











































































































Kompozisyon:
Uygulama:
Tedavide kullanılır:
Oliinyk Elizabeth Ivanovna tarafından tıbbi olarak gözden geçirilmiştir, Eczane Son güncelleme: 26.06.2023

Dikkat! Sayfadaki bilgiler sadece sağlık profesyonelleri içindir! Bilgi kamu kaynaklarında toplanır ve anlamlı hatalar içerebilir! Dikkatli olun ve bu sayfadaki tüm bilgileri tekrar kontrol edin!

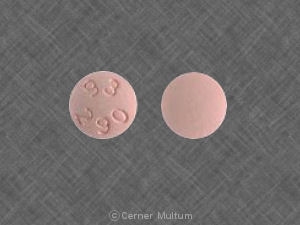
Budeprion XL

BUDEPRİON XL™ (bupropion hidroklorür genişletilmiş salımlı tabletler) 150 mg, beyazdan beyaza, yuvarlak, tablet baskılı “A101”ile. Bunlar aşağıdaki gibi tedarik edilir:
30 NDC'LİK şişeler # 0093-5350-56
500 NDC'LİK şişeler # 0093-5350-05
20 ° ila 25°C'de (68° ila 77°F) saklayın.
* Aşağıdaki ilgili üreticilerin tescilli ticari markalarıdır:
ZYBAN®, WELLBUTRİN® ve WELLBUTRİN SR® / GlaxoSmithKline.
Tarafından üretilmiştir: Anchen Pharmaceuticals Inc., Irvine, CA 92618. İmal
için: Teva Pharmaceuticals ABD, Sellersville, PA 18960. Rev. B 8/2007. FDA revizyonu
tarih: n / a

Majör Depresif Bozukluk
BUDEPRİON XL™ (bupropion hidroklorür genişletilmiş salımlı tabletler) majör depresif bozukluğun tedavisi için endikedir. Bupropionun majör depresif atak tedavisinde etkinliği yatarak tedavi gören iki haftada 4 kontrollü deneyler 6 hafta ve kurulan teşhisleri en yakın olan ayaktan hastaların kontrollü çalışması APA tanı ve İstatistik el kitabının (DSM) majör depresyon kategorisi) (görmek Klinik Çalışmalar).
Majör depresif atak (DSM-IV), 1) depresif ruh halinin varlığını ima eder veya 2) ilgi veya zevk kaybı, ek olarak, Aşağıdakilerden en az 5'i semptomlar aynı 2 haftalık dönemde mevcuttu ve bir değişikliği temsil ediyor önceki işleyişten: depresif ruh hali, belirgin şekilde azalmış ilgi veya zevk normal aktivitelerde, kilo ve/veya iştahta önemli değişiklikler, uykusuzluk veya hipersomni, psikomotor ajitasyon veya gerilik, artan yorgunluk, duygular suçluluk veya değersizlik, yavaş düşünme veya konsantrasyon bozukluğu, intihar girişim veya intihar düşüncesi.
Bupropionun up için bir antidepresan yanıtının korunmasında etkinliği 8 haftalık akut tedaviyi takip eden 44 haftaya kadar plasebo kontrollü bir şekilde gösterilmiştir. bupropion'un sürekli salımlı formülasyonu ile deneme (bkz. Klinik Denemeler). Bununla birlikte, BUDEPRİON XL™ (bupropion hidroklorür genişletilmiş salımlı tabletler) kullanmayı seçen doktor) uzun süre düzenli olarak uzun süreli yararlılığını değerlendirmek gerekir bireysel hasta için ilaç.

Dozlama İle İlgili Genel Hususlar
BUDEPRİON XL™ ' in (bupropion hidroklorür genişletilmiş salımlı tabletler) bir şekilde uygulanması özellikle önemlidir nöbet riskini en aza indirgeme olasılığı daha yüksektir (bkz. UYARMALAR). Kademeli tırmanma dozajda ajitasyon, motor huzursuzluk ve uykusuzluk da önemlidir, genellikle tedavinin ilk günlerinde görülen, en aza indirilmelidir. Gerekirse, bu etkiler, dozun geçici olarak azaltılması veya kısa süreli olarak yönetilebilir. uzun etkili sedatif hipnotik için bir ara uygulama. Sakinleştirici hipnotik genellikle tedavinin ilk haftasından sonra gerekli değildir. Uykusuzluk yatmadan önce dozlardan kaçınarak da en aza indirilebilir. Üzücü ise, istenmeyen etkiler supervene, doz artışı durdurulmalıdır. BUDEPRİON XL™ (bupropion hydrochloride extended-release tabletler) olmalıdır yutulmak ve ezilmiş değil, bölünmüş, ya da çiğnenmiş. BUDEPRİON XL™ (bupropion hidroklorür genişletilmiş salımlı tabletler) yemeklere bakılmaksızın alınmalı
Majör Depresif Bozukluk
İlk Tedavi
BUDEPRİON XL™ (bupropion hidroklorür genişletilmiş salımlı tabletler) için normal yetişkin hedef dozu, bir kez verilen 300 mg / gün'dür sabahları her gün. BUDEPRİON XL™ (bupropion hidroklorür genişletilmiş salımlı tabletler) ile dozaj 150 mg / gün ile başlamalıdır sabahları tek bir günlük doz olarak verilir. 150 mg başlangıç dozu yeterli ise tolere edilen, günde bir kez verilen 300 mg/gün hedef dozuna bir artış olabilir dozajın 4. günü kadar erken yapılmalıdır. En az bir aralık olmalıdır Ardışık dozlar arasında 24 saat.
Dozajı 300 mg / gün'ün üzerine çıkarmak
Diğer antidepresanlarda olduğu gibi, BUDEPRİON'UN tam antidepresan etkisi XL™, 4 haftalık tedaviye veya daha uzun bir süreye kadar belirgin olmayabilir. Artma tek bir doz olarak verilen maksimum 450 mg/gün dozajında düşünülebilir birkaç hafta sonra klinik iyileşme görülmeyen hastalar için 300 mg / gün tedavi.
Bakım Tedavisi
Genellikle akut depresyon ataklarının birkaç ay sürdüğü kabul edilir veya akut yanıtın ötesinde uzun süreli farmakolojik tedavi bölüm. BUDEPRİON XL™ (bupropion hidroklorür genişletilmiş salımlı tabletler) dozunun gerekli olup olmadığı bilinmemektedir. idame tedavisi için bir başlangıç elde etmek için gerekli doz ile aynıdır yanıt. Hastalar, ihtiyacı belirlemek için periyodik olarak yeniden değerlendirilmelidir idame tedavisi ve bu tedavi için uygun doz.
Hastaları Bupropion hidroklorür Tabletlerinden veya Bupropion'dan değiştirme Hidroklorür Sürekli Salımlı Tabletler
Hastaları bupropion hidroklorür tabletlerinden BUDEPRİON XL™ ' e değiştirirken veya bupropion hidroklorür sürekli salımlı tabletlerden BUDEPRİON XL™ ' ye (bupropion hidroklorür genişletilmiş salımlı tabletler) , mümkün olduğunda aynı toplam günlük dozu verin. Şu anda olan hastalar bupropion hidroklorür tabletleri ile 300 mg / gün (örneğin, 100 günde 3 kez mg) BUDEPRİON XL (bupropion hydrochloride extended-release tablets) ™ 300 mg'a günde bir kez değiştirilebilir. Şu anda bupropion hidroklorür ile tedavi edilen hastalar sürekli salımlı tabletler 300 mg/gün (örneğin, günde iki kez 150 mg) BUDEPRİON'A değiştirilebilir XL ™ 300 mg günde bir kez
Böbrek Fonksiyonu Bozulmuş Olan Hastalar için doz Ayarlaması
BUDEPRİON XL™ (bupropion hydrochloride extended-release tablets), şiddetli vakaları olan hastalarda çok dikkatli kullanılmalıdır. karaciğer sirozu. Bu dozlarda doz her gün 150 mg'ı geçmemelidir. hastalar. BUDEPRİON XL™ (bupropion hidroklorür genişletilmiş salımlı tabletler) hepatik hastalarda dikkatli kullanılmalıdır karaciğer fonksiyon bozukluğu (hafif ila orta derecede karaciğer sirozu dahil) ve düşük frekans hafif ila orta derecede karaciğer sirozu olan hastalarda ve / veya doz dikkate alınmalıdır (görmek KLİNİK FARMAKOLOJİ, UYARMALAR, ve TEDBİRLER).
Böbrek fonksiyon bozukluğu olan hastalar için doz ayarlaması
BUDEPRİON XL™ (bupropion hidroklorür genişletilmiş salımlı tabletler) böbrek yetmezliği olan hastalarda dikkatli kullanılmalıdır ve azaltılmış bir frekans ve / veya doz düşünülmelidir (bkz. KLİNİK FARMAKOLOJİ ve TEDBİRLER).

BUDEPRİON XL™ (bupropion hidroklorür genişletilmiş salımlı tabletler) nöbet bozukluğu olan hastalarda kontrendikedir.
BUDEPRİON XL™, ZYBAN ® ile tedavi edilen hastalarda kontrendikedir veya bupropion hidroklorür sürekli salımlı tabletler, WELLBUTRİN® veya bupropion hidroklorür anında salımlı formülasyon, WELLBUTRİN SR® veya bupropion hidroklorür sürekli salımlı formülasyon veya aşağıdakileri içeren diğer ilaçlar bupropion çünkü nöbet insidansı doza bağımlıdır.
BUDEPRİON XL™ (bupropion hidroklorür genişletilmiş salımlı tabletler), mevcut veya önceki hastalarda kontrendikedir daha yüksek nöbet insidansı nedeniyle bulimia veya anoreksiya nervoza tanısı hemen serbest bırakma formülasyonu ile bulimia için tedavi edilen hastalarda not edilir bupropion'dan.
BUDEPRİON XL™ (bupropion hidroklorür genişletilmiş salımlı tabletler) ani kesilme geçiren hastalarda kontrendikedir alkol veya sakinleştiriciler (benzodiazepinler dahil).
BUDEPRİON XL™ (bupropion hidroklorür genişletilmiş salımlı tabletler) ve bir monoamin oksidazın eşzamanlı uygulanması (MAO) inhibitörü kontrendikedir. İlacın kesilmesi arasında en az 14 gün geçmelidir bir MAO inhibitörü ve BUDEPRİON XL™ (bupropion hidroklorür genişletilmiş salımlı tabletler) ile tedavinin başlatılması.
BUDEPRİON XL™ (bupropion hidroklorür genişletilmiş salımlı tabletler) alerjik reaksiyon gösteren hastalarda kontrendikedir. bupropion veya BUDEPRİON XL™ (bupropion hidroklorür genişletilmiş salımlı tabletler) oluşturan diğer bileşenlere tepki.

UYARMALAR
Klinik kötüleşme ve intihar riski
Hem yetişkin hem de pediatrik majör depresif bozukluğu (MDD) olan hastalar depresyonlarının kötüleşmesi ve/veya intihar düşüncesinin ortaya çıkması ve davranış (intihar) veya davranışta olağandışı değişiklikler olsun ya da olmasın antidepresan ilaçlar alıyor ve bu risk önemli olana kadar devam edebilir remisyon oluşur. İntihar depresyonun bilinen bir risk ve diğer bazı psikiyatrik bozukluklar ve bu bozuklukların kendileri intiharın en güçlü belirleyicileridir. Bununla birlikte, antidepresanların sahip olabileceği uzun süredir devam eden bir endişe vardır depresyonun kötüleşmesine ve intiharın ortaya çıkmasına neden olan bir rol bazı hastalarda tedavinin erken evrelerinde. Birleştirilmiş analizler antidepresan ilaçların kısa süreli plasebo kontrollü denemeleri (Ssrı'lar ve diğerleri) bu ilaçların intihar düşünme ve davranış riskini artırdığını gösterdi (intihar) çocuklarda, ergenlerde ve genç yetişkinlerde (18 ila 24 yaş arası) majör depresif bozukluk (MDD) ve diğer psikiyatrik bozukluklar. Kısa vadeli çalışmalar antidepresanlarla intihar riskinde bir artış göstermedi 24 yaşın üzerindeki yetişkinlerde plasebo ile karşılaştırıldığında, antidepresanlarda bir azalma vardı 65 yaş ve üstü yetişkinlerde plasebo ile karşılaştırıldığında
Çocuk ve ergenlerde plasebo kontrollü çalışmaların birleştirilmiş analizleri MDD, obsesif kompulsif bozukluk (OKB) veya diğer psikiyatrik bozukluklarla 4400'den fazla 9 antidepresan ilacın toplam 24 kısa süreli çalışmasını içeriyordu hastalar. MDD'Lİ erişkinlerde plasebo kontrollü çalışmaların birleştirilmiş analizleri veya diğer psikiyatrik bozukluklar toplam 295 kısa süreli çalışmayı içeriyordu (medyan 77.000'den fazla hastada 11 antidepresan ilacın süresi 2 aydır. Orada uyuşturucu arasında intihar riskinde önemli bir değişiklik oldu, ancak bir eğilim çalışılan hemen hemen tüm ilaçlar için genç hastalarda bir artışa doğru. Orada farklı endikasyonlarda mutlak intihar riskinde farklılıklar var mıydı, MDD'DE en yüksek insidans ile. Bununla birlikte, risk farklılıkları (ilaç ve plasebo), yaş tabakaları içinde ve endikasyonlar arasında nispeten stabildi. Bu risk farklılıklar (intihar vakalarının sayısında ilaç-plasebo farkı Tedavi edilen 1000 hasta) Tablo 1.
1 Tablo.
| Yaş Aralığı | Vaka sayısındaki ilaç-plasebo farkı tedavi edilen 1000 hasta başına intihar |
| Plaseboya kıyasla artar | |
| < 18 | 14 ek vaka |
| 18 için 24 | 5 ek durum |
| Plasebo ile karşılaşıldığında azalır | |
| 25 için 64 | 1 daha az vaka |
| ≥ 65 | 6 daha az vaka |
Pediatrik denemelerin hiçbirinde intihar olmadı. İntiharlar vardı. yetişkin denemeleri, ancak sayı herhangi bir sonuca ulaşmak için yeterli değildi uyuşturucunun intihar üzerindeki etkisi hakkında.
İntihar riskinin daha uzun süreli kullanım için geçerli olup olmadığı bilinmemektedir, yani., birkaç ay ötesinde. Bununla birlikte, plasebo kontrolünden önemli kanıtlar vardır depresyonu olan yetişkinlerde antidepresanların kullanımı ile ilgili bakım çalışmaları depresyonun nüksetmesini geciktirebilir.
Herhangi bir endikasyon için antidepresan ile tedavi edilen tüm hastalar klinik iyileştirme, intihar eğil için uygun şekilde izlenmeli ve yakından izlenmeli, ve davranışta olan değişiklikler, özellikle ilk birkaç ay boyu ilaç tedavisinin seyri veya doz değişimleri sırasında artar veya azalır.
Aşağıdaki belirtiler, anksiyete, ajitasyon, panik atak, uykusuzluk, sinirlilik, düşmanlık, saldırganlık, dürtüsellik, akatizi (psikomotor huzursuzluk), yetişkin ve pediatrik hastalarda hipomani ve mani bildirilmiştir. majör depresif bozukluk için antidepresanlar ile tedavi yanı sıra diğer göstergeler, hem psikiyatrik ve nonpsychiatric. Arasında, ancak nedensel bir bağlantı bu semptomların ortaya çıkması ve depresyonun kötüleşmesi ve / veya intihar dürtülerinin ortaya çıkışı kurulmamıştır, endişe vardır bu tür semptomlar ortaya çıkan intiharın habercilerini temsil edebilir.
Göz tedavi rejimi değiştirmek için verilmeli dahil depresyonu kalıcı olan hastalarda ilacı almayı bırakmak mümkündür daha da kötüsü, ya da acil intihar ya da semptomlar yaşayanlar kötüleşen depresyon veya intiharın öncüleri, özellikle de bu belirtiler şiddetli, ani başlangıçlı veya hastanın semptomlarının bir parçası değildi.
Antidepresanlar ile tedavi edilen hastaların aileleri ve bakıcıları majör depresif bozukluk veya diğer endikasyonlar, hem psikiyatrik hem de psikiyatrik olmayan, ajitasyonun ortaya çıkması için hastaları izleme ihtiyacı konusunda uyarılmalıdır, sinirlilik, davranış değişikliği ve açık olan diğer tanımlar yukarıda, intiharın ortaya çıkmasının yanı sıra, bu tür semptomları rapor etmek hemen sağlık hizmeti sağlayıcılarına. Bu izleme günlük gözlemeli aileler ve bakıcılar tarafından. BUDEPRİON XL™ (bupropion hydrochloride extended-release tabletler) için reçeteler iyi bir hastaya karşılık gelen en az sayıda tablet için yazılmalıdır aşırı doz riskini azaltmak için yönetim.
Bipolar bozukluk için hastaların taranması
Majör depresif atak bipolar bozukluğun ilk belirtisi olabilir. Genel olarak (kontrollü çalışmalarda kurulmamış olsa da) inanılmaktadır böyle bir atağı tek başına bir antidepresan ile tedavi etmek olasılığı artırabilir bipolar bozukluk için risk altındaki hastalarda karışık / manik bir atağın çökelmesi. Yukarıda açıklanan belirtilerden herhangi birinin böyle bir dönüşümü temsil edip etmediği bilinmemektedir. Bununla birlikte, bir antidepresan ile tedaviye başlamadan önce, hastalar depresif belirtiler olup olmadıklarını belirlemek için yeterince taranmalıdır. bipolar bozukluk için risk, böyle bir tarama detaylı bir psikiyatrik içermelidir ailede intihar, bipolar bozukluk ve depresyon öyküsü de dahil olmak üzere tarih. BUDEPRİON XL™ ' in (bupropion hidroklorür genişletilmiş salımlı tabletler) tedavide kullanım için onaylanmadığına dikkat edilmelidir bipolar depresyon
Hastalar BUDEPRİON XL™ ' in aynı şeyi içerdiğini bilmelidir zyban ® veya bupropion hidroklorürde bulunan aktif bileşen kalıcı salımlı sigara bırakma tedavisine yardımcı olarak kullanılan tabletler ve bu BUDEPRİON XL™, ZYBAN® veya bupropion hidroklor ile kombinasyon halinde kullanılmamalıdır sürekli salımlı tabletler veya bupropion ıçeren diğer ilaçlar, WELLBUTRİN SR veya bupropion hidroklor sürekli salımlı formülasyon gibi, ve WELLBUTRİN veya bupropion hidroklor derhal serbest bırakma formu.
Nöbetler
Bupropion, doza bağlı nöbet riski ile ilişkilidir. Riskli nöbetler ayrıca hasta faktörleri, klinik durumlar ve eşlikçi hastalarla da ilişkilidir. tedavi için hasta seçiminde dikkate alınması gereken ilaçlar BUDEPRİON XL™ (bupropion hidroklor genişlemiş salımlı tabletler). BUDEPRİON XL™ (bupropion hidroklor genişletilmiş salımlı tabletler) kesilmeli ve yeniden başlatılmamalıdır tedavi sırasında nöbet geçen hastalarda.
BUDEPRİON XL™ (bupropion hidroklor genişlemiş salımlı tabletler), hem hemen salımlı formülasyona biyoeşdedir bupropion ve bupropion kalıcı salım formu, nöbet BUDEPRİON XL™ (bupropion hidroklor genişletilmiş salımlı tabletler) ile ınsidans, klinik olarak resmi olarak değerlendirilmemekle birlikte denemeler, hemen serbest bırakılması için aşağıda sunulan benzer olabilir ve bupropion'un sürekli salımlı formları.
- Doz: sürekli salımlı formülasyonun 300 mg / gün kadar olan dozlarda bupropion'da nöbet insidansı %0.1'dir (1/1,000).
Bupropion'un hemen salınan formu için veriler bir nöbet ortaya çıktı insidansı %0.4'tür (yani, prospektif olarak takip edilen 3.200 hastanın 13'ü) 300 ila 450 mg / gün aralığında dozlarda tedavi edilen hastalarda. Bu nöbet insidansı (%0.4), pazarlanan diğer bazı antidepresanların değerini aşabilir.
Bupropion'un derhal serbest bırakılması için birikmiş ek veriler tahmini sıfır insidansının yaklaşık on kat arttığı ön sürülmüş. 450 ve 600 mg / gün. 600 mg dozdan iki kez olagan yetişkin doz ve ve önerilen maksimum günlük dozun üçte biri (450 mg) BUDEPRİON XL™ (bupropion hidroklor genişlemiş salımlı tabletler). Doz artı ile nöbet içinde orantısız bir artı dozajda dikkatlı olması gerekir.
- Hasta faktörleri: nöbet riskini artırabilecek predispozan faktörler bupropion kullanımı ile kafa travması veya önceki nöbet hikayesi, merkezi sinir sistemi (CNS) tümörü, şiddetli karaciger sirozu varlığı ve sıfır eşiğini düşünen eşlikçi ilaçlar.
- Klinik durumlar: artmış nöbet ile ilişkili durumlar risk, diğerlerinin yan sıra, aşırı alkol veya sakinleştirici kullanımını (dahil benzodiazepinler), Afyon, kokain veya uyarıcılara bağlanma, recetesiz kullanım uyarıcılar ve anorektikler ve oral hipoglisemik ile tedavi edilebilir diyabetveya insülin.
- Eşlik eden ilaçlar: birçok ilaç (örneğin, antipsikotikler, antidepresanlar, teofilin, sistemik steroidler) nöbet eşiğini düşürdüğü bilinmektedir.
Nöbet riskini azaltmak için öneriler
Gelişim sırasında kazanılanın klinik deneyimin retrospektif analizi bupropion, nöbet riskinin şu durumlarında en aza indirilebileceğini göstermektedir
- BUDEPRİON XL™ ' in genel günlük dozu (bupropion hidroklor genişletilmiş salımlı tabletler) değil 450'yi AŞ mg,
- doz artan hızlı kademeli olarak gerçekleşir.
BUDEPRİON XL™ (bupropion hidroklor genişletilmiş salımlı tabletler) hastalara çok dikkatlı uygulamalıdır nöbet hikayesi, kranial travma veya diğer yatkın(lar) ile nöbet veya diğer ilaçlarla tedavi edilen hastalar (örneğin, antipsikotikler, Diğer İlaçlar). antidepresanlar, teofilin, sistemik steroidler, vb. bu daha düşük sıfır eşiği.
Karaciğer Yetmezliği
BUDEPRİON XL™ (bupropion hidroklor genişletilmiş salımlı tabletler), şiddetli karaciger sirozu. Bu hastalıklarda düşük frekans ve / veya doz bupropion zirvesinin yan sıra AUC seviyeleri önemli ölçüde arttığından gereklidir ve birikimin bu tür hastalarda daha büyük ölçülerde ortaya çıkması çok önemlidir. olagan. Bu hastalarda doz her gün 150 mg'ı geçmemelidir (bkz. Klinik farmakoloji, öneriler ve dozaj VE YÖNETİM).
Hepatotoksisite potansiyeli
Kronik olarak büyük dozlarda bupropion alan sıçanlarda bir artış oldu hepatik hiperplastik nodüller ve hepatoselüler hipertrofi insidansında. Kronik olarak büyük dozlarda bupropion alan köpeklerde çeşitli histolojik değişiklikler meydana gelir karaciğerde görüldü ve laboratuvar testleri hafif hepatoselüler olduğunu gösterdi yaralanma kaydedildi.
TEDBİRLER
Genel
Ajitasyon ve uykusuzluk
Artan huzursuzluk, ajitasyon, anksiyete ve uykusuzluk, özellikle kısa bir süre tedavinin başlamasından sonra, bupropion ile tedavi ile ilişkili olmuştur. Majör depresif bozukluğun plasebo kontrollü çalışmalarında hastalar bupropionun sürekli salınımlı formülasyonu, deneyimli ajitasyon, anksiyete, ve uykusuzluk gösterildiği gibi Tablo 2.
Tablo 2. Ajitasyon, anksiyete ve uyku ınsidansı
Bupropionun kalıcı salınımlı Formülasyonunun plasebo kontrol çalışmaları
Majör Amortisör Bozukluk
| Olumsuz Olay Takım |
Sürekli serbest bırakma formülasyon bupropion 300 mg / gün (n = 376) |
Sürekli serbest bırakma formülasyon bupropion 400 mg / gün (n = 114) |
Plasebo (n = 385) |
| Ajitasyon | 3% | 9% | 2% |
| Anksiyete | 5% | 6% | 3% |
| Uykusuzluk | 11% | 16% | 6% |
Majör depresif bozukluğun klinik çalışmalarında, bu semptomlar bazen sedatif / hipnotik ilaçlarla tedavi gerektirecek kadar büyük.
Bu çalışmalardaki semptomlar, ilacın kesilmesini gerektirecek kadar şiddetliydi sırasıyla 300 ve 400 mg/gün ile tedavi edilen hastaların %1 ve %2.6'sında tedavi, bupropion sürekli salımlı tabletler ve plasebo ile tedavi edilen hastaların %0.8'i.
Psikoz, konfüzyon ve diğer Nöropsikiyatrik fenomenler
Bupropion ile tedavi edilen depresif hastaların çeşitli olduğu bildirilmiştir sanrılar, halüsinasyonlar dahil olmak üzere nöropsikiyatrik belirti ve semptomların, psikoz, konsantrasyon bozukluğu, paranoya ve kafa karışıklığı. Bazı durumlarda, bu semptomlar doz azaltımı ve/veya tedavinin geri çekilmesi üzerine azalmıştır.
Psikoz ve/veya Maninin aktivasyonu
Antidepresanlar bipolar bozukluk hastalarında manik atakları tetikleyebilir depresif fazda, hastalıkları da gizli psikozu aktive edebilir diğer duyarlı hastalarda. BUDEPRİON XL™ ' in (bupropion hydrochloride extended-release tablets) benzer poz vermesi bekleniyor riskler.
İştah ve kilo değişikliği
Sürekli salım kullanarak majör depresif bozukluk plasebo kontrollü çalışmalarda bupropion formülasyonu, hastalar kilo alımı veya kilo kaybı yaşadı gösterilen Tablo 3.
Tablo 3. Plasebo kontrollü kilo alımı ve kilo kaybı ınsidansı
Majör depresif bozulma için Bupropionun sürekli salınımlı Formülasyonunun testleri
| Ağırlık Değişimi | Sürekli serbest bırakma bupropion formu 300 mg / gün (n = 339) |
Sürekli serbest bırakma bupropion formu 400 mg / gün (n = 112) |
Plasebo (n = 347) |
| Kazanılan > 5 lbs | 3% | 2% | 4% |
| Kayıp > 5 lbs | 14% | 19% | 6% |
Bupropion'un derhal salınan formülasyonu ile yapılan çalışmalarda, 35% trisiklik antidepresanlar alan hastaların 9'una kıyasla kilo aldı% bupropion'un derhal salınan formülasyonu ile tedavi edilen hastaların. Eğer kilo kaybı, hastanın depresif hastalığının ana belirtisidir. BUDEPRİON XL™ ' in (bupropion hidroklorür genişletilmiş salımlı tabletler) anorektik ve/veya ağırlık azaltma potansiyeli olmalıdır düşünülen.
Alerjik Reaksiyonlar
Kaşıntı gibi semptomlarla karakterize anafilaktoid / anafilaktik reaksiyonlar, ürtiker, anjiyoödem ve tıbbi tedavi gerektiren dispne bildirilmiştir bupropion ile klinik çalışmalarda. Buna ek olarak, nadir spontan olmuştur Lyell, Stevens-Johnson sendromu, raporlar pazarlama sonrası ve bupropion ile ilişkili anafilaktik şok. Bir hasta BUDEPRİON almayı bırakmalıdır XL™ ve alerjik veya anafilaktoid/anafilaktik yaşıyorsanız bir doktora danışın reaksiyonlar (örneğin, deri döküntüsü, kaşıntı, ürtiker, göğüs ağrısı, ödem ve nefes darlığı nefes) tedavi sırasında.
Artralji, miyalji ve döküntü ve gecikmeyi düşündüren diğer semptomlarla ateş bupropion ile birlikte aşırı duyarlılık bildirilmiştir. Bu belirtiler serum hastalığına benzeyebilir.
Kardiyovasküler Etkiler
Klinik uygulamada, hipertansiyon, bazı durumlarda şiddetli, akut tedavi gerektirir, bupropion ile tek başına ve kombinasyon halinde tedavi edilen hastalarda bildirilmiştir. nikotin replasman tedavisi. Bu olaylar her iki hastada da gözlenmiştir önceden var olan hipertansiyon kanıtı olan ve olmayan.
Bupropion'un sürekli salımlı formülasyonunun karşılaştırmalı bir çalışmasından elde edilen veriler, nikotin transdermal sistemi (NTS), sürekli salımlı bupropion kombinasyonu ayrıca NTS ve plasebo, sigarayı bırakmaya yardımcı olarak daha yüksek bir insidans olduğunu göstermektedir tedavi-kombinasyon ile tedavi edilen hastalarda acil hipertansiyon sürekli salımlı bupropion ve NTS. Bu çalışmada, 6.Tedavi edilen hastaların %1'i sürekli salımlı bupropion ve NTS kombinasyonu ile tedavi-acil 2 ile karşılaştırıldığında hipertansiyon.5%, 1.%6 ve %3.Sürekli salım ile tedavi edilen hastaların %1'i bupropion, NTS ve plasebo sırasıyla. Bu hastaların çoğunluğu vardı önceden var olan hipertansiyonun kanıtı. Üç hasta (1.2%) ile tedavi zyban® ve NTS ve 1 Hastanın kombinasyonu (0.4%) NTS ile tedavi edildi çalışma, hastaların hiçbirine kıyasla hipertansiyon nedeniyle ilaç almayı bıraktı bupropion veya plasebo sürekli salımlı bir formülasyon ile tedavi edilir. İzleme kan basıncı kombinasyonu alan hastalarda tavsiye edilir bupropion ve nikotin replasmanı
BUDEPRİON XL™ ' in (bupropion hydrochloride extended-release tablets) güvenliğini sağlayan klinik bir deneyim yoktur) yakın zamanda miyokard enfarktüsü veya kararsız kalp öyküsü olan hastalarda hastalık. Bu nedenle, bu gruplarda kullanılıyorsa dikkatli olunmalıdır. Bupropion, daha önce gelişen depresif hastalarda iyi tolere edildi trisiklik antidepresanlar alırken ortostatik hipotansiyon ve ayrıca genellikle stabil konjestif olan 36 depresif yatarak hasta grubunda iyi tolere edilir (CHF kalp yetmezliği ). Bununla birlikte, bupropion sırtüstü bir artış ile ilişkiliydi chf'li hastaların çalışmasında kan basıncı, ilacın kesilmesine neden olur başlangıç hipertansiyonunun alevlenmesi için 2 hastada tedavi
Karaciğer Yetmezliği
BUDEPRİON XL™ (bupropion hydrochloride extended-release tablets), şiddetli vakaları olan hastalarda çok dikkatli kullanılmalıdır. karaciğer sirozu. Bu hastalarda, azaltılmış bir frekans ve / veya doz gereklidir. BUDEPRİON XL™ (bupropion hidroklorür genişletilmiş salımlı tabletler) karaciğer yetmezliği olan hastalarda dikkatli kullanılmalıdır (hafif ila orta derecede karaciğer sirozu dahil) ve düşük frekans ve / veya hafif ila orta derecede karaciğer sirozu olan hastalarda doz düşünülmelidir.
Karaciğer yetmezliği olan tüm hastalar mümkün olduğunca yakından izlenmelidir yüksek ilaç ve metabolit seviyelerini gösterebilecek yan etkiler (bkz. KLİNİK FARMAKOLOJİ, UYARMALAR, ve DOZ VE YÖNETİM).
Böbrek Yetmezliği
Hastalarda bupropionun farmakokinetiği hakkında sınırlı bilgi vardır böbrek yetmezliği ile. Normal denekler ve denekler arasındaki İnter-study karşılaştırması son dönem böbrek yetmezliği olan hastalar, ana ilacın Cmax olduğunu göstermiştir ve AUC değerleri 2 grupta karşılaştırılabilir iken, hidroksibupropion ve threohydrobupropion metabolitleri 2.3 ve 2.Sırasıyla 8 kat artış, son dönem böbrek yetmezliği olan hastalar için AUC'DE. Bupropion yoğun olarak metabolize edilir karaciğerde, daha sonra metabolize olan ve daha sonra metabolize olan aktif metabolitlere böbrekler tarafından atılır. BUDEPRİON XL™ (bupropion hydrochloride extended-release tablets) aşağıdaki durumlarda dikkatli kullanılmalıdır: böbrek yetmezliği olan ve düşük frekans ve/veya dozu olan hastalar bupropion olarak kabul edilir ve bupropion metabolitleri aşağıdaki gibi birikebilir hastalar normalden daha büyük ölçüde. Hasta yakından izlenmelidir yüksek ilaç veya metabolit seviyelerini gösterebilecek olası yan etkiler için
Laboratuvar Testleri
Önerilen özel bir laboratuvar testi yoktur.
Karsinogenez, Mutajenez, doğurganlık bozukluğu
Sıçanlarda ve farelerde daha yüksek dozlarda yaşam boyu kanserojenlik çalışmaları yapıldı sırasıyla 300 ve 150 mg / kg / gün. Bu dozlar yaklaşık 7 ve Mg / m2'de sırasıyla önerilen maksimum insan dozunun (MRHD) 2 katı temel. Sıçan çalışmasında nodüler proliferatif lezyonlarda bir artış vardı karaciğerin 100 ila 300 mg/kg/gün dozlarında (yaklaşık 2 ila 7 kez Mg/m2 bazında MRHD), daha düşük dozlar test edilmedi. Sorusu ya da bu tür lezyonlar şu anda karaciğer neoplazmlarının öncüleri olabilir çözünmemiş. Fare çalışmasında benzer karaciğer lezyonları görülmedi ve artış olmadı her iki çalışmada da karaciğer ve diğer organların malign tümörleri görüldü
Bupropion pozitif bir yanıt üretti (2 ila 3 kat kontrol mutasyon oranı) Ames bakteriyel mutajenite testinde 5 suşun 2'sinde ve 3'ün 1'inde kromozomal sapmalar in vivo sıçan kemik iliği sitogenetik çalışıyor. Sıçanlarda 300 mg/kg/güne kadar olan dozlarda yapılan bir doğurganlık çalışması, bozulmuş doğurganlık kanıtı.
Gebelik
Teratojenik Etkiler
Gebelik kategorisi C
Sıçanlarda ve tavşanlarda yapılan çalışmalarda, bupropion oral yoldan uygulandı sırasıyla 450 ve 150 mg/kg/gün'e kadar olan dozlarda (yaklaşık 11 ve 7 kez mg/m2 bazında sırasıyla önerilen maksimum insan dozu [MRHD]), organogenez döneminde. Teratojenik aktiviteye dair net bir kanıt yok her iki türde de bulundu, ancak tavşanlarda insidans biraz arttı en düşük dozda fetal malformasyonlar ve iskelet varyasyonları gözlendi test edilmiş (25 mg / kg / gün, yaklaşık olarak bir mg/m2bas üzerinde MRHD'YE eşit) ve daha fazla. Fetal ağırlıkta 50 mg/kg ve daha fazla azalma gözlendi. Ne zaman sıçanlara 300 mg/kg/gün'e kadar oral dozlarda bupropion uygulandı (yaklaşık olarak Çiftleşmeden önce ve hamilelik boyunca mg/m2 bazında MRHD'NİN 7 katı ve emzirme döneminde, yavruların gelişimi üzerinde belirgin bir yan etki yoktu.
Gebe kadınlarda bir çalışma yapılmıştır. Bu retrospektif, yönetilen bakım veri tabanı çalışması, genel olarak konjenital malformasyon ve kardiyovasküler hastalık riskini değerlendirdi özellikle malformasyonlar, ilk trimesterde bupropion'a maruz kaldıktan sonra diğer antidepresanlara maruz kaldıktan sonra bu malformasyonların riski ile karşılaştırıldığında ilk trimesterde ve ilk trimesterin dışında bupropion. Bu çalışma hamilelik sırasında antidepresana maruz kalan 7,005 bebek, 1,213 ilk trimesterde bupropion'a maruz kalanlar. Çalışma hiçbir şey göstermedi genel olarak konjenital malformasyonlar veya kardiyovasküler malformasyonlar için daha büyük risk özellikle, bupropion maruziyetinin ilk trimesterinden sonra, Maruz kalmaya kıyasla ilk trimesterdeki diğer tüm antidepresanlara veya bupropion'a ilk üç aylık dönem. Bu çalışmanın sonuçları doğrulanmamıştır. BUDEPRİON XL™ hamilelik sırasında sadece potansiyel fayda haklı çıkarsa kullanılmalıdır fetus için potansiyel risk
Emek ve teslimat
BUDEPRİON XL™ ' in (bupropion hydrochloride extended-release tablets) insanlarda doğum ve doğum üzerindeki etkisi bilinmemektedir.
Emziren Anneler
Diğer birçok ilaç gibi, bupropion ve metabolitleri de insanlarda salgılanır. süt. Emziren bebeklerde ciddi advers reaksiyon potansiyeli nedeniyle BUDEPRİON XL™ ' den (bupropion hydrochloride extended-release tablets) , Hemşireliği bırakmaya değip değmeyeceğine karar verilmelidir veya ilacın önemini dikkate alarak ilacı bırakmayın. anne.
Pediatrik Kullanım
Pediatrik popülasyonda güvenlik ve etkinlik belirlenmemiştir (görmek KUTULU UYARİ ve UYARMALAR, Klinik iyileştirme ve intihar riski). BUDEPRİON kullanımını düşünen var mı Bir çocuk veya ergen XL™ ile potansiyel riskleri dengelemek gerekir klinik ihtiyaç.
Geriatrik Kullanım
Klinik çalışmalara katılan yaklaşık 6.000 hastanın bupropion sürekli salımlı tabletler (depresyon ve sigara bırakma çalışmaları), 275 65 yaşındaydı ve 47 75 yaşındaydı. Buna ek olarak, birkaç 65 yaş ve üstü yüz hasta, hemen salınımı kullanarak klinik çalışmalara katıldı bupropion formülasyonu (depresyon çalışmaları). Genel güvenlik farkı yok veya bu denekler ve genç denekler arasında etkinlik gözlendi. Bildirilen klinik deneyim, aralarındaki yanıtlarda farklılıklar tespit etmemiştir yaşlı ve genç hastalar, ancak bazı yaşlı bireylerin daha fazla duyarlılığı göz ardı edilemez
Tek doz farmakokinetik bir çalışma, bupropionun eğiliminin ve yaşlı deneklerdeki metabolitleri genç deneklerinkine benzerdi, bununla birlikte, başka bir farmakokinetik çalışma, tek ve çoklu doz, önerdi yaşlıların bupropion ve onun birikimi için artan risk altında olduğunu metabolitler (bkz. KLİNİK FARMAKOLOJİ).
Bupropion, karaciğerde aktif metabolitlere yoğun bir şekilde metabolize edilir böbrekler tarafından daha fazla metabolize edilir ve atılır. Toksik reaksiyon riski böbrek fonksiyon bozukluğu olan hastalarda bu ilaca daha fazla olabilir. Çünkü yaşlı hastaların böbrek fonksiyonlarında azalma olasılığı daha yüksektir, dikkatli olunmalıdır doz seçiminde alınmalı ve böbrek fonksiyonunu izlemek yararlı olabilir (bkz. TEDBİRLER, Börek Yetmezliği ve DOZAJ VE UYGULAMA).

YAN ETKİLER
(Ayrıca Bkz. UYARMALAR ve TEDBİRLER.)
Majör Depresif Bozukluk
BUDEPRİON XL™ ' in (bupropion hydrochloride extended-release tablets) benzer biyoyararlanıma sahip olduğu gösterilmiştir bupropion'un hemen serbest bırakma formülasyonuna ve sürekli serbest bırakma formülasyonuna bupropion formülasyonu (bkz. KLİNİK FARMAKOLOJİ). Bilgi bu alt bölümde yer alan, öncelikle kontrollü klinik verilere dayanmaktadır bupropion'un sürekli salımlı formülasyonu ile yapılan denemeler.
Tedavinin Kesilmesi için Acil İle Lider-olumsuz Olaylar Bülteni veya Bupropion'un sürekli Salımlı formülasyonları
Plasebo kontrollü klinik çalışmalarda, tedavi edilen hastaların %9'u ve %11'i Bupropion'un sürekli salımlı formülasyonunun sırasıyla 300 ve 400 mg/gün ve hastaların %4 plasebo ile tedavi kesilmeli nedeniyle olumsuz tedavi etkinlik. Bu çalışmalarda ilacın kesilmesine neden olan spesifik advers olaylar 300 mg/gün veya 400 mg/gün ile tedavi edilen hastaların en az %1'inde bupropionun sürekli salımlı formülasyonu ve en az iki kat daha yüksek bir oranda plasebo oranı listelenmiştir Tablo 4.
Tablo 4. Olumsuz Olaylar için tedavi Süreksizlikler Nedeniyle
plasebo kontrollü çalışmalarda
| Olumsuz Olay Takım |
Sürekli serbest bırakma formülasyonu bupropion 300mg / gün (n = 376) |
Sürekli serbest bırakma formülasyonu bupropion 400mg / gün (n = 114) |
Plasebo (n = 385) |
| Döküm | 2.4% | 0.9% | 0.0% |
| Bulantı | 0.8% | 1.8% | 0.3% |
| Ajitasyon | 0.3% | 1.8% | 0.3% |
| Migrenli | 0.0% | 1.8% | 0.3% |
Bupropion'un derhal salınan formülasyonu ile yapılan klinik çalışmalarda, 10% hastalar ve gönüllüler olumsuz bir olay nedeniyle durduruldu. Ortaya çıkan olaylar kesildiğinde, sürekli serbest bırakma için yukarıda listelenenlere ek olarak bupropion formülasyonu, kusma, nöbetler ve uyku bozukluklarını içerir.
Tedavi edilen hastalar arasında %1 veya daha fazla İnsidansta ortaya çıkan advers olaylar Bupropion'un derhal salınan veya sürekli salınan formülasyonları ile
Tablo 5 arasında meydana gelen tedavi-acil advers olayları numaralandırır 300 ve 400 mg/gün sürekli salımlı formülasyon ile tedavi edilen hastalar kontrollü çalışmalarda bupropion ve plasebo ile. Bu olayların yaşandığı 300 veya 400 mg/gün grubunda %1 veya daha fazla insidans vardı ve daha fazlaydı plasebo grubuna göre daha sık bulunur. Bildirilen yan etkiler şunlardı COSTART tabanlı bir sözlük kullanılarak sınıflandırılır.
Kullanımla ilişkili advers olayların insidansının doğru tahminleri herhangi bir ilacın elde edilmesi zordur. Tahminler ilaç dozundan etkilenir, algılama tekniği, ayar, doktor kararları, vb. Belirtilen rakamlar olamaz kursdaki istenmeyen olayların insidansını doğru bir şekilde tahmin etmek için kullanılabilir hasta özelliklerinin ve diğer faktörlerin farklı olduğu olağan tıbbi uygulamaların klinik çalışmalarda hakim olanlardan. Bu insidans rakamları da aşağıdakileri içeren diğer klinik çalışmalardan elde edilenlerle karşılaştırılamaz ilgili ilaç ürünleri her ilaç grubu olarak farklı bir ilaç denemeleri altında yürütülmektedir. koşullar kümesi
Son olarak, tablonun yansıtmadığını vurgulamak önemlidir olayların göreceli şiddeti ve / veya klinik önemi. Daha iyi bir bakış açısı bupropion kullanımı ile ilişkili ciddi yan etkiler sağlanır in the UYARMALAR ve TEDBİRLER bölmeler.
5 Tablo. Plasebo kontrol tedavi-acil advers olaylar
Denemeler*
| Vücut Sistemi / Olumsuz Olay | Sürekli serbest bırakma formülasyonu bupropion 300 mg / gün (n = 376) |
Sürekli serbest bırakma formülasyonu bupropion 400 mg / gün (n = 114) |
Plasebo (n = 385) |
| Vücut (Genel) | |||
| Ağrı | 26% | 25% | 23% |
| Enfeksiyon | 8% | 9% | 6% |
| Karın ağrısı | 3% | 9% | 2% |
| Asteni | 2% | 4% | 2% |
| Göğüs ağrısı | 3% | 4% | 1% |
| Ağrı | 2% | 3% | 2% |
| Ateş | 1% | 2% | -- |
| Kardiyovasküler sistem | |||
| Çarpıntı | 2% | 6% | 2% |
| Sifon | 1% | 4% | -- |
| Migrenli | 1% | 4% | 1% |
| Sıcak basması | 1% | 3% | 1% |
| Sindirim | |||
| Ağız kuruluşu | 17% | 24% | 7% |
| Bulantı | 13% | 18% | 8% |
| Kabızlık | 10% | 5% | 7% |
| Ishal | 5% | 7% | 6% |
| Anoreksiya | 5% | 3% | 2% |
| Kusan | 4% | 2% | 2% |
| Disfaji | 0% | 2% | 0% |
| Iskelet | |||
| Miyalji | 2% | 6% | 3% |
| Artralji | 1% | 4% | 1% |
| Artrit | 0% | 2% | 0% |
| Seğirme | 1% | 2% | -- |
| Sinir Sistemi | |||
| Uykusuzluk | 11% | 16% | 6% |
| Baş dönmesi | 7% | 11% | 5% |
| Ajitasyon | 3% | 9% | 2% |
| Anksiyete | 5% | 6% | 3% |
| Titreme | 6% | 3% | 1% |
| Sinirlilik | 5% | 3% | 3% |
| Uyku hali | 2% | 3% | 2% |
| Sinirlilik | 3% | 2% | 2% |
| Belli azaldı | -- | 3% | 1% |
| Parestezi | 1% | 2% | 1% |
| Merkezi sinir sistemi stimülasyonu | 2% | 1% | 1% |
| Solunum | |||
| Farenjit | 3% | 11% | 2% |
| Sinüzit | 3% | 1% | 2% |
| Artan öksürük | 1% | 2% | 1% |
| Cilt | |||
| Terleme | 6% | 5% | 2% |
| Döküm | 5% | 4% | 1% |
| Kaşıntı | 2% | 4% | 2% |
| Ürtiker | 2% | 1% | 0% |
| Özel duyular | |||
| Kulak çınlaması | 6% | 6% | 2% |
| Tat Sapık | 2% | 4% | -- |
| Tembellik | 3% | 2% | 2% |
| Genitoüriner sistem | |||
| İdrar sıklığı | 2% | 5% | 2% |
| İdrar Aciliyeti | -- | 2% | 0% |
| Vajinal | 0% | 2% | -- |
| Kanama† | |||
| İdrar yolu enfeksiyonu | 1% | 0% | -- |
| * En azından meydan gelen advers olaylar
300 veya 400 mg / gün sürekli salım ile tedavi edilen hastaların %1'i
bupropion formu, ancak plaseboda eşit veya daha sık
grup, şunlardi: anormal rüyalar, kazara yaralanma, akne, ıştah artisi,
sırt ağrısı, bronş, dismenore, dispepsi, şişkinlik, kavana sendrom,
hipertansiyon, boyun ağrısı, solunum bozukluğu, rinit ve diş bozukluğu. † İnsidans, kadın hasta sayısına bağlıdır. -- Tire, 0'dan daha büyük fakir daha az meydan gelen advers olayları gösterir hastaların %0.5'inden fazı. |
|||
Listede listelenenlere ek olaylar Tablo 5 bu bir insidansta meydana geldi hemen salınan formülasyonun kontrollü klinik çalışmalarında en az %1 bupropion (300 ila 600 mg / gün) ve sayısal olarak daha sıktı plasebo: kardiyak aritmiler (%5 vs %4), hipertansiyon (%4 vs %2), hipotansiyon (%3 vs %2), taşikardi (%11 vs %9), iştah artışı (%4 vs %2), dispepsi (%3 vs %2), adet şikayetleri (%5 vs %1), akatizi (%2 vs %1), bozulmuş uyku kalitesi( 4% vs 2%), duyusal bozukluk( 4 % vs 3%), karışıklık (8 % vs 5%), azalmış libido (%3'e karşı %2), düşmanlık (%6'ya karşı %4), işitsel bozukluk (%5% vs 3%) ve tat bozukluğu (3%vs 1%).
Kontrollü klinik çalışmalarda sık görülen advers olayların insidansı
Yan etkiler Tablo 5 tedavi edilen hastaların en az %5'inde görülür bupropion'un sürekli salımlı formülasyonu ile ve en az iki kez bir oranda plasebo oranı 300 ve 400 mg / gün doz grupları için aşağıda listelenmiştir.
Sürekli Salımlı Formülasyonun 300 mg/gün:Anoreksiya, kuru ağız, döküntü, terleme, kulak çınlaması ve titreme.
Sürekli Salımlı Formülasyonun 400 mg/gün: Karın ağrısı, ajitasyon, anksiyete, baş dönmesi, ağız kuruluğu, uykusuzluk, miyalji, bulantı, çarpıntı, farenjit, terleme, kulak çınlaması ve idrar sıklığı.
Klinik gelişim ve pazarlama sonrası deneyim sırasında gözlenen diğer olaylar Bupropion
Yukarıda belirtilen advers olaylara ek olarak, aşağıdaki olaylar olmuştur klinik çalışmalarda ve sürekli serbest bırakma ile pazarlama sonrası deneyimlerde bildirilmiştir depresyonlu hastalarda ve depresyonsuz sigara içenlerde bupropion formülasyonu, klinik çalışmalarda ve pazarlama sonrası klinik deneyimde olduğu gibi bupropion'un hemen serbest bırakma formülasyonu.
Aşağıdaki frekansların sağlandığı advers olaylar klinik olarak ortaya çıkmıştır bupropion'un sürekli salımlı formülasyonu ile yapılan denemeler. Frekans bu, acil tedavi gören hastaların oranını temsil eder. depresyon için plasebo kontrollü çalışmalarda en az bir kez olay (n = 987) veya sigarayı bırakma (n = 1,013) veya olumsuz bir deneyim yaşayan hastalar açık etiketli bir sürveyans çalışmasında tedavinin kesilmesini gerektiren olay bupropion'un sürekli salımlı formülasyonu ile (n = 3,100). Tüm tedavi-acil yan etkiler, listede listelenenler dışında dahil edilir Tablolar 2 arasında 5, güvenlikle ilgili diğer bölümlerde listelenen olaylar, bu olumsuz olaylar alt kümelenmiştir aşırı genel veya aşırı spesifik olan COSTART terimleri altında bilgilendirici olmamak için, bu olaylar makul bir şekilde kullanımla ilişkili değildir ve ciddi olmayan ve daha az meydana gelen olaylar 2 hasta. Büyük klinik öneme sahip olaylar UYARMALAR ve TEDBİRLER etiketleme bölümleri.
Olaylar ayrıca vücut sistemine göre kategorize edilir ve azalan sıraya göre listelenir frekans aşağıdaki frekans tanımlarına göre: sık olumsuz olaylar en az 1/100 hastada meydana gelen olaylar olarak tanımlanır. Nadir advers olaylar 1/100 ila 1/1, 000 hastada meydana gelenlerdir, nadir ise olaylar 1/1,000'den az hastada meydana gelen olaylardır.
Frekansların sağlanmadığı advers olaylar klinik bupropion ile denemeler veya pazarlama sonrası deneyim. Sadece bu olumsuz olaylar daha önce uzun süreli sürüm için listelenmemiş olan bupropion pakete dahildir. Alan bu olayların BUDEPRİON XL™ (bupropion hydrochloride extended-release tablets) ile ilişkili olabileceği bilinmemektedir.
Vücut (Genel): Nadiren titreme, yüz ödemi, kas-iskelet sistemi vardı göğüs ağrısı ve ışığa duyarlılık. Nadir kırıklık vardı. Artralji de gözlendi, miyalji, döküntü ve gecikmiş aşırı duyarlılığı düşündüren diğer semptomlarla ateş. Bu semptomlar serum hastalığına benzeyebilir (bkz. TEDBİRLER).
Kardiyovasküler sistem: Seyrek postural hipotansiyon, inme vardı, taşikardi ve vazodilatasyon. Nadir bayılma oldu. Ayrıca gözlemlenen tamamlandı atriyoventriküler blokaj, ekstrasistoller, hipotansiyon, hipertansiyon (bazı durumlarda şiddetli, bkz TEDBİRLER), miyokard enfarktüsü, flebit ve pulmoner emboli. Sindirim: Nadiren anormal karaciğer fonksiyonu vardı, bruksizm, gastrik reflü, diş eti iltihabı, glossit, artan salivasyon, sarılık, ağız ülseri, stomatit ve susuzluk. Nadir dil ödemi oldu. Ayrıca gözlemlendi kolit, özofajit, gastrointestinal kanama, diş eti kanaması, hepatit vardı, bağırsak perforasyonu, karaciğer hasarı, pankreatit ve mide ülseri.
Endokrin: Ayrıca hiperglisemi, hipoglisemi ve uygun olmayan antidiüretik hormon sendromu.
Hemik ve lenfatik: Seyrek olarak ekimoz vardı. Ayrıca gözlemlendi anemi, lökositoz, lökopeni, lenfadenopati, pansitopeni ve trombositopeni vardı. Değişmiş PT ve / veya INR, nadiren hemorajik veya trombotik ile ilişkili bupropion varfarin ile birlikte kullanıldığında komplikasyonlar gözlendi.
Metabolik ve beslenme: Nadiren ödem ve periferik ödem vardı ödem. Glikozüri de gözlendi.
Iskelet: Nadiren bacak krampları vardı. Ayrıca gözlemlendi kas sertliği / ateş/rabdomiyoliz ve kas güçsüzlüğü.
Sinir Sistemi: Nadiren anormal koordinasyon vardı, azaldı libido, duyarsızlaşma, disfori, duygusal kararsızlık, düşmanlık, hiperkinezi, hipertoni, hipestezi, intihar düşüncesi ve baş dönmesi. Nadir amnezi vardı, ataksi, derealizasyon ve hipomani. Anormal elektroensefalogram da gözlendi (EEG), saldırganlık, akinezi, afazi, koma, deliryum, sanrılar, dizartri, diskinezi, distoni, öfori, ekstrapiramidal sendrom, halüsinasyonlar, hipokinezi, artan libido, manik reaksiyon, nevralji, nöropati, paranoyak düşünce, huzursuzluk ve maskesiz tardif diskinezi.
Solunum: Nadir bronkospazm oldu. Pnömoni de gözlendi.
Cilt: Nadir makülopapüler döküntü oldu. Alopesi de gözlendi, anjiyoödem, eksfolyatif " > dermatit ve hirsutizm.
Özel Duyular: Nadiren konaklama anormalliği ve kuru göz. Ayrıca sağırlık, diplopi, artmış göz içi basıncı gözlendi, ve midriyazis.
Genitoüriner sistem: Nadiren iktidarsızlık, poliüri ve prostat vardı bozukluk. Ayrıca gözlenen anormal boşalma, sistit, disparoni, dizüri, jinekomasti, menopoz, ağrılı ereksiyon, salpenjit, idrar kaçırma, idrar retansiyonu ve vajinit.
Uyuşturucu Bağlılığı Ve Bağlılığı
Kontrollü Madde Sınıfı
Bupropion kontrollü bir madde değildir.
İnsanlar
Bupropion (anında serbest bırakma formülasyonu) ile ilgili kontrollü klinik çalışmalar yapılmıştır normal gönüllülerde, çoklu uyuşturucu bağımlılığı öyküsü olan deneklerde ve depresif hastalarda motor aktivite ve ajitasyon/heyecanda bir miktar artış gösterdi.
Kötüye kullanım ilaçları ile deneyimlenen bir birey popülasyonunda, tek bir doz 400 mg bupropion ile karşılaştırıldığında hafif amfetamin benzeri aktivite üretildi bağımlılık Araştırma Merkezi'nin morfin-Benzedrin alt ölçeğinde plasebo Envanterler (ARCI) ve plasebo ve amfetamin arasında bir ara puan ARCI beğenme ölçeğinde. Bu ölçekler genel öfori duygularını ölçer ve uyuşturucu arzu edilebilirliği.
Klinik bulgular, ancak, güvenilir bir şekilde tahmin etmek için bilinmemektedir uyuşturucu kötüye kullanma potansiyeli. Bununla birlikte, tek dozlu çalışmalardan elde edilen kanıtlar bupropionun önerilen günlük dozunu bölünmüş dozların amfetamin veya uyarıcı için özellikle takviye edici olması muhtemel değildir istismarcılar. Bununla birlikte, risk nedeniyle test edilemeyen daha yüksek dozlar nöbet, uyarıcı ilaçları kötüye kullananlar için mütevazı bir şekilde çekici olabilir.
Hayvancılıklar
Kemirgenler ve primatlarda çalışmalar bupropion bazı farmakolojik sergiler göstermiştir psikostimülanlar için ortak eylemler. Kemirgenlerde, arttığı gösterilmiştir lokomotor aktivite, hafif basmakalıp davranışsal bir tepki ortaya çıkarmak ve artırmak çeşitli program kontrollü davranış paradigmalarında yanıt verme oranları. Primatta psikoaktif ilaçların olumlu güçlendirici etkilerini değerlendirmek için modeller, bupropion intravenöz olarak kendi kendine uygulandı. Sıçanlarda, bupropion amfetamin benzeri üretti uyuşturucu ayrımcılığı paradigmalarında kokain benzeri ayrımcılık uyaran etkileri psikoaktif ilaçların öznel etkilerini karakterize etmek için kullanılır
İLAÇ ETKİLEŞİMLERİ
Bupropion metabolizması hakkında çok az sistemik veri toplanmıştır diğer ilaçlarla eşzamanlı uygulama veya alternatif olarak bupropionun diğer ilaçların metabolizması üzerine eşzamanlı uygulanması. Çünkü bupropion yoğun olarak metabolize edilir, diğer ilaçların birlikte uygulanması klinik aktivitesini etkiler. İn vitro çalışmalar bupropion olduğunu göstermektedir esas olarak cyp2b6 izoenzimi ile hidroksibupropiona metabolize edilir. Bu nedenle, BUDEPRİON XL™ (bupropion hidroklorür genişletilmiş salımlı tabletler) ve cyp2b6 izoenziminin substratları veya inhibitörleri olan ilaçlar (örneğin, orfenadrin, tiyotepa ve siklofosfamid). Ek olarak, in vitro çalışmalar o fluoksetin, sertraline, norfluoxetine ve Celexa gibi ilacı, ritonavir ve efavirenz, bupropionun hidroksilasyonunu inhibe eder. Klinik yok bu bulguyu değerlendirmek için çalışmalar yapılmıştır. Threohydrobupropion bupropion metaboliti sitokrom P450 tarafından üretilmiyor gibi görünüyor izoenzimler. Simetidin eşzamanlı uygulamasının farmakokinetik üzerindeki etkileri bupropion ve aktif metabolitleri 24 sağlıklı genç erkekte incelenmiştir gönüllülükler. İki 150 mg sürekli salımlı tabletin oral yoldan verilmesinden sonra 800 mg simetidin ile ve olmadan bupropion formülasyonu, farmakokinetik bupropion ve hidroksibupropion etkilenmedi. Ancak, %16 ve AUC ve C'de %32 artışmaksimum, sırasıyla, kombine parçalarının threohydrobupropion ve erythrohydrobupropion
Sistematik olarak çalışılmasa da, bazı ilaçlar metabolizmayı indükleyebilir bupropion (örneğin, karbamazepin, fenobarbital, fenitoin).
Birden fazla oral bupropion dozunun vücut üzerinde istatistiksel olarak anlamlı bir etkisi yoktu. 12 sağlıklı gönüllüde lamotrijinin tek doz farmakokinetiği.
Hayvan verileri, bupropionun ilaç metabolizmasının bir indükleyicisi olabileceğini göstermiştir insanlarda enzimler. Bir çalışmada, bupropionun kronik uygulamasını takiben, 14 gün boyunca 8 sağlıklı erkek gönüllüye günde 3 kez 100 mg, kendi metabolizmasının indüksiyonunun kanıtı. Yine de, olabilir birlikte uygulanan kan seviyelerinde klinik olarak önemli değişiklikler için potansiyel ilaçlar.
Sitokrom P450IID6 (CYP2D6) tarafından metabolize edilen ilaçlar)
Çoğu antidepresan (Ssrı'lar, birçok trisiklik), beta blokerler de dahil olmak üzere birçok ilaç, antiaritmikler ve antipsikotikler CYP2D6 izoenzimi tarafından metabolize edilir. Bupropion bu izoenzim, bupropion ve hidroksibupropion tarafından metabolize olmamasına rağmen CYP2D6 izoenziminin inhibitörleri mi in vitro. 15 erkek denek üzerinde yapılan bir çalışmada CYP2D6 izoenziminin geniş metabolizörleri olan (19 ila 35 yaş arası), günlük bupropion dozları günde iki kez 150 mg ve ardından tek bir doz olarak verilir 50 mg desipramin, Desipraminin Cmaksimum, AUC ve t½'sini arttırdı ortalama olarak, sırasıyla yaklaşık 2, 5 ve 2 kat.
Etki, bupropionun son dozundan en az 7 gün sonra mevcuttu. Bupropionun CYP2D6 tarafından metabolize edilen diğer ilaçlarla birlikte kullanılması oldu resmen okudu.
Bu nedenle, bupropionun metabolize edilen ilaçlarla birlikte uygulanması Bazı antidepresanlar (e) içeren CYP2D6 izoenzimi.bin dolar., nortriptilin, imipramin, desipramin, paroksetin, fluoksetin, sertralin), antipsikotikler( e.bin dolar., haloperidol, risperidon, tioridazin), beta blokerler( e.bin dolar., metoprolol) ve Tip 1C antiaritmikler (e.bin dolar. propafenon, flecainide), dikkatli bir şekilde ele alınmalı ve eşlik eden ilacın doz aralığının alt ucunda başlatılabilir. Bupropion zaten alan bir hastanın tedavi rejimine eklenirse CYP2D6 tarafından metabolize edilen bir ilaç, orijinalin dozunu azaltma ihtiyacı özellikle eşlik eden ilaçlar için ilaç tedavisi düşünülmelidir dar bir terapötik indeks ile
MAO inhibitörleri
Hayvanlarda yapılan çalışmalar, bupropionun akut toksisitesinin arttığını göstermektedir MAO inhibitörü phenelzine tarafından (bkz. KONTRENDİKASYONLAR).
Levodopa ve amantadine
Sınırlı klinik veriler, olumsuz deneyimlerin daha yüksek bir insidansını göstermektedir levodopa veya amantadin ile eşzamanlı olarak bupropion alan hastalar. Levodopa alan hastalara BUDEPRİON XL™ (bupropion hidroklorür genişletilmiş salımlı tabletler) uygulanması veya amantadin aynı anda küçük bir başlangıç kullanarak dikkatli bir şekilde yapılmalıdır dozlar ve kademeli doz artar.
Nöbet Eşiğini Düşüren İlaçlar
BUDEPRİON XL™ (bupropion hidroklorür genişletilmiş salımlı tabletler) ve ajanların (örneğin, antipsikotikler) eşzamanlı uygulanması, diğer antidepresanlar, teofilin, sistemik steroidler, vb.) bu daha düşük nöbet eşik sadece çok dikkatli yapılmalıdır (bkz. UYARMALAR). Düşük başlangıç dozu ve kademeli doz artışı kullanılmalıdır.
Nikotin Transdermal Sistemi
(görmek TEDBİRLER, Kardiyovasküler Etkiler).
Alkol
Pazarlama sonrası deneyim, olumsuz nöropsikiyatrik nadir raporlar olmuştur alkol kullanımı sırasında alkol alan hastalarda olaylar veya azaltılmış alkol toleransı bupropion ile tedavi. BUDEPRİON ile tedavi sırasında alkol tüketimi XL™ en aza indirilmeli veya kaçınılmalıdır (Ayrıca Bkz. KONTRENDİKASYONLAR).

Teratojenik Etkiler
Gebelik kategorisi C
Sıçanlarda ve tavşanlarda yapılan çalışmalarda, bupropion oral yoldan uygulandı sırasıyla 450 ve 150 mg/kg/gün'e kadar olan dozlarda (yaklaşık 11 ve 7 kez mg/m2 bazında sırasıyla önerilen maksimum insan dozu [MRHD]), organogenez döneminde. Teratojenik aktiviteye dair net bir kanıt yok her iki türde de bulundu, ancak tavşanlarda insidans biraz arttı en düşük dozda fetal malformasyonlar ve iskelet varyasyonları gözlendi test edilmiş (25 mg / kg / gün, yaklaşık olarak bir mg/m2bas üzerinde MRHD'YE eşit) ve daha fazla. Fetal ağırlıkta 50 mg/kg ve daha fazla azalma gözlendi. Ne zaman sıçanlara 300 mg/kg/gün'e kadar oral dozlarda bupropion uygulandı (yaklaşık olarak Çiftleşmeden önce ve hamilelik boyunca mg/m2 bazında MRHD'NİN 7 katı ve emzirme döneminde, yavruların gelişimi üzerinde belirgin bir yan etki yoktu.
Gebe kadınlarda bir çalışma yapılmıştır. Bu retrospektif, yönetilen bakım veri tabanı çalışması, genel olarak konjenital malformasyon ve kardiyovasküler hastalık riskini değerlendirdi özellikle malformasyonlar, ilk trimesterde bupropion'a maruz kaldıktan sonra diğer antidepresanlara maruz kaldıktan sonra bu malformasyonların riski ile karşılaştırıldığında ilk trimesterde ve ilk trimesterin dışında bupropion. Bu çalışma hamilelik sırasında antidepresana maruz kalan 7,005 bebek, 1,213 ilk trimesterde bupropion'a maruz kalanlar. Çalışma hiçbir şey göstermedi genel olarak konjenital malformasyonlar veya kardiyovasküler malformasyonlar için daha büyük risk özellikle, bupropion maruziyetinin ilk trimesterinden sonra, Maruz kalmaya kıyasla ilk trimesterdeki diğer tüm antidepresanlara veya bupropion'a ilk üç aylık dönem. Bu çalışmanın sonuçları doğrulanmamıştır. BUDEPRİON XL™ hamilelik sırasında sadece potansiyel fayda haklı çıkarsa kullanılmalıdır fetus için potansiyel risk

(Ayrıca Bkz. UYARMALAR ve TEDBİRLER.)
Majör Depresif Bozukluk
BUDEPRİON XL™ ' in (bupropion hydrochloride extended-release tablets) benzer biyoyararlanıma sahip olduğu gösterilmiştir bupropion'un hemen serbest bırakma formülasyonuna ve sürekli serbest bırakma formülasyonuna bupropion formülasyonu (bkz. KLİNİK FARMAKOLOJİ). Bilgi bu alt bölümde yer alan, öncelikle kontrollü klinik verilere dayanmaktadır bupropion'un sürekli salımlı formülasyonu ile yapılan denemeler.
Tedavinin Kesilmesi için Acil İle Lider-olumsuz Olaylar Bülteni veya Bupropion'un sürekli Salımlı formülasyonları
Plasebo kontrollü klinik çalışmalarda, tedavi edilen hastaların %9'u ve %11'i Bupropion'un sürekli salımlı formülasyonunun sırasıyla 300 ve 400 mg/gün ve hastaların %4 plasebo ile tedavi kesilmeli nedeniyle olumsuz tedavi etkinlik. Bu çalışmalarda ilacın kesilmesine neden olan spesifik advers olaylar 300 mg/gün veya 400 mg/gün ile tedavi edilen hastaların en az %1'inde bupropionun sürekli salımlı formülasyonu ve en az iki kat daha yüksek bir oranda plasebo oranı listelenmiştir Tablo 4.
Tablo 4. Olumsuz Olaylar için tedavi Süreksizlikler Nedeniyle
plasebo kontrollü çalışmalarda
| Olumsuz Olay Takım |
Sürekli serbest bırakma formülasyonu bupropion 300mg / gün (n = 376) |
Sürekli serbest bırakma formülasyonu bupropion 400mg / gün (n = 114) |
Plasebo (n = 385) |
| Döküm | 2.4% | 0.9% | 0.0% |
| Bulantı | 0.8% | 1.8% | 0.3% |
| Ajitasyon | 0.3% | 1.8% | 0.3% |
| Migrenli | 0.0% | 1.8% | 0.3% |
Bupropion'un derhal salınan formülasyonu ile yapılan klinik çalışmalarda, 10% hastalar ve gönüllüler olumsuz bir olay nedeniyle durduruldu. Ortaya çıkan olaylar kesildiğinde, sürekli serbest bırakma için yukarıda listelenenlere ek olarak bupropion formülasyonu, kusma, nöbetler ve uyku bozukluklarını içerir.
Tedavi edilen hastalar arasında %1 veya daha fazla İnsidansta ortaya çıkan advers olaylar Bupropion'un derhal salınan veya sürekli salınan formülasyonları ile
Tablo 5 arasında meydana gelen tedavi-acil advers olayları numaralandırır 300 ve 400 mg/gün sürekli salımlı formülasyon ile tedavi edilen hastalar kontrollü çalışmalarda bupropion ve plasebo ile. Bu olayların yaşandığı 300 veya 400 mg/gün grubunda %1 veya daha fazla insidans vardı ve daha fazlaydı plasebo grubuna göre daha sık bulunur. Bildirilen yan etkiler şunlardı COSTART tabanlı bir sözlük kullanılarak sınıflandırılır.
Kullanımla ilişkili advers olayların insidansının doğru tahminleri herhangi bir ilacın elde edilmesi zordur. Tahminler ilaç dozundan etkilenir, algılama tekniği, ayar, doktor kararları, vb. Belirtilen rakamlar olamaz kursdaki istenmeyen olayların insidansını doğru bir şekilde tahmin etmek için kullanılabilir hasta özelliklerinin ve diğer faktörlerin farklı olduğu olağan tıbbi uygulamaların klinik çalışmalarda hakim olanlardan. Bu insidans rakamları da aşağıdakileri içeren diğer klinik çalışmalardan elde edilenlerle karşılaştırılamaz ilgili ilaç ürünleri her ilaç grubu olarak farklı bir ilaç denemeleri altında yürütülmektedir. koşullar kümesi
Son olarak, tablonun yansıtmadığını vurgulamak önemlidir olayların göreceli şiddeti ve / veya klinik önemi. Daha iyi bir bakış açısı bupropion kullanımı ile ilişkili ciddi yan etkiler sağlanır in the UYARMALAR ve TEDBİRLER bölmeler.
5 Tablo. Plasebo kontrol tedavi-acil advers olaylar
Denemeler*
| Vücut Sistemi / Olumsuz Olay | Sürekli serbest bırakma formülasyonu bupropion 300 mg / gün (n = 376) |
Sürekli serbest bırakma formülasyonu bupropion 400 mg / gün (n = 114) |
Plasebo (n = 385) |
| Vücut (Genel) | |||
| Ağrı | 26% | 25% | 23% |
| Enfeksiyon | 8% | 9% | 6% |
| Karın ağrısı | 3% | 9% | 2% |
| Asteni | 2% | 4% | 2% |
| Göğüs ağrısı | 3% | 4% | 1% |
| Ağrı | 2% | 3% | 2% |
| Ateş | 1% | 2% | -- |
| Kardiyovasküler sistem | |||
| Çarpıntı | 2% | 6% | 2% |
| Sifon | 1% | 4% | -- |
| Migrenli | 1% | 4% | 1% |
| Sıcak basması | 1% | 3% | 1% |
| Sindirim | |||
| Ağız kuruluşu | 17% | 24% | 7% |
| Bulantı | 13% | 18% | 8% |
| Kabızlık | 10% | 5% | 7% |
| Ishal | 5% | 7% | 6% |
| Anoreksiya | 5% | 3% | 2% |
| Kusan | 4% | 2% | 2% |
| Disfaji | 0% | 2% | 0% |
| Iskelet | |||
| Miyalji | 2% | 6% | 3% |
| Artralji | 1% | 4% | 1% |
| Artrit | 0% | 2% | 0% |
| Seğirme | 1% | 2% | -- |
| Sinir Sistemi | |||
| Uykusuzluk | 11% | 16% | 6% |
| Baş dönmesi | 7% | 11% | 5% |
| Ajitasyon | 3% | 9% | 2% |
| Anksiyete | 5% | 6% | 3% |
| Titreme | 6% | 3% | 1% |
| Sinirlilik | 5% | 3% | 3% |
| Uyku hali | 2% | 3% | 2% |
| Sinirlilik | 3% | 2% | 2% |
| Belli azaldı | -- | 3% | 1% |
| Parestezi | 1% | 2% | 1% |
| Merkezi sinir sistemi stimülasyonu | 2% | 1% | 1% |
| Solunum | |||
| Farenjit | 3% | 11% | 2% |
| Sinüzit | 3% | 1% | 2% |
| Artan öksürük | 1% | 2% | 1% |
| Cilt | |||
| Terleme | 6% | 5% | 2% |
| Döküm | 5% | 4% | 1% |
| Kaşıntı | 2% | 4% | 2% |
| Ürtiker | 2% | 1% | 0% |
| Özel duyular | |||
| Kulak çınlaması | 6% | 6% | 2% |
| Tat Sapık | 2% | 4% | -- |
| Tembellik | 3% | 2% | 2% |
| Genitoüriner sistem | |||
| İdrar sıklığı | 2% | 5% | 2% |
| İdrar Aciliyeti | -- | 2% | 0% |
| Vajinal | 0% | 2% | -- |
| Kanama† | |||
| İdrar yolu enfeksiyonu | 1% | 0% | -- |
| * En azından meydan gelen advers olaylar
300 veya 400 mg / gün sürekli salım ile tedavi edilen hastaların %1'i
bupropion formu, ancak plaseboda eşit veya daha sık
grup, şunlardi: anormal rüyalar, kazara yaralanma, akne, ıştah artisi,
sırt ağrısı, bronş, dismenore, dispepsi, şişkinlik, kavana sendrom,
hipertansiyon, boyun ağrısı, solunum bozukluğu, rinit ve diş bozukluğu. † İnsidans, kadın hasta sayısına bağlıdır. -- Tire, 0'dan daha büyük fakir daha az meydan gelen advers olayları gösterir hastaların %0.5'inden fazı. |
|||
Listede listelenenlere ek olaylar Tablo 5 bu bir insidansta meydana geldi hemen salınan formülasyonun kontrollü klinik çalışmalarında en az %1 bupropion (300 ila 600 mg / gün) ve sayısal olarak daha sıktı plasebo: kardiyak aritmiler (%5 vs %4), hipertansiyon (%4 vs %2), hipotansiyon (%3 vs %2), taşikardi (%11 vs %9), iştah artışı (%4 vs %2), dispepsi (%3 vs %2), adet şikayetleri (%5 vs %1), akatizi (%2 vs %1), bozulmuş uyku kalitesi( 4% vs 2%), duyusal bozukluk( 4 % vs 3%), karışıklık (8 % vs 5%), azalmış libido (%3'e karşı %2), düşmanlık (%6'ya karşı %4), işitsel bozukluk (%5% vs 3%) ve tat bozukluğu (3%vs 1%).
Kontrollü klinik çalışmalarda sık görülen advers olayların insidansı
Yan etkiler Tablo 5 tedavi edilen hastaların en az %5'inde görülür bupropion'un sürekli salımlı formülasyonu ile ve en az iki kez bir oranda plasebo oranı 300 ve 400 mg / gün doz grupları için aşağıda listelenmiştir.
Sürekli Salımlı Formülasyonun 300 mg/gün:Anoreksiya, kuru ağız, döküntü, terleme, kulak çınlaması ve titreme.
Sürekli Salımlı Formülasyonun 400 mg/gün: Karın ağrısı, ajitasyon, anksiyete, baş dönmesi, ağız kuruluğu, uykusuzluk, miyalji, bulantı, çarpıntı, farenjit, terleme, kulak çınlaması ve idrar sıklığı.
Klinik gelişim ve pazarlama sonrası deneyim sırasında gözlenen diğer olaylar Bupropion
Yukarıda belirtilen advers olaylara ek olarak, aşağıdaki olaylar olmuştur klinik çalışmalarda ve sürekli serbest bırakma ile pazarlama sonrası deneyimlerde bildirilmiştir depresyonlu hastalarda ve depresyonsuz sigara içenlerde bupropion formülasyonu, klinik çalışmalarda ve pazarlama sonrası klinik deneyimde olduğu gibi bupropion'un hemen serbest bırakma formülasyonu.
Aşağıdaki frekansların sağlandığı advers olaylar klinik olarak ortaya çıkmıştır bupropion'un sürekli salımlı formülasyonu ile yapılan denemeler. Frekans bu, acil tedavi gören hastaların oranını temsil eder. depresyon için plasebo kontrollü çalışmalarda en az bir kez olay (n = 987) veya sigarayı bırakma (n = 1,013) veya olumsuz bir deneyim yaşayan hastalar açık etiketli bir sürveyans çalışmasında tedavinin kesilmesini gerektiren olay bupropion'un sürekli salımlı formülasyonu ile (n = 3,100). Tüm tedavi-acil yan etkiler, listede listelenenler dışında dahil edilir Tablolar 2 arasında 5, güvenlikle ilgili diğer bölümlerde listelenen olaylar, bu olumsuz olaylar alt kümelenmiştir aşırı genel veya aşırı spesifik olan COSTART terimleri altında bilgilendirici olmamak için, bu olaylar makul bir şekilde kullanımla ilişkili değildir ve ciddi olmayan ve daha az meydana gelen olaylar 2 hasta. Büyük klinik öneme sahip olaylar UYARMALAR ve TEDBİRLER etiketleme bölümleri.
Olaylar ayrıca vücut sistemine göre kategorize edilir ve azalan sıraya göre listelenir frekans aşağıdaki frekans tanımlarına göre: sık olumsuz olaylar en az 1/100 hastada meydana gelen olaylar olarak tanımlanır. Nadir advers olaylar 1/100 ila 1/1, 000 hastada meydana gelenlerdir, nadir ise olaylar 1/1,000'den az hastada meydana gelen olaylardır.
Frekansların sağlanmadığı advers olaylar klinik bupropion ile denemeler veya pazarlama sonrası deneyim. Sadece bu olumsuz olaylar daha önce uzun süreli sürüm için listelenmemiş olan bupropion pakete dahildir. Alan bu olayların BUDEPRİON XL™ (bupropion hydrochloride extended-release tablets) ile ilişkili olabileceği bilinmemektedir.
Vücut (Genel): Nadiren titreme, yüz ödemi, kas-iskelet sistemi vardı göğüs ağrısı ve ışığa duyarlılık. Nadir kırıklık vardı. Artralji de gözlendi, miyalji, döküntü ve gecikmiş aşırı duyarlılığı düşündüren diğer semptomlarla ateş. Bu semptomlar serum hastalığına benzeyebilir (bkz. TEDBİRLER).
Kardiyovasküler sistem: Seyrek postural hipotansiyon, inme vardı, taşikardi ve vazodilatasyon. Nadir bayılma oldu. Ayrıca gözlemlenen tamamlandı atriyoventriküler blokaj, ekstrasistoller, hipotansiyon, hipertansiyon (bazı durumlarda şiddetli, bkz TEDBİRLER), miyokard enfarktüsü, flebit ve pulmoner emboli. Sindirim: Nadiren anormal karaciğer fonksiyonu vardı, bruksizm, gastrik reflü, diş eti iltihabı, glossit, artan salivasyon, sarılık, ağız ülseri, stomatit ve susuzluk. Nadir dil ödemi oldu. Ayrıca gözlemlendi kolit, özofajit, gastrointestinal kanama, diş eti kanaması, hepatit vardı, bağırsak perforasyonu, karaciğer hasarı, pankreatit ve mide ülseri.
Endokrin: Ayrıca hiperglisemi, hipoglisemi ve uygun olmayan antidiüretik hormon sendromu.
Hemik ve lenfatik: Seyrek olarak ekimoz vardı. Ayrıca gözlemlendi anemi, lökositoz, lökopeni, lenfadenopati, pansitopeni ve trombositopeni vardı. Değişmiş PT ve / veya INR, nadiren hemorajik veya trombotik ile ilişkili bupropion varfarin ile birlikte kullanıldığında komplikasyonlar gözlendi.
Metabolik ve beslenme: Nadiren ödem ve periferik ödem vardı ödem. Glikozüri de gözlendi.
Iskelet: Nadiren bacak krampları vardı. Ayrıca gözlemlendi kas sertliği / ateş/rabdomiyoliz ve kas güçsüzlüğü.
Sinir Sistemi: Nadiren anormal koordinasyon vardı, azaldı libido, duyarsızlaşma, disfori, duygusal kararsızlık, düşmanlık, hiperkinezi, hipertoni, hipestezi, intihar düşüncesi ve baş dönmesi. Nadir amnezi vardı, ataksi, derealizasyon ve hipomani. Anormal elektroensefalogram da gözlendi (EEG), saldırganlık, akinezi, afazi, koma, deliryum, sanrılar, dizartri, diskinezi, distoni, öfori, ekstrapiramidal sendrom, halüsinasyonlar, hipokinezi, artan libido, manik reaksiyon, nevralji, nöropati, paranoyak düşünce, huzursuzluk ve maskesiz tardif diskinezi.
Solunum: Nadir bronkospazm oldu. Pnömoni de gözlendi.
Cilt: Nadir makülopapüler döküntü oldu. Alopesi de gözlendi, anjiyoödem, eksfolyatif " > dermatit ve hirsutizm.
Özel Duyular: Nadiren konaklama anormalliği ve kuru göz. Ayrıca sağırlık, diplopi, artmış göz içi basıncı gözlendi, ve midriyazis.
Genitoüriner sistem: Nadiren iktidarsızlık, poliüri ve prostat vardı bozukluk. Ayrıca gözlenen anormal boşalma, sistit, disparoni, dizüri, jinekomasti, menopoz, ağrılı ereksiyon, salpenjit, idrar kaçırma, idrar retansiyonu ve vajinit.
Uyuşturucu Bağlılığı Ve Bağlılığı
Kontrollü Madde Sınıfı
Bupropion kontrollü bir madde değildir.
İnsanlar
Bupropion (anında serbest bırakma formülasyonu) ile ilgili kontrollü klinik çalışmalar yapılmıştır normal gönüllülerde, çoklu uyuşturucu bağımlılığı öyküsü olan deneklerde ve depresif hastalarda motor aktivite ve ajitasyon/heyecanda bir miktar artış gösterdi.
Kötüye kullanım ilaçları ile deneyimlenen bir birey popülasyonunda, tek bir doz 400 mg bupropion ile karşılaştırıldığında hafif amfetamin benzeri aktivite üretildi bağımlılık Araştırma Merkezi'nin morfin-Benzedrin alt ölçeğinde plasebo Envanterler (ARCI) ve plasebo ve amfetamin arasında bir ara puan ARCI beğenme ölçeğinde. Bu ölçekler genel öfori duygularını ölçer ve uyuşturucu arzu edilebilirliği.
Klinik bulgular, ancak, güvenilir bir şekilde tahmin etmek için bilinmemektedir uyuşturucu kötüye kullanma potansiyeli. Bununla birlikte, tek dozlu çalışmalardan elde edilen kanıtlar bupropionun önerilen günlük dozunu bölünmüş dozların amfetamin veya uyarıcı için özellikle takviye edici olması muhtemel değildir istismarcılar. Bununla birlikte, risk nedeniyle test edilemeyen daha yüksek dozlar nöbet, uyarıcı ilaçları kötüye kullananlar için mütevazı bir şekilde çekici olabilir.
Hayvancılıklar
Kemirgenler ve primatlarda çalışmalar bupropion bazı farmakolojik sergiler göstermiştir psikostimülanlar için ortak eylemler. Kemirgenlerde, arttığı gösterilmiştir lokomotor aktivite, hafif basmakalıp davranışsal bir tepki ortaya çıkarmak ve artırmak çeşitli program kontrollü davranış paradigmalarında yanıt verme oranları. Primatta psikoaktif ilaçların olumlu güçlendirici etkilerini değerlendirmek için modeller, bupropion intravenöz olarak kendi kendine uygulandı. Sıçanlarda, bupropion amfetamin benzeri üretti uyuşturucu ayrımcılığı paradigmalarında kokain benzeri ayrımcılık uyaran etkileri psikoaktif ilaçların öznel etkilerini karakterize etmek için kullanılır

İnsan Aşırı Doz Deneyimi
30 g veya daha fazla bupropion doz aşımı bildirilmiştir. Nöbet oldu tüm vakaların yaklaşık üçte birinde rapor edildi. Diğer ciddi tepkiler bildirildi tek başına bupropion doz aşımı ile halüsinasyonlar, bilinç kaybı dahil, sinüs taşikardisi ve iletim bozuklukları veya aritmiler gibi EKG değişiklikleri. Ateş, kas sertliği, rabdomiyoliz, hipotansiyon, stupor, koma ve solunum başarısızlık, esas olarak bupropion çoklu ilaç aşırı dozlarının bir parçası olduğunda bildirilmiştir.
Çoğu hasta sekel olmadan iyileşmiş olsa da, aşırı dozlarla ilişkili ölümler bupropion tek başına büyük dozlarda yutan hastalarda bildirilmiştir ilaç. Çoklu kontrolsüz nöbetler, bradikardi, kalp yetmezliği ve kardiyak bu hastalarda ölüm öncesi tutuklama bildirildi.
Doz Aşımı Yönetimi
Yeterli hava yolu, oksijenasyon ve havalandırma sağlayın. Kalp ritmini izleyin ve yaşamsal belirtiler. EEG izleme, yutulduktan sonraki ilk 48 saat boyunca da önerilir. Genel destekleyici ve semptomatik önlemler de önerilir. İndüksiyon kusma tavsiye edilmez. Büyük delikli orogastrik tüp ile gastrik lavaj uygun hava yolu koruması ile, gerekirse, gerçekleştirilirse belirtilebilir Yuttuktan kısa bir süre sonra veya semptomatik hastalarda.
Aktif kömür uygulanmalıdır. Bu deneyim yoktur zorlanmış diürez, diyaliz, hemoperfüzyon veya metabolik transfüzyon kullanımı bupropion aşırı dozlarının yönetimi. Bupropion için spesifik panzehir yoktur bilinen.
BUDEPRİON XL™ (bupropion hidroklorür genişletilmiş salımlı tabletler) ile doza bağlı nöbet riski nedeniyle hastaneye yatış aşırı dozdan şüphelenildikten sonra dikkate alınmalıdır. Hayvanlarda yapılan çalışmalara dayanarak, nöbetlerin intravenöz benzodiazepin uygulaması ile tedavi edilmesi önerilir ve diğer destekleyici önlemler, uygun olarak.
Doz aşımını yönetirken, çoklu ilaç tutulumu olasılığını göz önünde bulundurun. Doktor daha fazla bilgi için bir zehir kontrol merkezine başvurmayı düşünmelidir herhangi bir aşırı dozun tedavisi hakkında bilgi. Sertifikalı telefon numaraları zehir kontrol merkezleri Hekimlerin Masa Referansı (PDR).

Bupropion, norepinefrinin nöronal alımının nispeten zayıf bir inhibitörüdür ve dopamin ve monoamin oksidazı veya serotoninin yeniden alımını inhibe etmez. Bupropionun etki mekanizması, diğer antidepresanlarda olduğu gibi, bilinmeyen, bu eylemin noradrenerjik ve / veya dopaminerjik mekanizmalar.

Bupropion rasemik bir karışımdır. Farmakolojik aktivite ve farmakokinetik bireysel enantiyomerler çalışılmamıştır. Ortalama eliminasyon yarı ömrü Kronik dozdan sonra bupropionun (±SD) 21 (±9) saattir ve bupropionun kararlı hal plazma konsantrasyonlarına 8 gün içinde ulaşılır.
Bupropion hidroklorür genişletilmiş salımlı 14 günlük dozlamayı karşılaştıran bir çalışmada tabletler (XL) bupropion'un hemen salınan formülasyonuna günde bir kez 300 mg günde 3 kez 100 mg'da, pik plazma konsantrasyonu için eşdeğerlik gösterildi ve bupropion ve 3 metabolitleri (hydroxybupropion) için eğri altında alan, threohydrobupropion ve erythrohydrobupropion). Ek olarak, bir çalışmada Bupropion hidroklorür genişletilmiş salımlı tabletler (XL) ile 14 günlük dozaj 300 150 mg 2'de bupropionun sürekli salımlı formülasyonuna günde bir kez mg günde bir kez, pik plazma konsantrasyonu için eşdeğerlik gösterildi ve bupropion ve 3 metabolit için eğri altındaki alan
Emilme
Sağlıklı gönüllülere BUDEPRİON XL™ (bupropion hydrochloride extended-release tablets) oral uygulamasından sonra, bupropion için en yüksek plazma konsantrasyonlarına kadar geçen süre yaklaşık 5 saat ve gıda, Bupropion'un Cmaksimum veya AUC'SİNİ etkilemedi.
Dağıtım
İn vitro testler, bupropionun insan plazma proteinlerine %84 bağlı olduğunu göstermektedir 200 mcg/ml'ye kadar konsantrasyonlarda. Hidroksibupropionun protein bağlanma derecesi metabolit, bupropion için olana benzer, oysa protein bağlanma derecesi threohidrobupropion metabolitinin bupropion ile görülen yaklaşık yarısıdır.
Metabolizma
Bupropion insanlarda yaygın olarak metabolize edilir. Üç metabolit aktif olduğu gösterilmiştir: hidroksibupropion, hidroksilasyon yoluyla oluşur tert- bupropion bütil grubu ve amino-alkol izomerleri threohydrobupropion ve karbonil grubunun indirgenmesi yoluyla oluşan eritrohidrobupropion. İn vitro bulgular, sitokrom P450IIB6'NIN (CYP2B6) ana olduğunu göstermektedir izoenzim hidroksibupropion oluşumunda rol alırken, sitokrom P450 izoenzimler threohydrobupropion oluşumunda yer almaz. Oksidasyon bupropion yan zincirinin bir glisin konjugat oluşumu ile sonuçlanır meta-klorobenzoik asit, daha sonra ana idrar metaboliti olarak atılır. Metabolitlerin bupropion'a göre potensi ve toksisitesi tamamen karakterize. Bununla birlikte, bir antidepresan olarak gösterilmiştir farelerde hidroksibupropionun bupropionun yarısı kadar güçlü olduğu tarama testi, threohydrobupropion ve erythrohydrobupropion 5 kat daha az güçlü iken bupropion. Bu klinik öneme sahip olabilir çünkü plazma konsantrasyonları metabolitlerin bupropionunkinden daha yüksek veya daha yüksektir
Bupropion büyük oranda metabolize olduğundan, uyuşturucu için potansiyel var- özellikle sitokrom tarafından metabolize edilen ajanlarla etkileşimler P450ııb6 (CYP2B6) izoenzim. Bupropion sitokrom tarafından metabolize olmamasına rağmen P450IID6 (CYP2D6), bupropion olduğunda ilaç-ilaç etkileşimleri için potansiyel vardır bu izoenzim tarafından metabolize edilen ilaçlarla birlikte kullanılır (bkz. TEDBİRLER: İLAÇ ETKİLERİ).
İnsanlarda, hidroksibupropionun pik plazma konsantrasyonları yaklaşık olarak meydana gelir BUDEPRİON XL™ (bupropion hidroklorür genişletilmiş salımlı tabletler) uygulamasından 7 saat sonra). Aşağıdaki yönetim BUDEPRİON XL™ ' den (bupropion hidroklorür genişletilmiş salımlı tabletler) , hidroksibupropion'un pik plazma konsantrasyonları yaklaşık olarak Kararlı durumda ana ilacın tepe seviyesinin 7 katı. Eliminasyon yarı ömrü hidroksibupropion yaklaşık 20 (±5) saattir ve AUC sabittir devlet, bupropion'un yaklaşık 13 katıdır. Tepe konsantrasyonlarına kadar geçen süre eritrohidrobupropion ve threohidrobupropion metabolitleri için benzerdir hidroksibupropion metabolitine. Ancak, onların eliminasyon yarı ömürleri sırasıyla yaklaşık 33 (±10) ve 37 (±13) saat daha uzundur, ve kararlı durum Auc'leri 1'dir.Bupropion'un sırasıyla 4 ve 7 katı
Bupropion ve metabolitleri, kronik uygulamadan sonra doğrusal kinetik sergilerler 300 ila 450 mg / gün.
Eleme
Oral uygulamadan sonra 200 mg 14İnsanlarda C-bupropion, Radyoaktif dozun %87'si ve %10'u sırasıyla idrar ve dışkıda geri kazanıldı. Bununla birlikte, bupropionun oral dozunun fraksiyonu değişmeden atıldı 0.5, bupropionun geniş metabolizması ile tutarlı bir bulgu.


