
Kompozisyon:
Uygulama:
Tedavide kullanılır:
Oliinyk Elizabeth Ivanovna tarafından tıbbi olarak gözden geçirilmiştir, Eczane Son güncelleme: 26.06.2023

Dikkat! Sayfadaki bilgiler sadece sağlık profesyonelleri içindir! Bilgi kamu kaynaklarında toplanır ve anlamlı hatalar içerebilir! Dikkatli olun ve bu sayfadaki tüm bilgileri tekrar kontrol edin!


Dozaj Formları ve Güçlü Yönleri
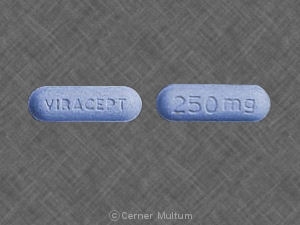
VIRACEPT 250 mg Tablet: Açık mavi, kapsül şeklinde bir tarafında “VIRACEPT” ve “250” ile kazınmış şeffaf film kaplamalı tabletler mg ”öteki.
VIRACEPT 625 mg Tablet: Berrak beyaz oval tablet bir tarafında “V” ve üzerinde “625” ile kazınmış film kaplama diğer.
VIRACEPT Oral Toz: 50 mg içeren kirli beyaz toz (nelfinavir içermeyen baz olarak) her seviyede kepçe (1 gram).
Depolama ve Taşıma
VIRACEPT (nelfinavir mesilat) 250 mg: Oyulmuş net film kaplamalı açık mavi, kapsül şeklinde tabletler bir tarafta “VIRACEPT” ve diğer tarafta “250 mg” ile.
300 (250 mg) tablet şişeler - NDC 63010-010-30
VIRACEPT (nelfinavir mesilat) 625 mg: “V” ile kazınmış şeffaf film kaplamalı beyaz oval tablet bir tarafta “625” diğer tarafta “625”.
120 (625 mg) tablet şişeler - NDC 63010-027-70
VIRACEPT (nelfinavir mesilat) Oral Toz 50 mg / g kirli beyaz bir toz olarak 50 mg (as nelfinavir serbest baz) her seviyede kepçe (1 gram).
144 adet çoklu kullanım şişesi kepçe ile toz gram - € ¦â € ¦.NDC 63010-011-90
VIRACEPT tabletleri ve oral toz 15 ° ila 30 ° C'de (59 ° ila 86 ° F) saklanmalıdır.
Kabı sıkıca kapalı tutun. Orijinal kapta dağıtım.
Dağıtımı: ViiV Healthcare Şirket, Araştırma Üçgen Parkı, NC 27709. Revize: Mart 2015

VIRACEPT diğer antiretroviral ajanlarla kombinasyon halinde HIV-1 enfeksiyonunun tedavisi için endikedir.

Yetişkinler ve Ergenler (13 Yaş ve Üstü)
Önerilen doz 1250 mg'dır (beş 250 mg tablet veya günde iki kez iki 625 mg tablet veya üç kez 750 mg (üç 250 mg tablet) günlük. VIRACEPT bir yemekle birlikte alınmalıdır. 250'yi yutamayan hastalar veya 625 mg tabletler tabletleri az miktarda suda çözebilir.
Pediatrik Hastalar (2 ila 13 Yıldan Az)
2 yaş ve üstü çocuklarda önerilir VIRACEPT Oral Toz veya 250 mg tabletlerin oral dozu iki kez 45 ila 55 mg / kg'dır günlük veya günde üç kez 25 ila 35 mg / kg. Tüm dozlar a ile alınmalıdır yemek. Yetişkin maksimum 2500 mg dozundan daha yüksek dozlar günde olmamıştır çocuklarda okudu.
Tabletleri yutamayan çocuklar için VIRACEPT 250 mg tablet (ler) az miktarda su veya VIRACEPT Oral Toz içinde çözülebilir uygulanabilir.
Sağlık hizmeti sağlayıcısı uygun değerlendirmelidir her hasta için formülasyon ve dozaj. Tablo 1 ve 2 dozlama sağlar yaş ve vücut ağırlığına göre VIRACEPT tabletleri ve tozu için yönergeler.
Tablo 1: 2 ila 13 yaşından küçük çocuklar için doz tablosu
yaş (tablet)
| Vücut ağırlığı Kg | Günde iki kez (BID) 45 - 55 mg / kg ≥ 2 yıl | Günde üç kez (TID) 25 - 35 mg / kg ≥ 2 yıl |
| Tablet sayısı (250 mg) | Tablet sayısı (250 mg) | |
| 10-12 | 2 | 1 |
| 13-18 | 3 | 2 |
| 19-20 | 4 | 2 |
| ≥ 21 | 4-5 * | 3† |
| * BID dozlaması için günde maksimum doz 5 tablet BID'dir † TID dozlaması için günde maksimum doz 3 tablet TID'dir |
Tablo 2: 2'den 13'e kadar olan çocuklar için dozlama tablosu
yaş (toz)
| Vücut ağırlığı Kg | Günde iki kez (BID) 45-55 mg / kg | Günde üç kez (TID) 25-35 mg / kg | ||
| Toz kepçeleri (50 mg / 1 g) | Çay kaşığı * toz | Toz kepçeleri (50 mg / 1 g) | Çay kaşığı * toz | |
| 9.0 ila <10.5 | 10 | 2½ | 6 | 1½ |
| 10.5 ila <12 | 11 | 2 3/4 | 7 | 1 3/4 |
| 12 ila <14 | 13 | 3 1/4 | 8 | 2 |
| 14 ila <16 | 15 | 3% | 9 | 2% |
| 16 ila <18 | Tavsiye edilmez † | Tavsiye edilmez † | 10 | 2½ |
| 18 ila <23 | Tavsiye edilmez † | Tavsiye edilmez † | 12 | 3 |
| ≥ 23 | Tavsiye edilmez † | Tavsiye edilmez † | 15 | 3 3/4 |
| * VIRACEPT oral tozunu ölçmek için bir çay kaşığı kullanılırsa,
1 seviye çay kaşığı 200 mg VIRACEPT içerir (4 seviye kepçe 1 seviyeye eşittir
çay kaşığı) † VIRACEPT 250 mg tablet kullanın |
Uygulama şekli
Viracept Tabletlerini Yutamayan Hastalar için
- VIRACEPT tablet (ler) i az miktarda suya koyun.
- Çözündükten sonra, bulutlu sıvıyı iyice karıştırın ve tüketin hemen.
- Cam su ve durulama ile durulanmalıdır tüm dozun tüketildiğinden emin olmak için yutulur.
Viracept Oral Tozu
- VIRACEPT Oral Tozu az miktarda suyla karıştırın süt, formül, soya formülü, soya sütü veya diyet takviyeleri
- Karıştırıldıktan sonra, tüm içerikler sırayla tüketilmelidir tam dozu elde etmek için.
- Karışım hemen tüketilmezse, olmalıdır soğutma altında saklanır, ancak depolama 6 saati geçmemelidir.
- Asidik gıda veya meyve suyu (ör., portakal suyu, elma suyu veya elma sosu) VIRACEPT Oral Tozu karıştırmak için önerilmez çünkü kombinasyon acı bir tada neden olabilir.
- VIRACEPT Oral Toz ile sulandırılmamalıdır orijinal kabında su.
Karaciğer yetmezliği
VIRACEPT hafif hepatikli hastalarda kullanılabilir herhangi bir doz ayarlaması yapılmadan bozulma. VIRACEPT hastalarda kullanılmamalıdır orta veya şiddetli karaciğer yetmezliği ile.

VIRACEPT'in birlikte uygulanması kontrendikedir temizleme için CYP3A'ya oldukça bağımlı olan ve yükselmiş ilaçlar plazma konsantrasyonları ciddi ve / veya hayatı tehdit eden ile ilişkilidir olaylar. Bu ilaçlar ve diğer kontrendike ilaçlar (azaltılmasına neden olabilir) nelfinavir'in etkinliği) Tablo 3'te listelenmiştir [ayrıca bakınız İLAÇ ETKİLEŞİMLERİ, Tablo 6].
Tablo 3: VIRACEPT ile Kontrendike İlaçlar
| Uyuşturucu sınıfı | VIRACEPT ile Kontrendike Sınıf İçinde İlaçlar | Klinik Yorum |
| Alfa 1-adrenoreseptör antagonisti | Alfuzosin | Potansiyel olarak artan alfuzosin konsantrasyonları hipotansiyona neden olabilir. |
| Antiaritmikler | Amiodaron, kinidin | Ciddi ve / veya hayatı tehdit eden kardiyak aritmi potansiyeli. |
| Antimikobakteriyel Ajanlar | Rifampin | Nelfinavirin plazma konsantrasyonları, rifampinin birlikte kullanılmasıyla azaltılabilir. Bu, terapötik etki kaybına ve VIRACEPT veya diğer birlikte uygulanan antiretroviral ajanlara karşı olası direnç gelişimine yol açabilir. |
| Ergot Türevleri | Dihidroergotamin, ergotamin, metilergonovin | Periferik vazospazm ve ekstremitelerin ve diğer dokuların iskemisi ile karakterize ergot toksisitesi gibi ciddi ve / veya hayatı tehdit eden reaksiyonlar için potansiyel. |
| GI Hareketlilik Temsilcisi | Cisapride | Kardiyak aritmiler gibi ciddi ve / veya hayatı tehdit eden reaksiyonlar için potansiyel. |
| Bitkisel ürünler | St. John's wort (Hypericum perforatum) | Nelfinavir'in plazma konsantrasyonları, bitkisel preparat St. John’un şarabı. Bu, terapötik etki kaybına ve VIRACEPT veya diğer birlikte uygulanan antiretroviral ajanlara karşı olası direnç gelişimine yol açabilir. |
| HMG-CoA Redüktaz İnhibitörleri | Lovastatin, Simvastatin | Rabdomiyoliz dahil miyopati gibi ciddi reaksiyonlar potansiyeli. |
| Nöroleptikler | Pimozid | Kardiyak aritmiler gibi ciddi ve / veya hayatı tehdit eden reaksiyonlar için potansiyel. |
| PDE5 İnhibitörleri | Sildenafil (Revatio®) [pulmoner arteriyel hipertansiyon tedavisi için]a | Nelfinavir ile kullanıldığında güvenli ve etkili bir doz belirlenmemiştir. Sildenafil ile ilişkili advers olaylar için artan potansiyel vardır (görme bozuklukları, hipotansiyon, uzun süreli ereksiyon ve senkop dahil). |
| Sedatif / Hipnotik s | Triazolam, oral midazolam | Uzun süreli veya artmış sedasyon veya solunum depresyonu gibi ciddi ve / veya hayatı tehdit eden reaksiyonlar için potansiyel. |
| a Görmek İLAÇ ETKİLEŞİMLERİ, Tablo 6 için erektil dozlandığında sildenafil ve tadalafil birlikte uygulanması disfonksiyon. |

UYARILAR
Bir parçası olarak dahil ÖNLEMLER Bölüm.
ÖNLEMLER
UYARI: Olmaması gereken ilaçlar hakkında bilgi edinin VIRACEPT ile alınır . Bu ifade ürünün şişe etiketine dahildir.
İlaç Etkileşimleri Nedeniyle Ciddi Olumsuz Reaksiyon Riski
Bir CYP3A inhibitörü olan VIRACEPT'in hastalarda başlatılması CYP3A tarafından metabolize edilen ilaçların alınması veya metabolize edilen ilaçların başlatılması zaten VIRACEPT alan hastalarda CYP3A ile plazmayı artırabilir CYP3A tarafından metabolize edilen ilaç konsantrasyonları. İlaçların başlatılması CYP3A'yı inhibe eden veya indükleyen konsantrasyonları artırabilir veya azaltabilir VIRACEPT, sırasıyla. Bu etkileşimler aşağıdakilere yol açabilir:
- Potansiyel olarak klinik olarak anlamlı advers reaksiyonlar daha büyük maruziyetlerden kaynaklanan ciddi, hayatı tehdit eden veya ölümcül olaylara yol açar eşlik eden ilaçlar.
- Daha büyük klinik olarak anlamlı advers reaksiyonlar VIRACEPT maruziyeti .
- VIRACEPT'in terapötik etkisinin kaybı ve olası direnç gelişimi.
Bunları mümkün kılmak veya yönetmek için atılan adımlar için Tablo 6'ya bakın ve doz önerileri de dahil olmak üzere bilinen önemli ilaç etkileşimleri. Daha önce ilaç etkileşimi potansiyelini düşünün ve VIRACEPT tedavisi sırasında; VIRACEPT sırasında eşlik eden ilaçları gözden geçirin terapi; ve eşlik eden ile ilişkili advers reaksiyonları izlemek ilaçlar.
Karaciğer yetmezliği
VIRACEPT de hastalarda kullanılmamalıdır orta veya şiddetli karaciğer yetmezliği (Child-Pugh B veya C, veya daha yüksek puan 7'ye eşit).
Fenilketonürikler
Viracept Oral Tozu bir bileşen olan fenilalanin içerir aspartam. Her gram VIRACEPT tozu 11.2 mg fenilalanin içerir. Fenilalanin, fenilketonüri hastalarına zararlı olabilir.
Diyabet Mellitus / Hiperglisemi
Yeni başlayan diabetes mellitus, önceden var olanın alevlenmesi pazarlama sonrası gözetim sırasında diyabetes mellitus ve hiperglisemi bildirilmiştir proteaz inhibitörü tedavisi alan HIV ile enfekte hastalarda. Bazı hastalar insülin veya oral hipoglisemik başlangıcı veya doz ayarlaması gerektiriyordu bu olayların tedavisi için ajanlar. Bazı durumlarda diyabetik ketoasidoz vardır meydana geldi. Proteaz inhibitörü tedavisini bırakan hastalarda hiperglisemi bazı durumlarda devam etti. Çünkü bu olaylar bildirildi klinik uygulama sırasında gönüllü olarak, frekans tahminleri yapılamaz ve proteaz inhibitörü tedavisi ile bu olaylar arasında nedensel bir ilişki vardır kurulmamış.
Hemofili
Kanamanın arttığı bildirilmiştir hemofili tip A hastalarında spontan cilt hematomları ve hemartroz ve B proteaz inhibitörleri ile tedavi edildi. Bazı hastalarda ek faktör VIII verildi. Bildirilen vakaların yarısından fazlasında tedavi proteaz inhibitörleri devam ettirildi veya yeniden verildi. Nedensel bir ilişki var kurulmamış.
Yağ Yeniden Dağıtımı
Merkezi dahil vücut yağının yeniden dağılımı / birikimi obezite, dorsoservikal yağ büyütme (“manda kambur”), periferik israf, yüz israf, göğüs büyütme ve “kushingoid görünümü” gözlenmiştir antiretroviral tedavi alan hastalar. Mekanizma ve uzun vadeli sonuçlar bu olayların şu anda bilinmiyor. Nedensel bir ilişki olmadı kurdu.
Bağışıklık Sulandırma Sendromu
Bağışıklık sulandırma sendromu bildirilmiştir VIRACEPT dahil kombinasyon antiretroviral tedavi ile tedavi edilen hastalar. Sırasında kombinasyon antiretroviral tedavinin başlangıç aşaması, hastalar bağışıklık sistemi yanıtları, temkinli veya enflamatuar bir yanıt geliştirebilir artık fırsatçı enfeksiyonlar [Mycobacterium avium enfeksiyonu gibi sitomegalovirüs, Pneumocystis jiroveci pnömonisi (PCP) veya tüberküloz] daha fazla değerlendirme ve tedavi gerektirebilir.
Otoimmün bozukluklar (Graves hastalığı gibi) polimiyozit ve Guillain-Barré sendromunun) da meydana geldiği bildirilmiştir bağışıklık sulandırma ayarı; ancak, başlama zamanı daha fazladır değişkendir ve tedaviye başladıktan aylar sonra ortaya çıkabilir.
Hasta Danışmanlığı Bilgileri
Görmek FDA onaylı hasta etiketleme (HASTA BİLGİLERİ)
Hastalara bir açıklama ve sağlık hizmeti sağlayıcıları ürünün şişe etiketine dahildir: UYARISI: Öğrenin VIRACEPT ile alınmaması gereken ilaçlar hakkında .
- Kullanım Talimatı
Optimal emilim için hastalara VIRACEPT'i yiyecekle birlikte almaları tavsiye edilmelidir.
Hastalar bilgilendirilmelidir VIRACEPT Tabletlerin film kaplamalı olduğunu ve bu film kaplamanın amaçlandığını tabletlerin yutulmasını kolaylaştırır.
Bir doz VIRACEPT ise kaçırılan hastalar dozu mümkün olan en kısa sürede almalı ve sonra geri dönmelidir normal programları. Bununla birlikte, bir doz atlanırsa, hasta atlamamalıdır bir sonraki dozu iki katına çıkarın.
Yetişkin veya pediatrik hastalar tabletleri yutamamak tabletleri az miktarda çözebilir Su:
- VIRACEPT tablet (ler) i yerleştirin az miktarda su
- Çözündükten sonra bulutlu karıştırın sıvı ve hemen tüketin.
- Cam durulanmalıdır su ve durulama, tüm dozun tüketildiğinden emin olmak için yutulur
Pediatrik hastalar yapamaz kırlangıç tabletleri toz formülasyonunu da kullanabilir:
- VIRACEPT Oral Tozu a az miktarda su, süt, formül, soya formülü, soya sütü veya diyet takviyeleri
- Karıştırıldıktan sonra, tüm içerik tam dozu elde etmek için tüketilmelidir.
- Karışım tüketilmezse derhal soğutma altında saklanmalıdır, ancak depolama aşılmamalıdır 6 saat.
- Asidik gıda veya meyve suyu (ör., portakal suyu, elma suyu veya elma sosu) karıştırmak için önerilmez VIRACEPT Oral Toz, çünkü kombinasyon acı bir tada neden olabilir.
- VIRACEPT Oral Toz olmamalıdır orijinal kabında su ile sulandırılmalıdır.
İlaç Etkileşimleri
VIRACEPT bazılarıyla etkileşime girebilir ilaçlar; bu nedenle hastalara kullanımı doktorlarına bildirmeleri tavsiye edilmelidir reçetesiz, reçetesiz ilaç veya bitkisel ürünler özellikle St. John'un şarabı.
Oral alan hastalar kontraseptiflere alternatif veya ek kontraseptif olduğu bildirilmelidir VIRACEPT tedavisi sırasında önlemler kullanılmalıdır
Sildenafil alan hastalar veya diğer PDE5 inhibitörleri ve nelfinavir'e, bulunabilecekleri bildirilmelidir PDE5 inhibitörü ile ilişkili advers olay riski artar hipotansiyon, görsel değişiklikler ve uzun süreli penil ereksiyon ve derhal yapılmalıdır herhangi bir belirtiyi doktorlarına bildirin.
Karaciğer yetmezliği
Hastalar bilgilendirilmelidir orta veya şiddetli hepatik varsa VIRACEPT kullanılmamalıdır değer düşüklüğü.
Fenilketonüri
Doktorlar uyarmalıdır VIRACEPT Oral Tozu olan fenilketonüri hastaları fenilalanin içerir
Yağ Yeniden Dağıtımı
Hastalar bilgilendirilmelidir alan hastalarda vücut yağının yeniden dağıtılması veya birikmesi meydana gelebilir PREZISTA / ritonavir dahil antiretroviral tedavi ve bunun nedeni ve bu koşulların uzun vadeli sağlık etkileri şu anda bilinmemektedir
En sık görülen advers olay VIRACEPT ile ilişkili, genellikle kontrol edilebilen ishaldir gastrointestinal yavaşlayan loperamid gibi reçetesiz ilaçlar motilite.
Genel bilgi
VIRACEPT bunun için bir tedavi değildir HIV-1 enfeksiyonu ve hastalar ilişkili hastalıklar yaşamaya devam edebilir fırsatçı enfeksiyonlar dahil HIV-1 enfeksiyonu ile. Hastalar yapmalıdır VIRACEPT kullanırken bir doktorun bakımı altında kalır. Hastalar olmalıdır HIV-1 enfeksiyonunu başkalarına yayabilecek şeyler yapmaktan kaçınmanız önerilir.
- İğneleri paylaşmayın veya diğer enjeksiyon ekipmanları.
- Kişisel eşyaları paylaşmayın diş fırçaları ve tıraş bıçağı gibi kan veya vücut sıvıları olabilir.
- Herhangi bir seks yapmayın koruma olmadan. Her zaman güvenli çalışın cinsel temas olasılığını azaltmak için lateks veya poliüretan prezervatif kullanarak seks meni, vajinal sekresyonlar veya kan ile.
- Emzirmeyin. VIRACEPT'in bebeğinize aktarılıp aktarılamayacağını bilmiyoruz anne sütünüz ve bebeğinize zarar verip vermeyeceği. Ayrıca, HIV-1'li anneler emzirmemelidir çünkü HIV-1 göğüste bebeğe geçebilir süt.
Hastalara söylenmelidir plazma HIV RNA'sında sürekli düşüşler, azaltılmış bir riskle ilişkilendirilmiştir AIDSÂ'e ilerleme ve ölüm.
Hastalar altında kalmalıdır VIRACEPT kullanırken bir doktorun bakımı. Hastalara tavsiye edilmelidir VIRACEPT ve diğer eşlik eden antiretroviral tedaviyi her gün olduğu gibi alın reçete. Hastalar danışmadan dozu değiştirmemeli veya tedaviyi bırakmamalıdır doktorlarıyla.
Klinik Olmayan Toksikoloji
Kanserojenez, Mutajenez, Doğurganlığın Bozukluğu
Fare ve sıçanlarda kanserojenlik çalışmaları yapılmıştır 1000 mg / kg / güne kadar oral dozlarda nelfinavir ile. Tümörjenik kanıtı yok farelerde sistemik maruziyetlerde (Cmax) 9 kata kadar etki kaydedildi insanlarda önerilen terapötik dozda ölçülür (750 mg TID veya 1250 mg BID). Sıçanlarda tiroid foliküler hücre adenomları ve karsinomları arttırıldı 300 mg / kg / gün ve daha yüksek erkeklerde ve 1000 mg / kg / gün kadınlarda. Sistemik 300 ve 1000 mg / kg / gün maruziyetleri (Cmax) sırasıyla 1- ila 3 kat idi önerilen terapötik dozda insanlarda ölçülenler. Tekrarlandı sıçanlara nelfinavir uygulanması hepatik ile tutarlı etkiler üretti mikrozomal enzim indüksiyonu ve artmış tiroid hormonu birikimi; bunlar insanlar değil, sıçanları tiroid foliküler hücre neoplazmalarına etkiler. Nelfinavir, bir bataryada mutajenik veya klastojenik aktivite kanıtı göstermedi nın-nin in vitro ve in vivo genetik toksikoloji deneyleri. Bu çalışmalar dahil bakteriyel mutasyon deneyleri S. typhimurium ve E. coli, bir fare lenfoma tirozin kinaz deneyi, insanda kromozomal sapma deneyi lenfositler ve bir in vivo fare kemik iliği mikronükleus testi.
Nelfinavir, erkek ya da kadın üzerinde hiçbir etki yaratmadı karşılaştırılabilir sistemik maruziyetlerde sıçanlarda çiftleşme ve doğurganlık veya embriyo sağkalımı insan terapötik maruziyetine.
Belirli Popülasyonlarda Kullanın
Gebelik
Gebelik Kategorisi B
VIRACEPT hamilelik sırasında sadece aşağıdaki durumlarda kullanılmalıdır potansiyel fayda fetus için potansiyel riski haklı çıkarır. Hayır VIRACEPT alan hamile kadınlarda yeterli ve iyi kontrollü çalışmalar .
Fetal gelişim veya maternal üzerinde hiçbir etkisi yoktu sistemik maruziyetlerde hamile sıçanlara nelfinavir uygulandığında toksisite (AUC) insan maruziyeti ile karşılaştırılabilir. Nelfinavir'in gebe uygulanması tavşanlar, hafif bir doza kadar fetal gelişim etkisi ile sonuçlanmadı anne vücut ağırlığında azalma gözlenmiştir; ancak, en yüksekte bile doz değerlendirildi, tavşanlarda sistemik maruziyet insandan önemli ölçüde düşüktü maruz kalma. Sıçanlarda yapılan ek çalışmalar, nelfinavir'e maruz kalmanın gebelik ortasından emzirmeye kadar olan kadınların hayatta kalma üzerinde hiçbir etkisi yoktu büyüme ve sütten kesime kadar yavruların gelişimi. Sonraki üreme bu yavruların performansı da maternal maruziyetten etkilenmemiştir nelfinavir.
Antiretroviral Gebelik Sicili (APR)
Gebe kadınların anne-fetal sonuçlarını izlemek VIRACEPT ve diğer antiretroviral ajanlara, bir Antiretroviral'e maruz kalır Gebelik Sicili kurulmuştur. Doktorların kayıt yaptırması teşvik edilir (800) 258-4263 numaralı telefonu arayarak hastalar.
Hemşirelik Anneler
Hastalık Kontrol ve Önleme Merkezleri HIV ile enfekte annelerin risk almaktan kaçınmak için bebeklerini emzirmemelerini önerir doğum sonrası HIV bulaşması . Emziren sıçanlarda çalışmalar gösterilmiştir nelfinavir sütle atılır. Hem HIV potansiyeli nedeniyle bulaşma ve emziren bebeklerde ciddi advers reaksiyon potansiyeli, annelere VIRACEPT alıyorlarsa emzirmemeleri talimatı verilmelidir
Pediatrik Kullanım
Güvenlik, tolere edilebilirlik, farmakokinetik profil ve HIV ile enfekte pediatrik hastalarda VIRACEPT'in etkinliği 2'den 2'ye değerlendirildi Çok merkezli klinik çalışmalarda 13 yaşında, Çalışma 556 ve PACTG 337. 2 yaşından küçük hastalarda yaş, VIRACEPT'in incelenen dozlarda güvenli olduğu, ancak güvenilir bir şekilde bulunduğu bulunmuştur etkili doz belirlenemedi. Farmakokinetik profil, 13 yaş ve üstü ergen hastalarda VIRACEPT'in güvenliği ve antiviral aktivitesi daha eski, bazı çalışmaların yapıldığı yetişkin klinik çalışmalarından elde edilen verilerle desteklenmektedir 13 yaş ve üstü deneklerin kaydına izin verildi. Böylece, veriler ergenler ve yetişkinler toplu olarak analiz edildi.
Geriatrik Kullanım
VIRACEPT'in klinik çalışmaları yeterli değildi farklı tepki verip vermediklerini belirlemek için 65 yaş ve üstü denek sayısı genç deneklerden.
Karaciğer yetmezliği
VIRACEPT de hastalarda kullanılmamalıdır orta veya şiddetli karaciğer yetmezliği (Child-Pugh B veya C, veya daha yüksek puan 7'ye eşit). Hafif hepatikli hastalar için VIRACEPT doz ayarlaması gerekmez değer düşüklüğü (Child-Pugh A, puan 5-6).
Böbrek Bozukluğu
VIRACEPT'in güvenliği ve etkinliği henüz gerçekleşmemiştir böbrek yetmezliği olan hastalarda kurulmuştur.

CYP3A ve CYP2C19 baskın enzimler gibi görünmektedir insanlarda nelfinavir'i metabolize eder. Nelfinavir'in potansiyel yeteneği ana insan sitokrom P450 enzimlerini (CYP3A, CYP2C19, CYP2D6, CYP2C9, CYP1A2 ve CYP2E1) araştırılmıştır in vitro Sadece CYP3A vardı. terapötik aralıktaki konsantrasyonlarda inhibe edilir. Spesifik ilaç etkileşimi nelfinavir ve bir dizi ilaç ile çalışmalar yapıldı. Tablo 12 özetlemektedir nelfinavir'in geometrik ortalama AUC, Cmax ve Cmin üzerindeki etkileri birlikte uygulanan ilaçlar. Tablo 13, birlikte uygulanan ilaçların nelfinavirin geometrik ortalama AUC, Cmax ve Cmin.
Tablo 12: İlaç Etkileşimleri: Farmakokinetikteki Değişiklikler VIRACEPT Varlığında Birlikte Uygulanan İlaç Parametreleri
| Birlikte Uygulanan İlaç | Nelfinavir Dozu | N | Birlikte Uygulanan İlaç Farmakokinetik Parametrelerinin *% Değişimi (% 90 CI) | ||
| AUC | Cmax | Cmin | |||
| HIV-Proteaz İnhibitörleri | |||||
| Indinavir 800 mg Tek Doz | 750 mg q8h x 7 gün | 6 | %% 51 (↑ 29-% 77) |
↓% 10 (↓ 28-↑% 13) |
NA |
| Ritonavir 500 mg Tek Doz | 750 mg q8h x 5 doz | 10 | ↔ | ↔ | NA |
| Saquinavir 1200 mg Tek Doz † | 750 mg TID x 4 gün | 14 | %% 392 (↑ 291-% 521) |
%% 179 (↑ 117-% 259) |
NA |
| Amprenavir 800 mg TID x 14 gün | 750 mg TID x 14 gün | 6 | ↔ | ↓% 14 (↓ 38-% 20) |
%% 189 (↑ 52-↑% 448) |
| Nükleosid Ters Transkriptaz İnhibitörleri | |||||
| Lamivudin 150 mg Tek Doz | 750 mg q8h x 7-10 gün | 11 | %% 10 (↑ 2-↑% 18) |
% 31 (↑ 9-↑% 56) |
NA |
| Zidovudin 200 mg Tek Doz | 750 mg q8h x 7-10 gün | 11 | ↓% 35 (↓ 29-↓% 40) |
↓% 31 (↓ 13-↓% 46) |
NA |
| Nükleosid Olmayan Ters Transkriptaz İnhibitörleri | |||||
| Efavirenz 600 mg qd x 7 gün | 750 mg q8h x 7 gün | 10 | ↓% 12 (↓ 31-%% 12) |
↓% 12 (↓ 29-% 8) |
↓% 22 (↓ 54-% 32) |
| Delavirdine 400 mg q8h x 14 gün | 750 mg q8h x 7 gün | 7 | ↓% 31 (↓ 57-%% 10) |
↓% 27 (↓ 49- ↑% 4) |
↓% 33 (↓ 70- ↑% 49) |
| Anti-enfektif Ajanlar | |||||
| Rifabutin 150 mg qd x 8 gün§ | 750 mg q8h x 7-8 gün1 | 12 | %% 83 (↑ 72-% 96) |
↑% 19 (↑ 11-% 28) |
%% 177 (↑ 144-% 215) |
| Rifabutin 300 mg qd x 8 gün | 750 mg q8h x 7-8 gün | 10 | %% 207 (↑ 161-% 263) |
%% 146 (↑ 118-% 178) |
%% 305 (↑ 245- ↑% 375) |
| Azitromisin 1200 mg Tek Doz | 750 mg TID x 11 gün | 12 | %% 112 (↑ 80-↑% 150) |
%% 136 (↑ 77-↑% 215) |
NA |
| HMG-CoA Redüktaz İnhibitörleri | |||||
| Atorvastatin 10 mg qd x 28 gün | 1250 mg BID x 14 gün | 15 | % 74 (↑ 41-↑% 116) |
%% 122 (↑ 68-↑% 193) |
% 39 (↓ 21-↑% 145) |
| Simvastatin 20 mg qd x 28 gün | 1250 mg BID x 14 gün | 16 | %% 505 (↑ 393-% 643) |
%% 517 (↑ 367-% 715) |
ND |
| Diğer Temsilciler | |||||
| Etinil estradiol 35 | ag qd x 15 gün | 750 mg q8h x 7 gün | 12 | ↓% 47 (↓ 42-↓% 52) |
↓% 28 (↓ 16-↓% 37) |
↓% 62 (↓ 57-↓% 67) |
| Noretindron 0.4 mg qd x 15 gün | 750 mg q8h x 7 gün | 12 | ↓% 18 (↓ 13-↓% 23) |
↔ | ↓% 46 (↓ 38-↓% 53) |
| Metadon 80 mg ± 21 mg qd #> 1 ay | 1250 mg BID x 8 gün | 13 | ↓% 47 (↓ 42-↓% 51) |
↓% 46 (↓ 42-↓% 49) |
↓% 53 (↓ 49-↓% 57) |
| Fenitoin 300 mg qd x 14 günÞ | 1250 mg BID x 7 gün | 12 | ↓% 29 (↓ 17-↓% 39) |
↓% 21 (↓ 12-↓% 29) |
↓% 39 (↓ 27-↓% 49) |
| NA: Tek doz tedavi ile ilgili değildir; ND: Olamaz
belirledi * ↑ Artışı gösterir; ↓ Düşüşü gösterir; ↔ Hayır gösterir değişim (geometrik ortalama maruz kalma arttı veya <% 10 azaldı) † Sakinavirin yumuşak jelatin kapsül formülasyonunu kullanarak 1200 mg § Rifabutin 150 mg qd değişiklikleri Rifabutin 300 mg qd x 8 güne göredir nelfinavir ile birlikte uygulama olmadan VIRACEPT ile rifabutin konsantrasyonlarında karşılaştırılabilir değişiklikler gözlendi 1250 mg q12h x 7 gün # Toplam plazma metadonunda değişiklikler bildirilmiştir; birey için değişiklikler R-enantiyomer ve S-enantiyomer benzerdi Toplam fenitoin maruziyeti için fenitoin maruziyet ölçümleri rapor edilmiştir. nelfinavir'in bağlanmamış fenitoin üzerindeki etkisi benzerdi |
|||||
Tablo 13: İlaç Etkileşimleri: Değişiklikler
Birlikte Uygulanan Varlığında Nelfinavir için farmakokinetik Parametreler
İlaç
| Birlikte Uygulanan İlaç | Nelfinavir Dozu | N | Nelfinavir Farmakokinetik Parametrelerinin *% Değişimi (% 90 CI) | ||
| AUC | C maks | C dk | |||
| HIV-Proteaz İnhibitörleri | |||||
| Indinavir 800 mg q8h x 7 gün | 750 mg Tek Doz | 6 | %% 83 (↑ 42-↑% 137) |
% 31 (↑ 16-↑% 48) |
NA |
| Ritonavir 500 mg q12h x 3 doz | 750 mg Tek Doz | 10 | %% 152 (↑ 96-↑% 224) |
% 44 (↑ 28-↑% 63) |
NA |
| Saquinavir 1200 mg TID x 4 gün | 750 mg Tek Doz | 14 | ↑% 18 (↑ 7-↑% 30) |
↔ | NA |
| Nükleosid Ters Transkriptaz İnhibitörleri | |||||
| Didanosin 200 mg Tek Doz | 750 mg Tek Doz | 9 | ↔ | ↔ | NA |
| Zidovudin 200 mg + Lamivudin 150 mg Tek Doz | 750 mg q8h x 7-10 gün | 11 | ↔ | ↔ | ↔ |
| Nükleosid Olmayan Ters Transkriptaz İnhibitörleri | |||||
| Efavirenz 600 mg qd x 7 gün | 750 mg q8h x 7 gün | 7 | %% 20 (↑ 8-↑% 34) |
%% 21 (↑ 10-% 33) |
↔ |
| Nevirapin 200 mg qd x 14 gün, ardından 200 mg BID x 14 gün | 750 mg TID x 36 gün | 23 | ↔ | ↔ | ↓% 32 (↓ 50-% 5) |
| Delavirdine 400 mg q8h x 7 gün | 750 mg q8h x 14 gün | 12 | %% 107 (↑ 83-↑% 135) |
%% 88 (↑ 66-↑% 113) |
%% 136 (↑ 103-% 175) |
| Anti-enfektif Ajanlar | |||||
| Ketokonazol 400 mg qd x 7 gün | 500 mg q8h x 5-6 gün | 12 | %% 35 (↑ 24-↑% 46) |
%% 25 (↑ 11-% 40) |
%% 14 (↓ 23-% 69) |
| Rifabutin 150 mg qd x 8 gün | 750 mg q8h x 7-8 gün | 11 | ↓% 23 (↓ 14-↓% 31) |
↓% 18 (↓ 8-↓% 27) |
↓% 25 (↓ 8-↓% 39) |
| 1250 mg q12h x 7-8 gün | 11 | ↔ | ↔ | ↓% 15 (↓ 43-% 27) |
|
| Rifabutin 300 mg qd x 8 gün | 750 mg q8h x 7-8 gün | 10 | ↓% 32 (↓ 15-↓% 46) |
↓% 24 (↓ 10-↓% 36) |
↓% 53 (↓ 15-↓% 73) |
| Rifampin 600 mg qd x 7 gün | 750 mg q8h x 5-6 gün | 12 | ↓% 83 (↓ 79-↓% 86) |
↓% 76 (↓ 69-↓% 82) |
↓% 92 (↓ 86-↓% 95) |
| Azitromisin 1200 mg Tek Doz | 750 mg tid x 9 gün | 12 | ↓% 15 (↓ 7-↓% 22) |
↓% 10 (↓ 19-% 1) |
↓% 29 (↓ 19-↓% 38) |
| Diğer Temsilciler | |||||
| Fenitoin 300 mg qd x 7 gün | 1250 mg BID x 14 gün | 15 | ↔ | ↔ | ↓% 18 (↓ 45- ↑% 23) |
| Nelfinavir'den 30 dakika önce uygulanan 40 mg qd x 4 gün Omeprazol | 1250 mg BID x 4 gün | 19 | ↓% 36 (↓ 20-↓% 49) |
↓% 37 (↓ 23-↓% 49) |
↓% 39 (↓ 15-↓% 57) |
| NA: Tek doz tedavi ile ilgili değildir * ↑ Artışı gösterir; ↓ Düşüşü gösterir; ↔ Hayır gösterir değişim (geometrik ortalama maruziyet arttı veya azaldı <% 10) † Sakinavirin yumuşak jelatin kapsül formülasyonunu kullanarak 1200 mg |
|||||

Gebelik Kategorisi B
VIRACEPT hamilelik sırasında sadece aşağıdaki durumlarda kullanılmalıdır potansiyel fayda fetus için potansiyel riski haklı çıkarır. Hayır VIRACEPT alan hamile kadınlarda yeterli ve iyi kontrollü çalışmalar .
Fetal gelişim veya maternal üzerinde hiçbir etkisi yoktu sistemik maruziyetlerde hamile sıçanlara nelfinavir uygulandığında toksisite (AUC) insan maruziyeti ile karşılaştırılabilir. Nelfinavir'in gebe uygulanması tavşanlar, hafif bir doza kadar fetal gelişim etkisi ile sonuçlanmadı anne vücut ağırlığında azalma gözlenmiştir; ancak, en yüksekte bile doz değerlendirildi, tavşanlarda sistemik maruziyet insandan önemli ölçüde düşüktü maruz kalma. Sıçanlarda yapılan ek çalışmalar, nelfinavir'e maruz kalmanın gebelik ortasından emzirmeye kadar olan kadınların hayatta kalma üzerinde hiçbir etkisi yoktu büyüme ve sütten kesime kadar yavruların gelişimi. Sonraki üreme bu yavruların performansı da maternal maruziyetten etkilenmemiştir nelfinavir.
Antiretroviral Gebelik Sicili (APR)
Gebe kadınların anne-fetal sonuçlarını izlemek VIRACEPT ve diğer antiretroviral ajanlara, bir Antiretroviral'e maruz kalır Gebelik Sicili kurulmuştur. Doktorların kayıt yaptırması teşvik edilir (800) 258-4263 numaralı telefonu arayarak hastalar.

Çünkü klinik araştırmalar yaygın olarak yapılmaktadır değişen durumlar, a'nın klinik çalışmalarında gözlenen advers reaksiyon oranları ilaç, bir başkasının klinik çalışmalarındaki oranlarla doğrudan karşılaştırılamaz ilaç ve uygulamada gözlemlenen oranları yansıtmayabilir.
Klinik Araştırmalar Deneyimi: Yetişkinler ve Ergenler (13 Yıllar ve Daha Büyük)
VIRACEPT'in güvenliği 5000'den fazla hastada incelenmiştir tek başına veya nükleosid analogları ile kombinasyon halinde ilaç alan kişiler. advers olayların çoğu hafif yoğunluktadır. En sık bildirilen VIRACEPT alan hastalar arasında advers olay ishaldi genellikle hafif ila orta yoğunlukta.
Orta veya orta ilaca bağlı klinik advers deneyimler birlikte uygulanan VIRACEPT ile tedavi edilen hastaların ≥% 2'sinde şiddetli yoğunluk 48 haftaya kadar veya ZDV artı 3TC (Çalışma 511) ile d4T ve 3TC (Çalışma 542) 24 haftaya kadar Tablo 4'te sunulmaktadır.
Tablo 4: Hastaların Yüzdesi
Tedaviye Bağlı * Orta veya Şiddetli Şiddetin Olumsuz Olayları ≥ olarak bildirilmiştir
Yetişkin ve Ergen Hastaların% 2'si
| Olumsuz Olaylar | Çalışma 511 24 hafta | Çalışma 542 48 hafta | |||
| Plasebo + ZDV / 3TC (N = 101) |
500 mg TID VIRACEPT + ZDV / 3TC (N = 97) |
750 mg TID VIRACEPT + ZDV / 3TC (N = 100) |
1250 mg BID VIRACEPT + d4T / 3TC (N = 344) |
750 mg TID VIRACEPT + d4T / 3TC (N = 210) |
|
| Sindirim Sistemi | |||||
| İshal | 3% | % 14 | % 20 | % 20 | % 15 |
| Bulantı | 4% | 3% | 7% | 3% | 3% |
| Şişkinlik | 0 | 5% | 2% | 1% | 1% |
| Cilt / Ekler | |||||
| Döküntü | 1% | 1% | 3% | 2% | 1% |
| * Bu olumsuz olayları en azından muhtemelen içerir muhtemelen veya kesinlikle çalışma ilacı veya bilinmeyen bir ilişki ile ilgili ve eşzamanlı HIV koşullarını içermez | |||||
Hastaların% 2'sinden azında meydana gelen advers olaylar tüm faz 2 ve 3 klinik çalışmalarda VIRACEPT almak ve en azından dikkate almak muhtemelen ilişkili veya bilinmeyen bir ilişki ve en azından orta şiddet aşağıda listelenmiştir.
Bir bütün olarak vücut: karın ağrısı, kazara yaralanma, alerjik reaksiyon, asteni, sırt ağrısı, ateş, baş ağrısı, halsizlik, ağrı, ve vücut yağının yeniden dağıtılması / birikmesi.
Sindirim Sistemi: anoreksiya, dispepsi, epigastrik ağrı, gastrointestinal kanama, hepatit, ağız ülseri, pankreatit ve kusma.
Hemik / Lenfatik Sistem: anemi, lökopeni ve trombositopeni.
Metabolik / Beslenme Sistemi: artar alkalin fosfataz, amilaz, kreatin fosfokinaz, laktik dehidrojenaz, SGOT, SGPT ve gama-glutamil transpeptidaz; hiperlipemi, hiperürisemi, hiperglisemi, hipoglisemi, dehidrasyon ve karaciğer fonksiyon testleri anormal.
Kas-iskelet sistemi: artralji, artrit, kramplar, kas ağrısı, miyasteni ve miyopati.
Sinir Sistemi: kaygı, depresyon, baş dönmesi, duygusal değişkenlik, hiperkinezi, uykusuzluk, migren, parestezi, nöbetler, uyku bozukluğu, uyku hali ve intihar düşüncesi.
Solunum Sistemi: dispne, farenjit, rinit ve sinüzit.
Cilt / Ekler: dermatit, folikülit, mantar dermatit, makülopapüler döküntü, kaşıntı, terleme ve ürtiker.
Özel Duyular: akut iritis ve göz bozukluğu.
Ürogenital Sistem: böbrek hesabı, cinsel disfonksiyon ve idrar anormalliği.
Laboratuvar Anormallikleri
Laboratuarı işaretli hastaların yüzdesi Çalışma 542 ve 511'deki anormallikler Tablo 5'te sunulmaktadır. İşaretli laboratuvar anormallikleri bir hastada Derece 3 veya 4 anormallik olarak tanımlanır normal başlangıç değeri veya a. hastada Derece 4 anormallik Başlangıçta derece 1 anormallik.
Tablo 5: Tedavi Grubuna Göre Hastaların Yüzdesi
Hastaların% 2'sinden fazlasında İşaretli Laboratuvar Anormallikleri * ile
| Çalışma 511 | Çalışma 542 | ||||
| Plasebo + ZDV / 3TC (N = 101) |
500 mg TID VIRACEPT + ZDV / 3TC (N = 97) |
750 mg TID VIRACEPT + ZDV / 3TC (N = 100) |
1250 mg BID VIRACEPT + d4T / 3TC (N = 344) |
750 mg TID VIRACEPT + d4T / 3TC (N = 210) |
|
| Hematoloji | |||||
| Hemoglobin | 6% | 3% | 2% | 0 | 0 |
| Nötrofiller | 4% | 3% | 5% | 2% | 1% |
| Lenfositler | 1% | 6% | 1% | 1% | 0 |
| Kimya | |||||
| ALT (SGPT) | 6% | 1% | 1% | 2% | 1% |
| AST (SGOT) | 4% | 1% | 0 | 2% | 1% |
| Kreatin Kinaz | 7% | 2% | 2% | NA | NA |
| * İşaretli laboratuvar anormallikleri bir kayma olarak tanımlanır başlangıçta Sınıf 0'dan en az Sınıf 3'e veya Sınıf 1'den Sınıf 4'e | |||||
Klinik Araştırmalar Deneyimi: Pediatri (2 ila 13 yaş altı) Yaş Yılları)
VIRACEPT yaklaşık 400 pediatrikte çalışılmıştır doğumdan 13 yaşına kadar klinik çalışmalarda hastalar. Olumsuz olay profili pediatrik klinik çalışmalar sırasında görülen yetişkinler için benzerdi.
En sık bildirilen ilaca bağlı, pediatrik çalışmalarda bildirilen tedaviye bağlı advers olaylar şunları içermektedir: ishal, lökopeni / nötropeni, döküntü, anoreksiya ve karın ağrısı. İshal, çalışma ilacı ile atanan ilişki ne olursa olsun,% 39 ila% 47 arasında bildirilmiştir daha büyük tedavi çalışmalarının 2'sinde VIRACEPT alan pediatrik hastaların oranı. Lökopeni / nötropeni en sık bildirilen laboratuvar anormalliğiydi pediatrik çalışmalarda önemli bir olay.
Pazarlama Sonrası Deneyim
Aşağıdaki advers reaksiyonlar tanımlanmıştır VIRACEPT'in onay sonrası kullanımı sırasında. Çünkü bu reaksiyonlar gönüllü olarak rapor edilir belirsiz büyüklükteki bir popülasyondan, güvenilir bir şekilde her zaman mümkün değildir sıklıklarını tahmin etmek veya ilaca maruz kalmayla nedensel bir ilişki kurmak.
Bir bütün olarak vücut: aşırı duyarlılık reaksiyonları (bronkospazm, orta ila şiddetli döküntü, ateş ve ödem dahil).
Kardiyovasküler Sistem: QTc uzaması, torsades de pointes.
Sindirim Sistemi: sarılık.
Metabolik / Beslenme Sistemi: bilirubinemi, metabolik asidoz.

VIRACEPT ile akut doz aşımı deneyimi sınırlı. VIRACEPT ile aşırı doz için spesifik bir antidot yoktur. Belirtilirse, emilmeyen ilacın ortadan kaldırılması kusma veya mide lavajı ile sağlanmalıdır. Aktif kömür uygulaması da çıkarılmasına yardımcı olmak için kullanılabilir emilmemiş ilaç. Nelfinavir yüksek oranda proteine bağlı olduğundan diyaliz olası değildir ilacı kandan önemli ölçüde çıkarmak için.

Elektrokardiyogram üzerindeki etkiler
Viracept'in önerilen 1250 mg dozunda etkisi düşük yağlı bir yemekle (% 20 yağ) uygulanan QTcF aralığında günde iki kez olmuştur randomize, plasebo ve aktif olarak değerlendirilir (günde bir kez 400 mg moksifloksasin) 66 sağlıklı kişide kontrollü, çapraz çalışma. Maksimum ortalama QTcF aralığındaki zamanla eşleşen (% 95 üst güvene bağlı) farklılıklar başlangıç düzeltmesinden sonra plasebo, eşiği 10 milisaniyenin altındaydı klinik kaygı. Tek bir supraterapötik doz olduğunda bu bulgu değişmemiştir Viracept 3125 mg, 3 günlük bir uygulamadan sonra uygulandı Viracept günde iki kez 1250 mg. 3125 mg'da maruziyet 1250'de 1.4 kat idi mg. Bu çalışmada 3125 mg'lık doz beklenen maruziyetleri elde etmedi yüksek yağlı yemek alan (% 50 yağ) veya birlikte uygulanan hastalarda nelfinavir maruziyetini artırabilecek ilaçların.
Hiçbir gruptaki hiçbir deneğin QTcF'sinde ≥ 60 milisaniye artış olmadı taban çizgisi. Hiçbir denek potansiyel olarak aşan bir aralık yaşamamıştır klinik olarak anlamlı 500 milisaniye eşik.

Nelfinavir'in farmakokinetik özellikleri vardı sağlıklı gönüllülerde ve HIV ile enfekte hastalarda değerlendirilir; önemli bir fark yok iki grup arasında gözlendi.
Emilim
Nelfinavir'in farmakokinetik parametreleri (altındaki alan kararlı durumda 24 saatlik bir süre boyunca plazma konsantrasyon-zaman eğrisi [AUC24] pik plazma konsantrasyonları [Cmax], sabah ve akşam oluk konsantrasyonları [Ctrough]) HIV pozitif hastalarda çoklu çalışmadan sonra yapılan farmakokinetik bir çalışmadan 28 gün boyunca günde iki kez 1250 mg (beş 250 mg tablet) (BID) ile dozlama (10 hastalar) ve 28 gün boyunca günde üç kez (TID) 750 mg (üç 250 mg tablet) (11 hasta) Tablo 7'de özetlenmiştir.
Tablo 7: İçinde Farmakokinetik Çalışmanın Özeti
1250 mg (Beş 250 mg Tablet) BID'lik Çoklu Dozu Olan HIV pozitif Hastalar
28 Gün ve 750 mg (Üç 250 mg Tablet) TID için 28 Gün
| Regimen | AUC24 mg • h / L |
Cmax mg / L |
Ctrough Sabah mg / L |
Ctrough Öğleden sonra veya akşam mg / L |
| 1250 mg BID | 52.8 ± 15.7 | 4.0 ± 0.8 | 2.2 ± 1.3 | 0.7 ± 0.4 |
| 750 mg TID | 43.6 ± 17.8 | 3.0 ± 1.6 | 1.4 ± 0.6 | 1.0 ± 0.5 |
| Veriler ortalama ± SD'dir |
Sabah ve öğleden sonra veya akşam arasındaki fark sağlıklı bir şekilde TID ve BID rejimleri için oluk konsantrasyonları da gözlenmiştir tam olarak 8 veya 12 saatlik aralıklarla dozlanan gönüllüler.
Tek bir 1250 mg doz alan sağlıklı gönüllülerde 625 mg tablet, 250 mg tablet formülasyonuna biyoeşdeğer değildi. Altında açlık koşulları (n = 27), AUC ve Cmax% 34 ve% 24 daha yüksekti sırasıyla 625 mg tabletler için. Göreceli biyoyararlanım değerlendirmesinde beslenen koşullar altında (n = 28), AUC 625 mg tablet için% 24 daha yüksekti; Cmax her iki formülasyon için de karşılaştırılabilirdi. HIV-1 ile enfekte kişilerde (N = 21) beslenen koşullar altında 1250 mg BID'lik çoklu dozlar alan 625 mg formülasyon kararlı durumdaki benzerliğe dayanarak 250 mg formülasyona biyoeşdeğerdi pozlama (Cmax ve AUC).
Tablo 8, kararlı durumun özetini göstermektedir çoklu doz uygulamasından sonra nelfinavirin farmakokinetik parametreleri (ortalama ± SD) HIV ile enfekte hastalara (N = 21) 1250 mg BID (2 x 625 mg tablet) günler.
Tablo 8: Kararlı Durum Farmakokinetiğinin Özeti
1250 Çoklu Doz Uygulamasından Sonra Nelfinavir'in parametreleri (Ortalama ± SD)
HIV ile enfekte Hastalara (N = 21) 14 Gün boyunca mg BID (2 x 625 mg Tablet).
| Regimen | AUC12 mg • h / L |
Cmax mg / L |
Cmin mg / L |
| 1250 mg BID | 35,3 (16,4) | 4.7 (1.9) | 1.5 (1.0) |
| AUC12: Kararlı durum AUC Cmax: Kararlı durumda maksimum plazma konsantrasyonu Cmin: Kararlı durumda minimum plazma konsantrasyonu |
Tek bir 750 mg doz alan sağlıklı gönüllülerde beslenen koşullar altında, uygulamadan sonra nelfinavir konsantrasyonları benzerdi 250 mg tablet ve oral toz.
Yiyeceklerin Oral Absorpsiyon Üzerine Etkisi
Gıda nelfinavir maruziyetini arttırır ve azalır aç duruma göre nelfinavir farmakokinetik değişkenliği. Birinde sağlıklı gönüllüler 1250 mg VIRACEPT 250 mg'lık tek bir doz aldı açlık veya beslenme koşullarında tabletler (5 tablet) (üç farklı öğün). İçinde ikinci bir çalışmada, sağlıklı gönüllüler 1250 mg VIRACEPT'lik tek dozlar aldı (5 x 250 mg tabletler) açlık veya beslenme koşullarında (iki farklı yağ içeriği) yemekler). İki çalışmanın sonuçları Tablo 9 ve Tabloda özetlenmiştir 10.
Tablo 9: Nelfinavir için AUC, Cmax ve Tmax'ta artış
1250 mg VIRACEPT (5 x 250 mg) sonrasında Fed Eyaletinde
Tabletler)
| Kcal sayısı | % Yağ | Konu sayısı | AUC kat artışı | Cmax kat artışı | Tmax (saat) cinsinden artış |
| 125 | 20 | n = 21 | 2.2 | 2.0 | 1.00 |
| 500 | 20 | n = 22 | 3.1 | 2.3 | 2.00 |
| 1000 | 50 | n = 23 | 5.2 | 3.3 | 2.00 |
Tablo 10: Nelfinavir AUC, Cmax ve Tmax in'de artış
Fasted State'e Göre Yüksek Yağ (% 50) Eyaletine Karşı Düşük Yağ (% 20)
1250 mg VIRACEPT (5 x 250 mg Tablet) sonrasında
| Kcal sayısı | % Yağ | Konu sayısı | AUC kat artışı | Cmax kat artışı | Tmax (saat) cinsinden artış |
| 500 | 20 | n = 22 | 3.1 | 2.5 | 1.8 |
| 500 | 50 | n = 22 | 5.1 | 3.8 | 2.1 |
Nelfinavir maruziyeti arttırılarak arttırılabilir VIRACEPT ile alınan yemeklerde kalori veya yağ içeriği .
625 ile bir gıda etkisi çalışması yapılmamıştır mg tablet. Bununla birlikte, çapraz çalışma karşılaştırmasına dayanarak (n = 26 beslendi vs. n = 26 oruç) 1250 mg nelfinavirin tek doz uygulamasını takiben, büyüklüğü 625 mg nelfinavir tabletin gıda etkisi, bununla karşılaştırılabilir görünmektedir 250 mg tabletler. VIRACEPT bir yemekle birlikte alınmalıdır.
Dağıtım
Oral sonrası belirgin dağılım hacmi nelfinavir uygulaması 2-7 L / kg idi. Serumdaki Nelfinavir yoğun bir şekilde proteine bağlıdır (>% 98).
Metabolizma
Değişmemiş nelfinavir, toplam plazmanın% 82-86'sını oluşturuyordu tek bir oral 750 mg 14C-nelfinavir dozundan sonra radyoaktivite. İn vitro, çoklu CYP3A ve CYP2C19 dahil olmak üzere sitokrom P-450 enzimleri sorumludur nelfinavir metabolizması. Bir majör ve birkaç minör oksidatif metabolit plazmada bulundu. Başlıca oksidatif metabolit vardır in vitro antiviral ana ilaçla karşılaştırılabilir aktivite.
Eliminasyon
Plazmada terminal yarılanma ömrü tipik olarak 3.5 ila 5 idi saatler. 14C-nelfinavir içeren oral 750 mg dozun çoğunluğu (% 87) geri kazanıldı dışkıda; dışkı radyoaktivitesi çok sayıda oksidatif metabolitten oluşuyordu (% 78) ve değişmemiş nelfinavir (% 22). Dozun sadece% 1-2'si geri kazanıldı değişmemiş nelfinavirin ana bileşen olduğu idrar.




































