

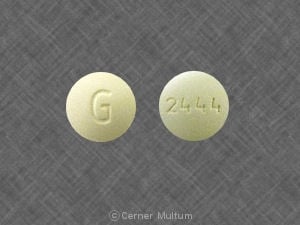




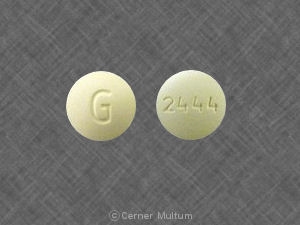






































































































Composition:
Application:
Utilisé dans le traitement:
Examiné médicalement par Oliinyk Elizabeth Ivanovna, Pharmacie Dernière mise à jour le 26.06.2023

Attention! Information sur la page est réservée aux professionnels de la santé! Les informations sont collectées dans des sources ouvertes et peuvent contenir des erreurs significatives! Soyez prudent et revérifiez toutes les informations de cette page!
Top 20 des médicaments avec les mêmes ingrédients:

Budeprion XL

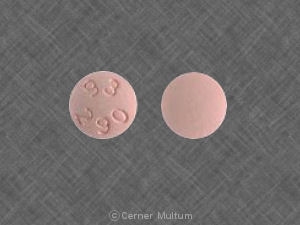
BUDEPRION XL™ (comprimés à libération prolongée de chlorhydrate de bupropion) 150 mg, sont blancs à blanc cassé, ronds, comprimés imprimés avec "A101". Ils sont fournis comme suit:
Bouteilles de 30 NDC # 0093-5350-56
Bouteilles de 500 NDC # 0093-5350-05
Conserver à 20 ° à 25°C (68° à 77°F).
* Ce qui suit sont des marques déposées de leurs fabricants respectifs:
ZYBAN®, WELLBUTRIN® et WELLBUTRIN SR® / GlaxoSmithKline.
Fabriqué par: Anchen Pharmaceuticals Inc., Irvine, CA 92618. Fabriqué
pour: Teva Pharmaceuticals USA, Sellersville, PA 18960. Rév. B 8/2007. Révision de la FDA
date: n/a

Trouble Dépressif Majeur
BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée) est indiqué pour le traitement du trouble dépressif majeur. L'efficacité du bupropion dans le traitement d'un épisode dépressif majeur était établi dans deux essais contrôlés de 4 semaines chez des patients hospitalisés et dans un essai de 6 semaines essai contrôlé de patients ambulatoires dont les diagnostics correspondaient le plus à la catégorie dépression majeure du manuel diagnostique et statistique de L'APA (DSM) (voir Les Essais Cliniques).
Un épisode dépressif majeur (DSM-IV) implique la présence de 1) humeur dépressive ou 2) une perte d'intérêt ou de plaisir, en outre, au moins 5 les symptômes ont été présents au cours de la même période de 2 semaines et représentent un changement du fonctionnement précédent: humeur dépressive, intérêt ou plaisir nettement diminué dans les activités habituelles, changement significatif de poids et / ou d'appétit, insomnie ou hypersomnie, agitation psychomotrice ou retard, fatigue accrue, sentiments de la culpabilité ou de l'inutilité, de la pensée ralentie ou de la concentration altérée, d'un suicide tentative ou idées suicidaires.
L'efficacité du bupropion dans le maintien d'une réponse antidépressive jusqu' à 44 semaines après 8 semaines de traitement aigu a été démontré dans un placebo contrôlé essai avec la formulation à libération prolongée de bupropion (voir Clinique Essai). Néanmoins, le médecin qui choisit D'utiliser BUDEPRION XL™ (comprimés à libération prolongée de chlorhydrate de bupropion) pour des périodes prolongées devrait périodiquement réévaluer l'utilité à long terme du médicament pour le patient individuel.

Considérations Générales De Dosage
Il est particulièrement important d'administrer BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée) d'une manière le plus susceptible de minimiser le risque de crise (voir AVERTISSEMENT). Progressive de l'escalade la posologie est également important si l'agitation, l'agitation motrice, et l'insomnie, souvent vu pendant les premiers jours de traitement, doivent être minimisés. Si nécessaire, ces effets peuvent être gérés par une réduction temporaire de la dose ou à court terme administration d'un hypnotique sédatif intermédiaire à longue durée d'action. Sédatif hypnotique n'est généralement pas nécessaire au-delà de la première semaine de traitement. Insomnie peut également être minimisé en évitant les doses coucher. Si affligeant, effets fâcheux supervene, l'augmentation de dose doit être arrêtée. BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée) doit être avalé entier et non écrasé, divisé ou mâché. BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée) être pris sans égard aux repas
Trouble Dépressif Majeur
Traitement Initial
La dose cible habituelle pour adultes de BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée) est de 300 mg / jour, administré une fois jour, le matin. L'administration de BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée) doit commencer à 150 mg / jour administré en une seule dose quotidienne le matin. Si la dose initiale de 150 mg est adéquate tolérée, une augmentation de la dose cible de 300 mg / jour, administrée une fois par jour, peut être fait dès le jour 4 du dosage. Il devrait y avoir un intervalle d'au moins 24 heures entre les doses successives.
Augmenter la dose au-dessus de 300 mg / jour
Comme avec d'autres antidépresseurs, L'effet antidépresseur complet de BUDEPRION XL™ peut ne pas être évident avant 4 semaines de traitement ou plus. Augmentation dans la posologie au maximum de 450 mg / jour, administré en une seule dose, peut être considéré pour les patients chez qui aucune amélioration clinique n'est notée après plusieurs semaines de le traitement à la dose de 300 mg/jour.
Le Traitement D'Entretien
Il est généralement admis que les épisodes aigus de dépression nécessitent plusieurs mois ou plus longtemps d'un traitement pharmacologique prolongé au-delà de la réponse à la épisode. On ne sait pas si la dose de BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée) était nécessaire pour le traitement d'entretien est identique à la dose nécessaire pour obtenir une réponse. Les Patients doivent être réévalués périodiquement pour déterminer le besoin de traitement d'entretien et la dose appropriée pour un tel traitement.
Changer les patients de comprimés de chlorhydrate de Bupropion ou de Bupropion Chlorhydrate Comprimés À Libération Prolongée
Lors du passage des patients des comprimés de chlorhydrate de bupropion à BUDEPRION XL™ ou des comprimés à libération prolongée de chlorhydrate de bupropion à BUDEPRION XL™ (comprimés à libération prolongée de chlorhydrate de bupropion) , donner la même dose quotidienne totale si possible. Les Patients qui sont actuellement traités avec des comprimés de chlorhydrate de bupropion à 300 mg/jour (par exemple, 100 mg 3 fois par jour) peut être remplacé par BUDEPRION XL (comprimés à libération prolongée de chlorhydrate de bupropion) ™ 300 mg une fois par jour. Patients qui sont actuellement traités par le chlorhydrate de bupropion à libération prolongée les comprimés à 300 mg / jour (par exemple, 150 mg deux fois par jour) peuvent être remplacés par BUDEPRION XL™ 300 mg une fois par jour
Ajustement posologique chez les Patients présentant une insuffisance hépatique
BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée) doit être utilisé avec une extrême prudence chez les patients présentant la cirrhose hépatique. La dose ne doit pas dépasser 150 mg tous les deux jours dans ces patients. BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée) doit être utilisé avec prudence chez les patients atteints de insuffisance (y compris cirrhose hépatique légère à modérée) et une fréquence réduite et / ou la dose doit être envisagée chez les patients présentant une cirrhose hépatique légère à modérée (voir PHARMACOLOGIE CLINIQUE, AVERTISSEMENT, et PRÉCAUTION).
Ajustement posologique chez les Patients présentant une insuffisance rénale
BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée) doit être utilisé avec prudence chez les patients présentant une insuffisance rénale et une fréquence et/ou une dose réduites devraient être envisagées (voir CLINIQUE PHARMACOLOGIE et PRÉCAUTION).

BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée) est contre-indiqué chez les patients présentant un trouble convulsif.
BUDEPRION XL™ est contre indiqué chez les patients traités par ZYBAN® ou comprimés à libération prolongée de chlorhydrate de bupropion, WELLBUTRIN® ou bupropion formulation de chlorhydrate à libération immédiate, WELLBUTRIN SR® ou bupropion formulation de chlorhydrate à libération prolongée, ou tout autre médicament contenant bupropion parce que l'incidence des convulsions dépend de la dose.
BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée) est contre-indiqué chez les patients présentant un diagnostic de boulimie ou d'anorexie mentale en raison d'une incidence plus élevée de crises noté chez les patients traités pour la boulimie avec la formulation à libération immédiate de bupropion.
BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée) est contre-indiqué chez les patients subissant un arrêt brutal du traitement d'alcool ou de sédatifs (y compris les benzodiazépines).
L'administration concomitante de BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée) et d'une monoamine oxydase (MAO) inhibiteur est contre-indiqué. Au moins 14 jours doivent s'écouler entre l'arrêt du traitement inhibiteur de la MAO et initiation du traitement par BUDEPRION XL™ (comprimés à libération prolongée de chlorhydrate de bupropion).
BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée) est contre-indiqué chez les patients ayant présenté une allergie réponse au bupropion ou aux autres ingrédients qui composent BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée).

AVERTISSEMENT
Aggravation clinique et risque de Suicide
Les Patients atteints d'un trouble dépressif majeur (TDM), tant chez l'adulte que chez l'enfant, peuvent une aggravation de leur dépression et / ou l'émergence d'idées suicidaires et comportement (suicidalité) ou des changements inhabituels de comportement, qu'ils prennent des médicaments antidépresseurs, et ce risque peut persister jusqu'à ce que significatif la rémission. Le Suicide est un risque connu de dépression et de certains autres troubles psychiatriques troubles, et ces troubles eux-mêmes sont les prédicteurs les plus forts du suicide. Il y a eu une préoccupation de longue date, cependant, que les antidépresseurs peuvent avoir un rôle dans l'aggravation de la dépression et l'émergence de la suicidalité chez certains patients au cours des premières phases du traitement. Les analyses regroupées de essais à court terme contrôlés par placebo de médicaments antidépresseurs (ISRS et autres) a montré que ces médicaments augmentent le risque de pensées et de comportements suicidaires (suicidalité) chez les enfants, les adolescents et les jeunes adultes (âgés de 18 à 24 ans) avec trouble dépressif majeur (TDM) et autres troubles psychiatriques. À court terme les études n'ont pas montré d'augmentation du risque de suicide avec les antidépresseurs par rapport au placebo chez les adultes de plus de 24 ans, il y avait une réduction avec les antidépresseurs comparé au placebo chez les adultes âgés de 65 ans et plus
Les analyses groupées des essais contrôlés contre placebo chez les enfants et les adolescents avec MDD, trouble obsessionnel compulsif (TOC), ou d'autres troubles psychiatriques inclus un total de 24 essais à court terme de 9 médicaments antidépresseurs dans plus de 4400 patients. La mise en commun des analyses d'essais contrôlés par placebo chez des adultes atteints de MDD ou d'autres troubles psychiatriques comprenaient un total de 295 essais à court terme (médiane durée de 2 mois) de 11 antidépresseurs chez plus de 77 000 patients. Y le risque de suicide varie considérablement d'un médicament à l'autre, mais une tendance vers une augmentation des patients plus jeunes pour presque tous les médicaments étudiés. Y y avait-il des différences dans le risque absolu de suicidalité entre les différentes indications, avec l'incidence la plus élevée dans le MDD. Les différences de risque (médicament vs placebo), cependant, étaient relativement stables dans les strates d'âge et entre les indications. Ces risques différences (différence médicament-placebo dans le nombre de cas de suicidalité par 1000 patients traités) sont fournis dans Le tableau 1.
Tableau 1.
| La Tranche D Âge | Différence médicament-Placebo dans le nombre de cas de suicidalité verser 1000 Patients traités |
| Augmentations par rapport au Placebo | |
| < 18 | 14 cas supplémentaires |
| De 18 à 24 SCN | 5 cas supplémentaires |
| Diminutions par rapport au Placebo | |
| De 25 à 64 SCN | 1 moins de |
| ≥ 65 | 6 cas en moins |
Aucun suicide n'est survenu dans aucun des essais pédiatriques. Il y a eu des suicides dans l'adulte essais, mais le nombre n'était pas suffisant pour parvenir à une conclusion à propos de l'effet de la drogue sur le suicide.
On ne sait pas si le risque de suicidalité s'étend à une utilisation à plus long terme, c'est-à-dire, au-delà de plusieurs mois. Cependant, il existe des preuves substantielles de contrôle par placebo essais d'entretien chez les adultes souffrant de dépression que l'utilisation d'antidépresseurs peut retarder la récurrence de la dépression.
Tous les patients traités avec des antidépresseurs verser toute indication être surveillé de manière appropriée et observé de près pour l'agravation clinique, la suicidalité, et des changements résidentiels de comportement, en particulier au cours des premiers mois de un cours de traitement médicamenteux, ou à des moments de changements de dose, augmente ou diminue.
Les symptômes suivants, anxiété, agitation, attaques de panique, insomnie, irritabilité, hostilité, agressivité, impulsivité, akathisie (agitation psychomotrice), une hypomanie et une manie ont été rapportées chez des patients adultes et pédiatriques traités avec des antidépresseurs trouble dépressif majeur ainsi que pour d'autres indications, à la fois psychiatriques et non psychiatriques. Bien qu'un lien de causalité entre l'apparition de tels symptômes et soit l'aggravation de la dépression et/ou l'émergence d'impulsions suicidaires n'a pas été établie, il y a inquiétude que de tels symptômes peuvent représenter des précurseurs à la suicidalité émergente.
Il faut envisager de modifier le régime thérapeutique, notamment peut-être l'arrêt du médicament, chez les patients dont la dépression est persistante pire, ou qui éprouvent une suicidalité émergente ou des symptômes qui pourraient être précurseurs d'une aggravation de la dépression ou de la suicidalité, surtout si ces symptômes sont graves, brusques dans l'apparition, ou ne faisaient pas partie de la présentation des symptômes du patient.
Les familles et Les soignants des patients traités avec des antidépresseurs verser trouble dépressif majeur ou autres indications, à la fois psychiatriques et non psychiatriques, doivent être alertés sur la nécessité de surveiller les patients pour l'apparition d'agitation, irritabilité, changements urbains de comportement et autres symptômes décrits ci-dessus, ainsi que l'émergence de tendances suicidaires, et de signaler de tels symptômes immédiatement aux fournisseurs de soins de santé. Cette surveillance devrait inclure une observation quotidienne par les familles et les soignants. Les Prescriptions de BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée) doivent être écrit pour la plus petite quantité de comprimés compatible avec bon patient de gestion, afin de réduire le risque de surdosage.
Dépistage du trouble bipolaire chez les Patients
Un épisode dépressif majeur peut être la présentation initiale du trouble bipolaire. On croit généralement (bien que non établi dans les essais contrôlés) que traiter un épisode avec un antidépresseur seul peut augmenter la probabilité de précipitation d'un épisode mixte / maniaque chez les patients à risque de trouble bipolaire. On ignore si l'un des symptômes décrits ci dessus représente une telle conversion. Cependant, avant de commencer le traitement avec un antidépresseur, les patients avec les symptômes dépressifs doivent être adéquatement dépistés pour déterminer s'ils sont à risque de trouble bipolaire, un tel dépistage devrait inclure un examen psychiatrique détaillé antécédents, y compris des antécédents familiaux de suicide, de trouble bipolaire et de dépression. Il convient de noter que BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée) n'est pas approuvé pour le traitement la dépression bipolaire
Les Patients doivent être informés que BUDEPRION XL™ contient le même ingrédients actifs présents dans le Zyban® ou le chlorhydrate de bupropion à libération prolongée comprimés utilisés comme aide au traitement du sevrage tabagique, et que BUDEPRION XL™ ne doit pas être utilisé en association avec ZYBAN® ou le chlorhydrate de bupropion comprimés à libération prolongée, ou tout autre médicament contenant du bupropion, tels que WELLBUTRIN SR ou le chlorhydrate de bupropion formulation à libération prolongée, et WELLBUTRIN ou chlorhydrate de bupropion formulation à libération immédiate.
Saisie
Le Bupropion hne associé à un risque de convulsions lié à la dose. Le risque de les crises sont également liées aux facteurs du patient, aux situations cliniques et aux facteurs concomitants médicaments, qui doivent être considérés dans la sélection des patients pour le traitement avec BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée). BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée) doit être arrêté et non recommarré chez les patients qui présentent une crise pendant le traitement.
Comme BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée) est bioéquivalent à la fois à la formulation à libération immédiate de bupropion et de la formulation à libération prolongée de bupropion, la saisie incidence avec BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée) , alors qu'elle n'a pas été formellement évaluée en clinique les essais, peuvent être similaires à ceux présentés ci-dessous pour la libération immédiate et formulations à libération prolongée de bupropion.
- Dose: À des doses allant jusqu'à 300 mg / jour de la formulation à libération prolongée chez le bupropion, l'incidence des crises est d'environ 0,1% (1/1 000).
Les données pour la formulation à libération immédiate de bupropion ont révélé une crise incidence d'environnement 0,4% (c.-à-d. 13 patients sur 3 200 suivis prospectivement) chez les patients traités à des doses comprend entre 300 et 450 mg/jour. Cette incidence de crise (0,4%) peut dépasser celui de certains autres antidépresseurs commercialisés.
Données supplémentaires accumulées pour la formulation à libération immédiate du bupropion suggère que l'incertitude estimée des crises augmente presque dix fois entre 450 et 600 mg / jour. La dose de 600 mg est deux fois la dose habituelle chez l'adulte et une et un tiers de la dose quotidienne maximale recommandée (450 mg) de BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée). Cette augmentation disproportionnée de l'incidence des crises avec l'augmentation de la dose appels à la prudence dans le dosage.
- Facteurs du Patient: facteurs prédisposants qui peuvent augmenter le risque de crise avec l'utilisation de bupropion incluant des antécédents de traumatisme crânien ou de crise antérieure, centrale tumeur du système nerveux (SNC), la présence d'une cirrhose hépatique sévère, et médicaments concomitants qui abaissent le seuil de crise.
- Situations cliniques: les circonstances associées à une crise d'accumulation des le risque comprend, entre autres, la consommation excessive d'alcool ou de sédatifs (y compris benzodiazépines), dépendance aux opiacés, à la cocaïne ou aux stimulants, utilisation de médicaments en vente libre stimulants et anorectiques, et diabète traités par hypoglycémies orales ou insuline.
- Médicaments concomitants: de nombreux médicaments (p. ex., antipsychotiques, antidépresseurs, théophylline, stéroïdes systémiques) sont connus pour abaisser le seuil de crise.
Recommandations pour réduire le risque de saisie
Analyser rétrospective de l'expérience clinique acquise au cours du développement de bupropion suggère que le risque de crise peut être minimisé si
- la dose quotidienne totale de BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée) fait PA dépasser les 450 mg,
- le taux d'augmentation de la dose hne progressif.
BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée) doit être administré avec une extrême prudence aux patients avec des antécédents de convulsions, de traumatismes crâniens ou d'autres prédispositions à convulsions, ou patients traités avec d'autres agents (p. ex., antipsychotiques, autres antidépresseurs, théophylline, stéroïdes systémiques, etc.) ce seuil de saisie inférieur.
Insuffisance Hépatique
BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée) doit être utilisé avec une extrême prudence chez les patients présents cirrhose hépatique sévère. Chez ces patients, une fréquence et / ou une dose réduite est nécessaire, car le pic de bupropion, ainsi que L'ASC, les niveaux sont considérablement augmentés et l'accumulation hne susceptibles de se produire chez ces de patients dans une plus grande mesure que habituel. La dose ne doit pas dépasser 150 mg tous les deux jours chez ces patients (voir Pharmacologie clinique, précautions et posologie ET DE L'ADMINISTRATION).
Potentiel D'hépatotoxicité
Chez les rats recevant de fortes doses de bupropion de manière chronique, il y avait une augmentation dans l'incidence des nodules hyperplasiques hépatiques et de l'hypertrophie hépatocellulaire. Chez les chiens recevant de fortes doses de bupropion chroniquement, divers changements histologiques ont été observés dans le foie et des tests de laboratoire suggérant une légère hépatocellulaire des blessures ont été notées.
PRÉCAUTION
Général
Agitation et insomnie
Augmentation de l'agitation, de l'agitation, de l'anxiété et de l'Insomnie, surtout sous peu après le début du traitement, ont été associés à un traitement par bupropion. Patients dans les essais contrôlés par placebo de trouble dépressif majeur avec le formulation à libération prolongée de bupropion, agitation expérimentée, anxiété, et l'insomnie comme indiqué dans Le tableau 2.
Tableau 2. Incidence de L'agitation, de L'anxiété et de l'isolement dans
Les Essais contrôlés contre Placebo de la Formulation à libération prolongée de Bupropion verser
Trouble Dépressif Majeur
| Les Événements Irréalisables Equipe |
À libération prolongée formulation de bupropion 300 mg / jour (n = 376) |
À libération prolongée formulation de bupropion 400 mg / jour (n = 114) |
Placebo (n = 385) |
| Agitation | 3% | 9% | 2% |
| Anxiété | 5% | 6% | 3% |
| Insomnie | 11% | 16% | 6% |
Dans les études cliniques du trouble dépressif majeur, ces symptômes étaient parfois d'une ampleur suffisante pour nécessiter un traitement avec des médicaments sédatifs / hypnotiques.
Symptômes dans ces études étaient suffisamment graves pour nécessiter l'arrêt de traitement chez 1% et 2,6% des patients traités avec 300 et 400 mg/jour, respectivement, de bupropion comprimés à libération prolongée et 0,8% des patients traités par placebo.
Psychose, Confusion et autres phénomènes neuropsychiatriques
Les patients déprimés traités par le bupropion ont été rapportés pour montrer une variété des signes et symptômes neuropsychiatriques, y compris des délires, des hallucinations, psychose, troubles de la concentration, paranoïa et confusion. Dans certains cas, ces symptômes se sont atténués lors de la réduction de la dose et/ou de l'arrêt du traitement.
Activation de la psychose et / ou de la manie
Les antidépresseurs peuvent précipiter les épisodes maniaques chez les patients atteints de trouble bipolaire pendant la phase dépressive de leur maladie et peut activer la psychose latente chez d'autres patients sensibles. BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée) devrait poser des problèmes similaires risque.
Altération de L'appétit et du poids
Dans les études contrôlées versus placebo du trouble dépressif majeur utilisant la libération prolongée formulation de bupropion, les patients ont connu un gain de poids ou une perte de poids comme indiqué dans Le tableau 3.
Tableau 3. Incidence de la prise de poids et de la perte de poids chez les patients contrôlés par Placebo
Essais de Formulation à libération prolongée de Bupropion pour le trouble dépressif majeur
| Changement De Poids | À libération prolongée la formulation de bupropion 300 mg / jour (n = 339) |
À libération prolongée la formulation de bupropion 400 mg / jour (n = 112) |
Placebo (n = 347) |
| Gagné > 5 livres | 3% | 2% | 4% |
| Perdu > 5 lb | 14% | 19% | 6% |
Dans les études menées avec la formulation à libération immédiate de bupropion35, % des patients recevant des antidépresseurs tricycliques ont pris du poids, par rapport à 9% des patients traités avec la formulation à libération immédiate de bupropion. Si la perte de poids est un signe majeur de la maladie dépressive d'un patient, le BUDEPRION XL™ (comprimés à libération prolongée de chlorhydrate de bupropion) devrait être anorexigène et/ou réduire le poids considérer.
Des Réactions Allergiques
Réactions anaphylactoïdes/anaphylactiques caractérisées par des symptômes tels que prurit, urticaire, œdème de quincke, dyspnée nécessitant un traitement médical ont été signalés dans les essais cliniques avec bupropion. En outre, il y a eu de rares spontanés rapports post-commercialisation d'érythème polymorphe, de syndrome de Stevens-Johnson et choc anaphylactique associé au bupropion. Un patient doit arrêter de prendre BUDEPRION XL™ et consulter un médecin en cas d'allergie ou d'anaphylactoïde / anaphylactique réactions (p. ex. éruption cutanée, prurit, urticaire, douleur thoracique, œdème et essoufflement de souffle) pendant le traitement.
Arthralgie, myalgie et fièvre avec éruption cutanée et autres symptômes évocateurs de retard une hypersensibilité a été rapportée en association avec le bupropion. Ces symptômes peut ressembler à la maladie sérique.
Effets Cardiovasculaires
Dans la pratique clinique, l'hypertension, dans certains cas graves, nécessitant un traitement aigu, des cas ont été rapportés chez des patients recevant du bupropion seul et en association avec thérapie de remplacement de la nicotine. Ces événements ont été observés chez les deux patients avec et sans preuve d'hypertension préexistante.
Données d'une étude comparative de la formulation à libération prolongée de bupropion, nicotine transdermal system (NTS), la combinaison de bupropion à libération prolongée plus NTS, et placebo comme une aide à l'abandon du tabac suggèrent une incidence plus élevée de l'hypertension émergente du traitement chez les patients traités par l'association de bupropion à libération prolongée et de SNN. Dans cette étude, 6.1% des patients traités avec la combinaison de bupropion à libération prolongée et de NTS, le traitement a émergé hypertension par rapport à 2.5%, 1.6% et 3.1% des patients traités avec libération prolongée bupropion, NTS et placebo, respectivement. La majorité de ces patients avaient preuve d'hypertension préexistante. Trois patients (1.2%) traités avec le combinaison D'un Zyban® et NTS et 1 patient (0.4%) traités par NTS avaient médicament de l'étude arrêté en raison de l'hypertension par rapport à aucun des patients traité avec une formulation à libération prolongée de bupropion ou placebo. Surveiller de la pression artérielle est recommandée chez les patients qui reçoivent la combinaison de bupropion et remplacement de la nicotine
Il n'existe aucune expérience clinique établissant l'innocuité de BUDEPRION XL™ (comprimés à libération prolongée de chlorhydrate de bupropion) chez les patients ayant des antécédents récents d'infarctus du myocarde ou de cœur instable maladie. Par conséquent, des précautions doivent être prises s'il est utilisé dans ces groupes. Le Bupropion était bien toléré chez les patients déprimés qui avaient précédemment développé hypotension orthostatique tout en recevant des antidépresseurs tricycliques, et a également été généralement bien toléré dans un groupe de 36 patients hospitalisés déprimés avec congestive stable insuffisance cardiaque (CHF). Cependant, le bupropion était associé à une augmentation du Couchant la pression artérielle dans l'étude des patients atteints D'ICC, entraînant l'arrêt du traitement de traitement chez 2 patients pour l'exacerbation de l'hypertension initiale
Insuffisance Hépatique
BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée) doit être utilisé avec une extrême prudence chez les patients présentant la cirrhose hépatique. Chez ces patients, une fréquence et/ou une dose réduites sont nécessaires. BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée) doit être utilisé avec prudence chez les patients présentant une insuffisance hépatique (y compris une cirrhose hépatique légère à modérée) et une fréquence réduite et/ou la dose doit être envisagée chez les patients présentant une cirrhose hépatique légère à modérée.
Tous les patients présentant une insuffisance hépatique devraient être étroitement surveillés pour possible effets indésirables pouvant indiquer des taux élevés de médicaments et de métabolites (voir CLINIQUE PHARMACOLOGIE, AVERTISSEMENT, et DOSAGE ET DE L'ADMINISTRATION).
Insuffisance Rénale
Il existe peu d'informations sur la pharmacocinétique du bupropion chez les patients avec insuffisance rénale. Une comparaison inter-étude entre les sujets normaux et les patients atteints d'insuffisance rénale terminale ont démontré que le médicament Parent Cmax et les valeurs de L'ASC étaient comparables dans les 2 groupes, alors que l'hydroxybupropion et les métabolites de thréohydrobupropion avaient un 2.3 et 2.Augmentation de 8 fois, respectivement, dans L'ASC chez les patients présentant une insuffisance rénale terminale. Le Bupropion est largement métabolisé dans le foie aux métabolites actifs, qui sont en outre métabolisés et par la suite excrété par les reins. BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée) doit être utilisé avec prudence dans les patients présentant une insuffisance rénale et une fréquence et/ou une dose réduites doivent être considéré comme bupropion et les métabolites du bupropion peuvent s'accumuler dans ces patients dans une plus grande mesure que d'habitude. Le patient doit être surveillé de près pour les effets indésirables possibles qui pourraient indiquer des niveaux élevés de médicaments ou de métabolites
Les Tests De Laboratoire
Aucun test de laboratoire spécifique n'est recommandé.
Carcinogenèse, mutagenèse, altération de la fertilité
Des études de cancérogénicité à vie ont été réalisées chez le rat et la souris à des doses allant jusqu'à de 300 et 150 mg/kg/jour, respectivement. Ces doses sont d'environ 7 et 2 fois la dose humaine maximale recommandée (MRHD), respectivement, sur un mg / m2 base. Dans l'étude chez le rat il y avait une augmentation des lésions prolifératives nodulaires du foie à des doses de 100 à 300 mg/kg/jour (environ 2 à 7 fois la MRHD en mg/m2), les doses plus faibles n'ont pas été testées. La question de savoir si ou non de telles lésions peuvent être des précurseurs de tumeurs du foie est actuellement irrésolu. Des lésions hépatiques similaires n'ont pas été observées dans l'étude chez la souris et aucune augmentation n'a été observée dans les tumeurs malignes du foie et d'autres organes ont été vues dans l'étude
Le Bupropion a produit une réponse positive (2 à 3 fois le taux de mutation témoin) dans 2 des 5 souches du test de mutagénicité bactérienne D'Ames et une augmentation de aberrations chromosomiques dans 1 de 3 in vivo moelle osseuse de rat cytogénétique étude. Une étude de fertilité chez le rat à des doses allant jusqu'à 300 mg / kg / jour a révélé signe d'altération de la fertilité.
Grossesse
Des Effets Tératogènes
Grossesse catégorie C
Dans les études menées chez le rat et le lapin, le bupropion a été administré par voie orale à des doses allant jusqu'à 450 et 150 mg/kg/jour, respectivement (environ 11 et 7 fois la dose maximale recommandée chez l'homme [MRHD], respectivement, en mg / m2), au cours de la période de l'organogenèse. Aucune preuve claire d'activité tératogène a été trouvé chez l'une ou l'autre espèce, cependant, chez le lapin, l'incidence a légèrement augmenté des malformations fœtales et des variations squelettiques ont été observées à la dose la plus faible testé (25 mg / kg / jour, approximativement égal à la MRHD sur une base mg/m2) et plus. Une diminution du poids fœtal a été observée à 50 mg/kg et plus. Lorsque des rats ont reçu du bupropion à des doses orales allant jusqu'à 300 mg/kg/jour (environ 7 fois la MRHD sur une base mg / m2) avant l'accouplement et tout au long de la grossesse et la lactation, il n'y avait pas d'effets indésirables apparents sur le développement de la progéniture.
Une étude a été menée chez des femmes enceintes. Cette rétrospective, de gestion des soins l'étude de base de données a évalué le risque de malformations congénitales en général, et cardiovasculaire malformations en particulier, suite à une exposition au bupropion au cours du premier trimestre par rapport au risque de ces malformations suite à une exposition à d'autres antidépresseurs au premier trimestre et bupropion En dehors du premier trimestre. Cette étude inclus 7 005 nourrissons exposés aux antidépresseurs pendant la grossesse, 1 213 dont ont été exposés au bupropion au cours du premier trimestre. L'étude a montré aucune plus grand risque de malformations congénitales en général ou de malformations cardiovasculaires plus précisément, après l'exposition au bupropion du premier trimestre par rapport à l'exposition à tous les autres antidépresseurs dans le premier trimestre, ou bupropion En dehors de le premier trimestre de la grossesse. Les résultats de cette étude n'ont pas été corroborés. BUDEPRION XL™ ne doit être utilisé pendant la grossesse que si le bénéfice potentiel le justifie le risque potentiel pour le foetus
Le travail et l'accouchement
L'effet de BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée) sur le travail et l'accouchement chez l'homme est inconnu.
Les Mères Qui Allaitent
Comme beaucoup d'autres médicaments, le bupropion et ses métabolites sont sécrétés chez l'homme lait. En raison du potentiel d'effets indésirables graves chez les nourrissons qui allaitent à partir de BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée), une décision doit être prise quant à l'arrêt des soins infirmiers ou arrêter le médicament, en tenant compte de l'importance du médicament pour mère.
Utilisation Pédiatrique
L'innocuité et l'efficacité dans la population pédiatrique n'ont pas été établies (voir AVERTISSEMENT EN BOÎTE et AVERTISSEMENT, Aggravation clinique et risque de Suicide). Quiconque envisage l'utilisation de BUDEPRION XL™ chez un enfant ou un adolescent doit équilibrer les risques potentiels avec le besoin clinique.
Utilisation Gériatrique
Sur les quelque 6 000 patients ayant participé à des essais cliniques avec bupropion comprimés à libération prolongée (études sur la dépression et le sevrage tabagique), 275 étaient âgés de ≥ 65 ans et 47 de ≥ 75 ans. En outre, plusieurs cent patients de 65 ans et plus ont participé à des essais cliniques utilisant la libération immédiate formulation de bupropion (études sur la dépression). Aucune différence globale en matière de sécurité ou efficacité ont été observées entre ces sujets et les sujets plus jeunes. L'expérience clinique rapportée n'a pas révélé de différences dans les réponses entre les patients âgés et plus jeunes, mais une plus grande sensibilité de certaines personnes âgées ne peut pas être exclu
Une étude pharmacocinétique à dose unique a démontré que l'élimination du bupropion et ses métabolites chez les sujets âgés étaient similaires à ceux des sujets plus jeunes, cependant, une autre étude pharmacocinétique, dose unique et multiple, a suggéré que les personnes âgées courent un risque accru d'accumulation de bupropion et de ses métabolites (voir PHARMACOLOGIE CLINIQUE).
Le Bupropion est largement métabolisé dans le foie en métabolites actifs, qui sont ensuite métabolisés et excrétés par les reins. Le risque de réaction toxique pour ce médicament peut être plus chez les patients présentant une insuffisance rénale. Parce les patients âgés sont plus susceptibles d'avoir une diminution de la fonction rénale, les soins doivent être pris dans la sélection de dose, et il peut être utile de surveiller la fonction rénale (voir PRÉCAUTION, Insuffisance Rénale et POSOLOGIE ET ADMINISTRATION).

EFFETS SECONDAIRES
(Voir aussi AVERTISSEMENT et PRÉCAUTION.)
Trouble Dépressif Majeur
BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée) a été démontré pour avoir une biodisponibilité similaire à la fois à la formulation à libération immédiate du bupropion et à libération prolongée formulation du bupropion (voir PHARMACOLOGIE CLINIQUE). Information inclus en vertu de cette sous section est fondée principalement sur des données provenant de cliniques contrôlées essais avec la formulation à libération prolongée de bupropion.
Effets indésirables entraînant L'arrêt du traitement avec libération immédiate ou Formulations à libération prolongée de Bupropion
Dans les essais cliniques contrôlés versus placebo, 9% et 11% des patients traités par 300 et 400 mg/jour, respectivement, de la formulation à libération prolongée de bupropion et 4% des patients traités par placebo ont interrompu le traitement en raison d'effets indésirables événement. Les effets indésirables spécifiques de ces essais qui ont conduit à l'arrêt du traitement chez au moins 1% des patients traités par 300 mg / jour ou 400 mg / jour de l' formulation à libération prolongée de bupropion, et à un taux au moins deux fois la le taux de placebo sont énumérés dans Tableau 4.
Tableau 4. Arrêt du traitement en raison d'événements irréalisables
dans les essais contrôlés par Placebo
| Les Événements Irréalisables Equipe |
À libération prolongée la formulation de bupropion 300 mg / jour (n = 376) |
À libération prolongée la formulation de bupropion 400mg / jour (n = 114) |
Placebo (n = 385) |
| Fessier | 2.4% | 0.9% | 0.0% |
| Nausée | 0.8% | 1.8% | 0.3% |
| Agitation | 0.3% | 1.8% | 0.3% |
| Migraine | 0.0% | 1.8% | 0.3% |
Dans les essais cliniques avec la formulation à libération immédiate de bupropion10, % des patients et des volontaires interrompu en raison d'un événement indésirable. Les événements résultant dans l'arrêt, en plus de ceux énumérés ci-dessus pour la libération prolongée formule de bupropion, comprend des vomissements, des convulsions et des troubles du sommeil.
Effets indésirables survenant à une Incidence de 1% ou plus chez les Patients traités Avec les Formulations à libération immédiate ou à libération prolongée de Bupropion
Tableau 5 énumère les événements indésirables liés au traitement qui se sont produits parmi patients traités avec 300 et 400 mg/jour de la formulation à libération prolongée de bupropion et avec placebo dans les essais contrôlés. Les événements qui ont eu lieu dans soit 300 ou 400 mg/jour à une fréquence de 1% ou plus et sont plus fréquents que dans le groupe placebo sont inclus. Les effets indésirables signalés étaient classé à l'aide d'un dictionnaire basé sur COSTART.
Estimations précises de l'incidence des effets indésirables associés à l'utilisation de tout médicament sont difficiles à obtenir. Les estimations sont influencées par la dose de médicament, technique de détection, réglage, jugements du médecin, etc. Les chiffres cités ne peuvent pas être utilisé pour prédire avec précision l'incidence des événements indésirables dans le cadre de la pratique médicale habituelle où les caractéristiques du patient et d'autres facteurs diffèrent de ceux qui ont prévalu dans les essais cliniques. Ces chiffres d'incidence également ne peuvent pas être comparés à ceux obtenus à partir d'autres études cliniques impliquant les médicaments connexes étant donné que chaque groupe d'essais de médicaments est mené dans un cadre différent ensemble de conditions
Enfin, il est important de souligner que la tabulation ne reflète pas la gravité relative et / ou l'importance clinique des événements. Une meilleure perspective sur les événements indésirables graves associés à l'utilisation de bupropion est fourni dans le AVERTISSEMENT et PRÉCAUTION section.
Tableau 5. Effets indésirables liés au traitement contrôlés par Placebo
Essai*
| Système Corporel/Événement Indésirable | À libération prolongée la formulation de bupropion 300 mg / jour (n = 376) |
À libération prolongée la formulation de bupropion 400 mg / jour (n = 114) |
Placebo (n = 385) |
| Corps D'Armée (Général) | |||
| Mal | 26% | 25% | 23% |
| Infection | 8% | 9% | 6% |
| Les douleurs abdominales | 3% | 9% | 2% |
| Asthenie | 2% | 4% | 2% |
| Douleur à la poitrine | 3% | 4% | 1% |
| Douleur | 2% | 3% | 2% |
| Fièvre | 1% | 2% | -- |
| Cardiovasculaire | |||
| Palpitation | 2% | 6% | 2% |
| Rinçage | 1% | 4% | -- |
| Migraine | 1% | 4% | 1% |
| Bouffée | 1% | 3% | 1% |
| Digestif | |||
| Sécheresse de la bouche | 17% | 24% | 7% |
| Nausée | 13% | 18% | 8% |
| Constipation | 10% | 5% | 7% |
| Diarrhée | 5% | 7% | 6% |
| Anorexie | 5% | 3% | 2% |
| Vomissement | 4% | 2% | 2% |
| Dysphagie | 0% | 2% | 0% |
| Musculo-squelettiques | |||
| Myalgie | 2% | 6% | 3% |
| Arthralgie | 1% | 4% | 1% |
| Arthrite | 0% | 2% | 0% |
| Twitch | 1% | 2% | -- |
| Système Nerveux | |||
| Insomia | 11% | 16% | 6% |
| Vertige | 7% | 11% | 5% |
| Agitation | 3% | 9% | 2% |
| Anxiété | 5% | 6% | 3% |
| Tremblement | 6% | 3% | 1% |
| Nervosité | 5% | 3% | 3% |
| Somnolence | 2% | 3% | 2% |
| Irritabilité | 3% | 2% | 2% |
| Mémoire a diminué | -- | 3% | 1% |
| Paresthésie | 1% | 2% | 1% |
| Stimulation du système nerveux Central | 2% | 1% | 1% |
| Respiratoire | |||
| Pharyngite | 3% | 11% | 2% |
| Sinusite | 3% | 1% | 2% |
| Augmentation de la toux | 1% | 2% | 1% |
| Peau | |||
| La Transpiration | 6% | 5% | 2% |
| Fessier | 5% | 4% | 1% |
| Le prurit | 2% | 4% | 2% |
| Urticaire | 2% | 1% | 0% |
| Sens spéciaux | |||
| Acouphènes | 6% | 6% | 2% |
| Altération Du Goût | 2% | 4% | -- |
| Amblyopie | 3% | 2% | 2% |
| Génito | |||
| La fréquence urinaire | 2% | 5% | 2% |
| L'Urgence Urinaire | -- | 2% | 0% |
| Vaginal | 0% | 2% | -- |
| Hémorragie† | |||
| Infection des voies urinaires | 1% | 0% | -- |
| * Événements irréalisables survenus dans au moins
1% des patients traités avec 300 ou 400 mg / jour de la libération
formulation de bupropion, mais également ou plus fréquemment dans le placebo
groupe, étaient: rêves anormaux, blessure accidentelle, acné, augmentation de l'appétit,
maux de dos, bronchite, dysménorrhée, dyspepsie, flatulences, syndrome grippal,
l'hypertension, douleur au cou, difficulté respiratoire, rhinite et de la difficulté dentaire. † Incidence basée sur le nombre de patientes. -- Trait d'Union désigne les événements irréalisables survenant dans plus de 0 mais moins que 0,5% des patients. |
|||
Événements supplémentaires à ceux énumérés dans Tableau 5 cela s'est produit à une incidence d'au moins 1% dans les essais cliniques contrôlés de la formulation à libération immédiate de bupropion (300 à 600 mg / jour) et qui étaient numériquement plus fréquents que le placebo était: arythmies cardiaques (5% vs 4%), hypertension (4% vs 2%), hypotension (3% vs 2%), la tachycardie (11% vs 9%), augmentation de l'appétit (4% vs 2%), la dyspepsie (3% vs 2%), les troubles menstruels (5% vs 1%), acathisie (2% vs 1%), de troubles de la la qualité du sommeil (4% vs 2%), troubles sensoriels (4% vs 3%), la confusion (8% vs 5%), diminution de la libido (3% vs 2%), hostilité (6% vs 4%), troubles auditifs (5% vs 3%), et la perturbation gustative (3% vs 1%).
Incidence des effets indésirables fréquemment observés dans les essais cliniques contrôlés
Les événements indésirables de l' Tableau 5 survenus chez au moins 5% des patients traités avec la formulation à libération prolongée de bupropion et à un taux au moins deux fois le taux de placebo est indiqué ci-dessous pour les groupes de doses de 300 et 400 mg/jour.
300 mg / jour de la Formulation à libération prolongée:L'anorexie, sécheresse de la bouche, éruption cutanée, transpiration, acouphènes et tremblements.
400 mg / jour de la Formulation à libération prolongée: Les douleurs abdominales, agitation, anxiété, vertiges, bouche sèche, insomnie, myalgie, nausée, palpitations, pharyngite, transpiration, acouphènes et fréquence urinaire.
Autres événements observés au cours du développement clinique et de L'expérience post commercialisation de Bupropion
En plus des événements indésirables signalés ci-dessus, les événements suivants ont été rapporté dans les essais cliniques et l'expérience post-commercialisation avec la libération prolongée formulation de bupropion chez les patients déprimés et chez les fumeurs non déprimés, ainsi que dans les essais cliniques et l'expérience clinique post commercialisation avec le formulation à libération immédiate de bupropion.
Les effets indésirables dont les fréquences sont indiquées ci-dessous se sont produits essais avec la formulation à libération prolongée de bupropion. Fréquence représente la proportion de patients ayant subi un traitement indésirable événement à au moins une occasion dans les études contrôlées versus placebo pour la dépression (n = 987) ou le sevrage tabagique (n = 1 013), ou les patients ayant événement nécessitant l'arrêt du traitement dans une étude de surveillance en Ouvert avec la formulation à libération prolongée de bupropion (n = 3 100). Tout traitement émergent les effets indésirables sont inclus à l'exception de ceux énumérés dans Les tableaux 2 travers 5, les événements énumérés dans d'autres sections liées à l'innocuité, ces événements indésirables sous COSTART des termes trop généraux ou trop spécifiques donc pour ne pas être informatif, ces événements ne sont pas raisonnablement associés à l'utilisation de la drogue, et les événements qui n'étaient pas graves et se sont produits dans moins de 2 patients. Les événements d'importance clinique majeure sont décrits dans AVERTISSEMENT et PRÉCAUTION les sections de l'étiquetage.
Les événements sont ensuite classés par système de corps et répertoriés par ordre décroissant fréquence selon les définitions suivantes de fréquence: fréquent défavorable les événements sont définis comme ceux survenant chez au moins 1/100 patients. Fréquent les événements indésirables sont ceux survenant chez 1/100 à 1/1 000 patients, bien que rares les événements sont ceux survenant chez moins de 1/1 000 patients.
Les effets indésirables pour lesquels les fréquences ne sont pas fournies se sont produits essais ou expérience post-commercialisation avec bupropion. Seulement ces effets indésirables le bupropion à libération prolongée n'a pas été répertorié auparavant. Étendue on ne sait pas à quoi ces événements peuvent être associés avec BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée).
Corps D'Armée (Général): Frissons, œdème facial, musculo-squelettique étaient rares douleur thoracique et photosensibilité. Rare était le malaise. On a également observé une arthralgie, myalgie et fièvre avec éruption cutanée et autres symptômes suggérant une hypersensibilité retardée. Ces symptômes peuvent ressembler à la maladie sérique (voir PRÉCAUTION).
Cardiovasculaire: Peu fréquents étaient hypotension posturale, accident vasculaire cérébral, tachycardie et vasodilatation. Rare était la syncope. Également observé étaient complets bloc auriculo-ventriculaire, extrasystoles, hypotension, hypertension (dans certains cas grave, voir PRÉCAUTION), infarctus du myocarde, phlébite, et pulmonaire embolie. Digestif: Peu fréquents étaient une fonction hépatique anormale, bruxisme, reflux gastrique, gingivite, glossite, augmentation de la salivation, jaunisse, ulcères de la bouche, stomatite et soif. Rare était l'œdème de la langue. Aussi observé étaient la colite, oesophagite, hémorragie gastro-intestinale, hémorragie gingivale, hépatite, perforation intestinale, lésions hépatiques, pancréatite et ulcère de l'estomac.
Endocrinien: On a également observé une hyperglycémie, une hypoglycémie et syndrome d'hormone antidiurétique inappropriée.
Hémic et lymphatique: Peu fréquent était l'ecchymose. Aussi observé étaient l'anémie, leucocytose, leucopénie, lymphadénopathie, pancytopénie, thrombocytopénie. Altéré PT et / ou INR, rarement associé à hémorragique ou thrombotique des complications ont été observées lorsque le bupropion était administré en association avec la warfarine.
Métabolique et nutritionnel: Peu fréquents étaient l'œdème et périphérique œdème. Également observée était de glycosurie.
Musculo-squelettiques: Rares étaient les crampes aux jambes. Également observés ont été rigidité musculaire / fièvre / rhabdomyolyse et faiblesse musculaire.
Système Nerveux: Peu fréquents étaient une coordination anormale, diminuée libido, dépersonnalisation, dysphorie, labilité émotionnelle, hostilité, hyperkinésie, hypertonie, hypesthésie, idées suicidaires et vertiges. Rares étaient l'amnésie, ataxie, déréalisation et hypomanie. On a également observé un électroencéphalogramme anormal (EEG), agression, akinésie, aphasie, coma, délire, délires, dysarthrie, dyskinésie, dystonie, euphorie, syndrome extrapyramidal, hallucinations, hypokinésie, augmentation de la libido, réaction maniaque, névralgie, neuropathie, idéation paranoïaque, l'agitation, et démasquer la dyskinésie tardive.
Respiratoire: Rare était bronchospasme. Une pneumonie a également été observée.
Peau: Rare était une éruption maculopapulaire. L'alopécie a également été observée, angioedema, exfoliative " > dermatite et hirsutisme.
Sens Spéciaux: Rares étaient les anomalies d'accommodation et la sécheresse oculaire. On a également observé une surdité, une diplopie, une augmentation de la pression intraoculaire, et mydriase.
Génito: Peu fréquents étaient l'impuissance, la polyurie et la prostate troubles. On a également observé une éjaculation anormale, une cystite, une dyspareunie, une dysurie, gynécomastie, ménopause, érection douloureuse, salpingite, incontinence urinaire, rétention urinaire et vaginite.
L'Abus Des Drogues Et De La Dépendance
Classe De Substance Contrôlée
Le Bupropion n'est pas une substance contrôlée.
Humain
Études cliniques contrôlées de bupropion (formulation à libération immédiate) menées chez les volontaires normaux, chez les sujets ayant des antécédents de toxicomanie multiple, et chez les patients déprimés ont montré une certaine augmentation de l'activité motrice et de l'agitation/excitation.
Dans une population de personnes ayant subi des abus de drogues, une dose unique de 400 mg de bupropion produit une légère activité de type amphétamine par rapport à placebo sur la sous-échelle Morphine-benzédrine du Centre de recherche sur les dépendances Inventaires (ARCI) , et un score intermédiaire entre le placebo et l'amphétamine sur L'échelle de goût de L'ARCI. Ces échelles mesurent les sentiments généraux d'euphorie de drogue et de désirabilité.
Les résultats des essais cliniques, cependant, ne sont pas connus pour prédire de manière fiable potentiel d'abus de drogues. Néanmoins, les preuves provenant des études à dose unique ne suggérer que la posologie quotidienne recommandée de bupropion lorsqu'il est administré dans les doses divisées ne sont pas susceptibles de renforcer particulièrement l'amphétamine ou le stimulant agresseur. Cependant, des doses plus élevées qui n'ont pas pu être testées en raison du risque de crise pourrait être modestement attrayant pour ceux qui abusent de drogues stimulantes.
Animal
Des études chez les rongeurs et les primates ont montré que le bupropion présente certains effets pharmacologiques actions communes aux psychostimulants. Chez les rongeurs, il a été démontré qu'il augmentait activité locomotrice, susciter une légère réponse comportementale stéréotypée, et augmenter taux de réponse dans plusieurs paradigmes de comportement contrôlés par le calendrier. Dans primates modèles pour évaluer les effets positifs de renforcement des médicaments psychoactifs, bupropion a été auto-administré par voie intraveineuse. Chez le rat, le bupropion a produit des amphétamines et effets de stimulus discriminatoires similaires à la cocaïne dans les paradigmes de la discrimination fondée sur la drogue utilisé pour caractériser les effets subjectifs des drogues psychoactives
INTERACTIONS MÉDICAMENTEUSES
Peu de données systémiques ont été recueillies sur le métabolisme du bupropion suivant l'administration concomitante avec d'autres médicaments, ou, alternativement, l'effet de l'administration concomitante de bupropion sur le métabolisme d'autres médicaments. Parce bupropion est largement métabolisé, la coadministration d'autres médicaments peut affecter son activité clinique. In vitro des études indiquent que le bupropion est principalement métabolisé en hydroxybupropion par L'isoenzyme CYP2B6. Donc, il existe un potentiel d'interaction médicamenteuse entre BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée) et médicaments qui sont des substrats ou des inhibiteurs de L'isoenzyme CYP2B6 (p. ex., l'orphénadrine, thiotépa et cyclophosphamide). Outre, in vitro des études suggèrent que la paroxétine, la sertraline, la norfluoxétine et la fluvoxamine ainsi que le nelfinavir, le ritonavir et l'éfavirenz inhibent l'hydroxylation du bupropion. Pas de données cliniques des études ont été réalisées pour évaluer ce résultat. Le threohydrobupropion le métabolite du bupropion ne semble pas être produit par le cytochrome P450 les isoenzymes. Les effets de l'administration concomitante de cimétidine sur la pharmacocinétique le bupropion et ses métabolites actifs ont été étudiés chez 24 jeunes hommes en bonne santé bénévole. Après administration orale de deux comprimés de 150 mg à libération prolongée formulation de bupropion avec et sans 800 mg de cimétidine, la pharmacocinétique de bupropion et d'hydroxybupropion n'ont pas été affectés. Cependant, il y avait 16% et Augmentation de 32% de l'ASC et de la Cmax, respectivement, des fractions combinées de thréohydrobupropion et érythrohydrobupropion
Bien qu'ils ne soient pas systématiquement étudiés, certains médicaments peuvent induire le métabolisme de bupropion (p. ex. carbamazépine, phénobarbital, phénytoïne).
Des doses orales multiples de bupropion n'ont eu aucun effet statistiquement significatif sur la pharmacocinétique à dose unique de la lamotrigine chez 12 volontaires sains.
Les données animales indiquent que le bupropion peut être un inducteur de la métabolisation du médicament enzymes chez l'homme. Dans une étude, après administration chronique de bupropion, 100 mg 3 fois par jour à 8 volontaires masculins en bonne santé pendant 14 jours, il n'y avait pas la preuve de l'induction de son propre métabolisme. Néanmoins, il peut être le risque d'altérations cliniquement importantes des taux sanguins de coadministrés drogue.
Médicaments métabolisés par le Cytochrome P450IID6 (CYP2D6)
De nombreux médicaments, y compris la plupart des antidépresseurs (ISRS, de nombreux tricycliques), les bêta-bloquants, les antiarythmiques et les antipsychotiques sont métabolisés par L'isoenzyme CYP2D6. Bien que le bupropion ne soit pas métabolisé par cette isoenzyme, le bupropion et l'hydroxybupropion sont des inhibiteurs de L'isoenzyme CYP2D6 in vitro. Dans une étude de 15 sujets masculins (âgés de 19 à 35 ans) qui étaient des métaboliseurs étendus de L'isoenzyme CYP2D6, doses quotidiennes de bupropion administrées à raison de 150 mg deux fois par jour suivies d'une dose unique de 50 mg de désipramine a augmenté la Cmax, L'ASC et la t½ de désipramine par une moyenne d'environ 2, 5, et 2 fois, respectivement.
L'effet était présent pour au moins 7 jours après la dernière dose de bupropion. L'utilisation concomitante du bupropion avec d'autres médicaments métabolisés par le CYP2D6 n'a pas été formellement étudié.
Par conséquent, la coadministration du bupropion avec des médicaments métabolisés par Isoenzyme CYP2D6 incluant certains antidépresseurs (e.g., la nortriptyline, l'imipramine, désipramine, paroxétine, fluoxétine, sertraline), antipsychotiques (e.g., halopéridol, rispéridone, thioridazine), bêta-bloquants (e.g., métoprolol) et antiarythmiques de Type 1C (e.g., propafénone, flécaïnide), doit être abordée avec prudence et devraient être initié à l'extrémité inférieure de la plage de doses du médicament concomitant. Si le bupropion est ajouté au régime de traitement d'un patient déjà recevant un médicament métabolisé par le CYP2D6, la nécessité de diminuer la dose de l'original des médicaments doivent être envisagés, en particulier pour les médicaments concomitants avec un indice thérapeutique étroit
Inhibiteurs de la MAO
Des études chez l'animal démontrent que la toxicité aiguë du bupropion est renforcée par l'inhibiteur de la MAO phénelzine (voir Contre-indications).
Lévodopa et Amantadine
Les données cliniques limitées suggèrent une incidence plus élevée d'expériences indésirables dans patients recevant du bupropion en même temps que la lévodopa ou l'amantadine. Administration de BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée) à des patients recevant soit de la lévodopa ou amantadine en même temps doit être entrepris avec prudence, en utilisant petite initiale doses et augmentations de dose graduelles.
Médicaments Qui Abaissent Le Seuil De Saisie
Administration concomitante de BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée) et d'agents (p. ex. antipsychotiques, autres antidépresseurs, théophylline, stéroïdes systémiques, etc.) cette saisie inférieure le seuil ne doit être pris qu'avec une extrême prudence (voir AVERTISSEMENT). Une faible dose initiale et une augmentation progressive de la dose doivent être utilisées.
Nicotine Système Transdermique
(voir PRÉCAUTION, Effets Cardiovasculaires).
L'alcool
Dans l'expérience post-commercialisation, il y a eu de rares rapports d'effets neuropsychiatriques indésirables événements ou tolérance réduite à l'alcool chez les patients qui buvaient de l'alcool pendant traitement avec bupropion. La consommation d'alcool pendant le traitement par BUDEPRION XL™ doit être minimisé ou évité (voir aussi Contre-indications).

Des Effets Tératogènes
Grossesse catégorie C
Dans les études menées chez le rat et le lapin, le bupropion a été administré par voie orale à des doses allant jusqu'à 450 et 150 mg/kg/jour, respectivement (environ 11 et 7 fois la dose maximale recommandée chez l'homme [MRHD], respectivement, en mg / m2), au cours de la période de l'organogenèse. Aucune preuve claire d'activité tératogène a été trouvé chez l'une ou l'autre espèce, cependant, chez le lapin, l'incidence a légèrement augmenté des malformations fœtales et des variations squelettiques ont été observées à la dose la plus faible testé (25 mg / kg / jour, approximativement égal à la MRHD sur une base mg/m2) et plus. Une diminution du poids fœtal a été observée à 50 mg/kg et plus. Lorsque des rats ont reçu du bupropion à des doses orales allant jusqu'à 300 mg/kg/jour (environ 7 fois la MRHD sur une base mg / m2) avant l'accouplement et tout au long de la grossesse et la lactation, il n'y avait pas d'effets indésirables apparents sur le développement de la progéniture.
Une étude a été menée chez des femmes enceintes. Cette rétrospective, de gestion des soins l'étude de base de données a évalué le risque de malformations congénitales en général, et cardiovasculaire malformations en particulier, suite à une exposition au bupropion au cours du premier trimestre par rapport au risque de ces malformations suite à une exposition à d'autres antidépresseurs au premier trimestre et bupropion En dehors du premier trimestre. Cette étude inclus 7 005 nourrissons exposés aux antidépresseurs pendant la grossesse, 1 213 dont ont été exposés au bupropion au cours du premier trimestre. L'étude a montré aucune plus grand risque de malformations congénitales en général ou de malformations cardiovasculaires plus précisément, après l'exposition au bupropion du premier trimestre par rapport à l'exposition à tous les autres antidépresseurs dans le premier trimestre, ou bupropion En dehors de le premier trimestre de la grossesse. Les résultats de cette étude n'ont pas été corroborés. BUDEPRION XL™ ne doit être utilisé pendant la grossesse que si le bénéfice potentiel le justifie le risque potentiel pour le foetus

(Voir aussi AVERTISSEMENT et PRÉCAUTION.)
Trouble Dépressif Majeur
BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée) a été démontré pour avoir une biodisponibilité similaire à la fois à la formulation à libération immédiate du bupropion et à libération prolongée formulation du bupropion (voir PHARMACOLOGIE CLINIQUE). Information inclus en vertu de cette sous section est fondée principalement sur des données provenant de cliniques contrôlées essais avec la formulation à libération prolongée de bupropion.
Effets indésirables entraînant L'arrêt du traitement avec libération immédiate ou Formulations à libération prolongée de Bupropion
Dans les essais cliniques contrôlés versus placebo, 9% et 11% des patients traités par 300 et 400 mg/jour, respectivement, de la formulation à libération prolongée de bupropion et 4% des patients traités par placebo ont interrompu le traitement en raison d'effets indésirables événement. Les effets indésirables spécifiques de ces essais qui ont conduit à l'arrêt du traitement chez au moins 1% des patients traités par 300 mg / jour ou 400 mg / jour de l' formulation à libération prolongée de bupropion, et à un taux au moins deux fois la le taux de placebo sont énumérés dans Tableau 4.
Tableau 4. Arrêt du traitement en raison d'événements indésirables
dans les essais contrôlés par Placebo
| Les Événements Irréalisables Equipe |
À libération prolongée la formulation de bupropion 300 mg / jour (n = 376) |
À libération prolongée la formulation de bupropion 400mg / jour (n = 114) |
Placebo (n = 385) |
| Fessier | 2.4% | 0.9% | 0.0% |
| Nausée | 0.8% | 1.8% | 0.3% |
| Agitation | 0.3% | 1.8% | 0.3% |
| Migraine | 0.0% | 1.8% | 0.3% |
Dans les essais cliniques avec la formulation à libération immédiate de bupropion10, % des patients et des volontaires interrompu en raison d'un événement indésirable. Les événements résultant dans l'arrêt, en plus de ceux énumérés ci-dessus pour la libération prolongée formule de bupropion, comprend des vomissements, des convulsions et des troubles du sommeil.
Effets indésirables survenant à une Incidence de 1% ou plus chez les Patients traités Avec les Formulations à libération immédiate ou à libération prolongée de Bupropion
Tableau 5 énumère les événements indésirables liés au traitement qui se sont produits parmi patients traités avec 300 et 400 mg/jour de la formulation à libération prolongée de bupropion et avec placebo dans les essais contrôlés. Les événements qui ont eu lieu dans soit 300 ou 400 mg/jour à une fréquence de 1% ou plus et sont plus fréquents que dans le groupe placebo sont inclus. Les effets indésirables signalés étaient classé à l'aide d'un dictionnaire basé sur COSTART.
Estimations précises de l'incidence des effets indésirables associés à l'utilisation de tout médicament sont difficiles à obtenir. Les estimations sont influencées par la dose de médicament, technique de détection, réglage, jugements du médecin, etc. Les chiffres cités ne peuvent pas être utilisé pour prédire avec précision l'incidence des événements indésirables dans le cadre de la pratique médicale habituelle où les caractéristiques du patient et d'autres facteurs diffèrent de ceux qui ont prévalu dans les essais cliniques. Ces chiffres d'incidence également ne peuvent pas être comparés à ceux obtenus à partir d'autres études cliniques impliquant les médicaments connexes étant donné que chaque groupe d'essais de médicaments est mené dans un cadre différent ensemble de conditions
Enfin, il est important de souligner que la tabulation ne reflète pas la gravité relative et / ou l'importance clinique des événements. Une meilleure perspective sur les événements indésirables graves associés à l'utilisation de bupropion est fourni dans le AVERTISSEMENT et PRÉCAUTION section.
Tableau 5. Effets indésirables liés au traitement contrôlés par Placebo
Essai*
| Système Corporel/Événement Indésirable | À libération prolongée la formulation de bupropion 300 mg / jour (n = 376) |
À libération prolongée la formulation de bupropion 400 mg / jour (n = 114) |
Placebo (n = 385) |
| Corps D'Armée (Général) | |||
| Mal | 26% | 25% | 23% |
| Infection | 8% | 9% | 6% |
| Les douleurs abdominales | 3% | 9% | 2% |
| Asthenie | 2% | 4% | 2% |
| Douleur à la poitrine | 3% | 4% | 1% |
| Douleur | 2% | 3% | 2% |
| Fièvre | 1% | 2% | -- |
| Cardiovasculaire | |||
| Palpitation | 2% | 6% | 2% |
| Rinçage | 1% | 4% | -- |
| Migraine | 1% | 4% | 1% |
| Bouffée | 1% | 3% | 1% |
| Digestif | |||
| Sécheresse de la bouche | 17% | 24% | 7% |
| Nausée | 13% | 18% | 8% |
| Constipation | 10% | 5% | 7% |
| Diarrhée | 5% | 7% | 6% |
| Anorexie | 5% | 3% | 2% |
| Vomissement | 4% | 2% | 2% |
| Dysphagie | 0% | 2% | 0% |
| Musculo-squelettiques | |||
| Myalgie | 2% | 6% | 3% |
| Arthralgie | 1% | 4% | 1% |
| Arthrite | 0% | 2% | 0% |
| Twitch | 1% | 2% | -- |
| Système Nerveux | |||
| Insomia | 11% | 16% | 6% |
| Vertige | 7% | 11% | 5% |
| Agitation | 3% | 9% | 2% |
| Anxiété | 5% | 6% | 3% |
| Tremblement | 6% | 3% | 1% |
| Nervosité | 5% | 3% | 3% |
| Somnolence | 2% | 3% | 2% |
| Irritabilité | 3% | 2% | 2% |
| Mémoire a diminué | -- | 3% | 1% |
| Paresthésie | 1% | 2% | 1% |
| Stimulation du système nerveux Central | 2% | 1% | 1% |
| Respiratoire | |||
| Pharyngite | 3% | 11% | 2% |
| Sinusite | 3% | 1% | 2% |
| Augmentation de la toux | 1% | 2% | 1% |
| Peau | |||
| La Transpiration | 6% | 5% | 2% |
| Fessier | 5% | 4% | 1% |
| Le prurit | 2% | 4% | 2% |
| Urticaire | 2% | 1% | 0% |
| Sens spéciaux | |||
| Acouphènes | 6% | 6% | 2% |
| Altération Du Goût | 2% | 4% | -- |
| Amblyopie | 3% | 2% | 2% |
| Génito | |||
| La fréquence urinaire | 2% | 5% | 2% |
| L'Urgence Urinaire | -- | 2% | 0% |
| Vaginal | 0% | 2% | -- |
| Hémorragie† | |||
| Infection des voies urinaires | 1% | 0% | -- |
| * Événements irréalisables survenus dans au moins
1% des patients traités avec 300 ou 400 mg / jour de la libération
formulation de bupropion, mais également ou plus fréquemment dans le placebo
groupe, étaient: rêves anormaux, blessure accidentelle, acné, augmentation de l'appétit,
maux de dos, bronchite, dysménorrhée, dyspepsie, flatulences, syndrome grippal,
l'hypertension, douleur au cou, difficulté respiratoire, rhinite et de la difficulté dentaire. † Incidence basée sur le nombre de patientes. -- Trait d'Union désigne les événements irréalisables survenant dans plus de 0 mais moins que 0,5% des patients. |
|||
Événements supplémentaires à ceux énumérés dans Tableau 5 cela s'est produit à une incidence d'au moins 1% dans les essais cliniques contrôlés de la formulation à libération immédiate de bupropion (300 à 600 mg / jour) et qui étaient numériquement plus fréquents que le placebo était: arythmies cardiaques (5% vs 4%), hypertension (4% vs 2%), hypotension (3% vs 2%), la tachycardie (11% vs 9%), augmentation de l'appétit (4% vs 2%), la dyspepsie (3% vs 2%), les troubles menstruels (5% vs 1%), acathisie (2% vs 1%), de troubles de la la qualité du sommeil (4% vs 2%), troubles sensoriels (4% vs 3%), la confusion (8% vs 5%), diminution de la libido (3% vs 2%), hostilité (6% vs 4%), troubles auditifs (5% vs 3%), et la perturbation gustative (3% vs 1%).
Incidence des effets indésirables fréquemment observés dans les essais cliniques contrôlés
Les événements indésirables de l' Tableau 5 survenus chez au moins 5% des patients traités avec la formulation à libération prolongée de bupropion et à un taux au moins deux fois le taux de placebo est indiqué ci-dessous pour les groupes de doses de 300 et 400 mg/jour.
300 mg / jour de la Formulation à libération prolongée:L'anorexie, sécheresse de la bouche, éruption cutanée, transpiration, acouphènes et tremblements.
400 mg / jour de la Formulation à libération prolongée: Les douleurs abdominales, agitation, anxiété, vertiges, bouche sèche, insomnie, myalgie, nausée, palpitations, pharyngite, transpiration, acouphènes et fréquence urinaire.
Autres événements observés au cours du développement clinique et de L'expérience post commercialisation de Bupropion
En plus des événements indésirables signalés ci-dessus, les événements suivants ont été rapporté dans les essais cliniques et l'expérience post-commercialisation avec la libération prolongée formulation de bupropion chez les patients déprimés et chez les fumeurs non déprimés, ainsi que dans les essais cliniques et l'expérience clinique post commercialisation avec le formulation à libération immédiate de bupropion.
Les effets indésirables dont les fréquences sont indiquées ci-dessous se sont produits essais avec la formulation à libération prolongée de bupropion. Fréquence représente la proportion de patients ayant subi un traitement indésirable événement à au moins une occasion dans les études contrôlées versus placebo pour la dépression (n = 987) ou le sevrage tabagique (n = 1 013), ou les patients ayant événement nécessitant l'arrêt du traitement dans une étude de surveillance en Ouvert avec la formulation à libération prolongée de bupropion (n = 3 100). Tout traitement émergent les effets indésirables sont inclus à l'exception de ceux énumérés dans Les tableaux 2 travers 5, les événements énumérés dans d'autres sections liées à l'innocuité, ces événements indésirables sous COSTART des termes trop généraux ou trop spécifiques donc pour ne pas être informatif, ces événements ne sont pas raisonnablement associés à l'utilisation de la drogue, et les événements qui n'étaient pas graves et se sont produits dans moins de 2 patients. Les événements d'importance clinique majeure sont décrits dans AVERTISSEMENT et PRÉCAUTION les sections de l'étiquetage.
Les événements sont ensuite classés par système de corps et répertoriés par ordre décroissant fréquence selon les définitions suivantes de fréquence: fréquent défavorable les événements sont définis comme ceux survenant chez au moins 1/100 patients. Fréquent les événements indésirables sont ceux survenant chez 1/100 à 1/1 000 patients, bien que rares les événements sont ceux survenant chez moins de 1/1 000 patients.
Les effets indésirables pour lesquels les fréquences ne sont pas fournies se sont produits essais ou expérience post-commercialisation avec bupropion. Seulement ces effets indésirables le bupropion à libération prolongée n'a pas été répertorié auparavant. Étendue on ne sait pas à quoi ces événements peuvent être associés avec BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée).
Corps D'Armée (Général): Frissons, œdème facial, musculo-squelettique étaient rares douleur thoracique et photosensibilité. Rare était le malaise. On a également observé une arthralgie, myalgie et fièvre avec éruption cutanée et autres symptômes suggérant une hypersensibilité retardée. Ces symptômes peuvent ressembler à la maladie sérique (voir PRÉCAUTION).
Cardiovasculaire: Peu fréquents étaient hypotension posturale, accident vasculaire cérébral, tachycardie et vasodilatation. Rare était la syncope. Également observé étaient complets bloc auriculo-ventriculaire, extrasystoles, hypotension, hypertension (dans certains cas grave, voir PRÉCAUTION), infarctus du myocarde, phlébite, et pulmonaire embolie. Digestif: Peu fréquents étaient une fonction hépatique anormale, bruxisme, reflux gastrique, gingivite, glossite, augmentation de la salivation, jaunisse, ulcères de la bouche, stomatite et soif. Rare était l'œdème de la langue. Aussi observé étaient colite, oesophagite, hémorragie gastro-intestinale, hémorragie gingivale, hépatite, perforation intestinale, lésions hépatiques, pancréatite et ulcère de l'estomac.
Endocrinien: On a également observé une hyperglycémie, une hypoglycémie et syndrome d'hormone antidiurétique inappropriée.
Hémic et lymphatique: Peu fréquent était l'ecchymose. Aussi observé étaient l'anémie, leucocytose, leucopénie, lymphadénopathie, pancytopénie, thrombocytopénie. Altéré PT et / ou INR, rarement associé à hémorragique ou thrombotique des complications ont été observées lorsque le bupropion était administré en association avec la warfarine.
Métabolique et nutritionnel: Peu fréquents étaient l'œdème et périphérique œdème. Également observée était de glycosurie.
Musculo-squelettiques: Rares étaient les crampes aux jambes. Également observés ont été rigidité musculaire / fièvre / rhabdomyolyse et faiblesse musculaire.
Système Nerveux: Peu fréquents étaient une coordination anormale, diminuée libido, dépersonnalisation, dysphorie, labilité émotionnelle, hostilité, hyperkinésie, hypertonie, hypesthésie, idées suicidaires et vertiges. Rares étaient l'amnésie, ataxie, déréalisation et hypomanie. On a également observé un électroencéphalogramme anormal (EEG), agression, akinésie, aphasie, coma, délire, délires, dysarthrie, dyskinésie, dystonie, euphorie, syndrome extrapyramidal, hallucinations, hypokinésie, augmentation de la libido, réaction maniaque, névralgie, neuropathie, idéation paranoïaque, l'agitation, et démasquer la dyskinésie tardive.
Respiratoire: Rare était bronchospasme. Une pneumonie a également été observée.
Peau: Rare était une éruption maculopapulaire. L'alopécie a également été observée, angioedema, exfoliative " > dermatite et hirsutisme.
Sens Spéciaux: Rares étaient les anomalies d'accommodation et la sécheresse oculaire. On a également observé une surdité, une diplopie, une augmentation de la pression intraoculaire, et mydriase.
Génito: Peu fréquents étaient l'impuissance, la polyurie et la prostate troubles. On a également observé une éjaculation anormale, une cystite, une dyspareunie, une dysurie, gynécomastie, ménopause, érection douloureuse, salpingite, incontinence urinaire, rétention urinaire et vaginite.
L'Abus Des Drogues Et De La Dépendance
Classe De Substance Contrôlée
Le Bupropion n'est pas une substance contrôlée.
Humain
Études cliniques contrôlées de bupropion (formulation à libération immédiate) menées chez les volontaires normaux, chez les sujets ayant des antécédents de toxicomanie multiple, et chez les patients déprimés ont montré une certaine augmentation de l'activité motrice et de l'agitation/excitation.
Dans une population de personnes ayant subi des abus de drogues, une dose unique de 400 mg de bupropion produit une légère activité de type amphétamine par rapport à placebo sur la sous-échelle Morphine-benzédrine du Centre de recherche sur les dépendances Inventaires (ARCI) , et un score intermédiaire entre le placebo et l'amphétamine sur L'échelle de goût de L'ARCI. Ces échelles mesurent les sentiments généraux d'euphorie de drogue et de désirabilité.
Les résultats des essais cliniques, cependant, ne sont pas connus pour prédire de manière fiable potentiel d'abus de drogues. Néanmoins, les preuves provenant des études à dose unique ne suggérer que la posologie quotidienne recommandée de bupropion lorsqu'il est administré dans les doses divisées ne sont pas susceptibles de renforcer particulièrement l'amphétamine ou le stimulant agresseur. Cependant, des doses plus élevées qui n'ont pas pu être testées en raison du risque de crise pourrait être modestement attrayant pour ceux qui abusent de drogues stimulantes.
Animal
Des études chez les rongeurs et les primates ont montré que le bupropion présente certains effets pharmacologiques actions communes aux psychostimulants. Chez les rongeurs, il a été démontré qu'il augmentait activité locomotrice, susciter une légère réponse comportementale stéréotypée, et augmenter taux de réponse dans plusieurs paradigmes de comportement contrôlés par le calendrier. Dans primates modèles pour évaluer les effets positifs de renforcement des médicaments psychoactifs, bupropion a été auto-administré par voie intraveineuse. Chez le rat, le bupropion a produit des amphétamines et effets de stimulus discriminatoires similaires à la cocaïne dans les paradigmes de la discrimination fondée sur la drogue utilisé pour caractériser les effets subjectifs des drogues psychoactives

Expérience De Surdosage Humain
Des surdoses allant jusqu'à 30 g ou plus de bupropion ont été rapportées. La saisie a été rapporté dans environ un tiers de tous les cas. Autres réactions graves signalées avec des surdoses de bupropion seul inclus hallucinations, perte de conscience, tachycardie sinusale et changements ECG tels que des troubles de la conduction ou des arythmies. Fièvre, rigidité musculaire, rhabdomyolyse, hypotension, stupeur, coma et respiration des défaillances ont été signalées principalement lorsque le bupropion faisait partie de surdoses multiples.
Bien que la plupart des patients se soient rétablis sans séquelles, les décès associés aux surdoses de bupropion seul ont été rapportés chez des patients ayant ingéré de fortes doses de drogue. Convulsions multiples non contrôlées, bradycardie, insuffisance cardiaque et une arrestation avant le décès a été signalée chez ces patients.
Gestion Du Surdosage
Assurez-vous que les voies respiratoires, l'oxygénation et la ventilation sont adéquates. Surveiller le rythme cardiaque et les signes vitaux. La surveillance de L'EEG est également recommandée pendant les 48 premières heures suivant l'ingestion. Des mesures générales de soutien et symptomatiques sont également recommandées. Induction des vomissements n'est pas recommandé. Lavage gastrique avec un tube orogastrique à gros alésage avec une protection appropriée des voies respiratoires, si nécessaire, peut être indiqué si effectué peu après l'ingestion ou chez les patients symptomatiques.
Du charbon actif doit être administré. Il n'y a aucune expérience avec le l'utilisation de la diurèse forcée, la dialyse, l'hémoperfusion ou transfusion d'échange dans la prise en charge des surdoses de bupropion. Aucun antidote spécifique pour le bupropion ne sont connu.
En raison du risque de convulsions lié à la dose avec BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée), hospitalisation une suspicion de surdosage doit être envisagée. Basé sur des études chez les animaux, il est recommandé de traiter les crises par administration intraveineuse de benzodiazépine et d'autres mesures de soutien, le cas échéant.
Dans la gestion du surdosage, envisager la possibilité d'une implication multiple de médicaments. Le médecin devrait envisager de contacter un CENTRE ANTIPOISON pour plus informations sur le traitement de tout surdosage. Numéros de téléphone pour certifié les centres antipoison sont répertoriés dans le Référence Du Bureau Des Médecins (PDR).

Le Bupropion est un inhibiteur relativement faible de l'absorption neuronale de la noradrénaline et la dopamine, et n'inhibe pas la monoamine oxydase ou la recapture de la sérotonine. Alors que le mécanisme d'action du bupropion, comme avec d'autres antidépresseurs, est inconnu, il est présumé que cette action est médiée par noradrénergique et/ou mécanismes dopaminergiques.

Le Bupropion est un mélange racémique. L'activité pharmacologique et pharmacocinétique des énantiomères individuels n'ont pas été étudiés. La moyenne de la demi-vie d'élimination (±Écart-type) de bupropion après administration chronique est de 21 (±9) heures, et les concentrations plasmatiques de bupropion à l 'état d' équilibre sont atteintes dans les 8 jours.
Dans une étude comparant des doses de 14 jours avec du chlorhydrate de bupropion à libération prolongée comprimés (XL) 300 mg une fois par jour à la formulation à libération immédiate de bupropion à 100 mg 3 fois par jour, une équivalence a été démontrée pour la concentration plasmatique maximale et zone sous la courbe pour le bupropion et les 3 métabolites (hydroxybupropion, thréohydrobupropion et érythrohydrobupropion). En outre, dans une étude comparant l' Administration de 14 jours avec du chlorhydrate de bupropion comprimés à libération prolongée (XL) 300 mg une fois par jour à la formulation à libération prolongée de bupropion à 150 mg 2 l'équivalence a été démontrée pour la concentration plasmatique maximale et zone sous la courbe pour le bupropion et les 3 métabolites
Absorption
Après administration orale de BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée) à des volontaires sains, le temps nécessaire pour atteindre les concentrations plasmatiques maximales du bupropion était d'environ 5 heures et la nourriture n'a pas affecté la Cmax ou L'ASC du bupropion.
Distribution
In vitro les tests montrent que le bupropion est lié à 84% aux protéines plasmatiques humaines à des concentrations allant jusqu'à 200 mcg/mL. L'étendue de la liaison protéique de l'hydroxybupropion le métabolite est similaire à celui du bupropion, alors que l'étendue de la liaison aux protéines du métabolite de thréohydrobupropion est environ la moitié que vu avec le bupropion.
Métabolisme
Le Bupropion est largement métabolisé. Trois métabolites ont été montré pour être actif: hydroxybupropion, qui est formé par hydroxylation de la tert- groupe butyle du bupropion, et les isomères de l'alcool aminé thréohydrobupropion et l'érythrohydrobupropion, qui sont formés par réduction du groupe carbonyle. In vitro les résultats suggèrent que le cytochrome P450IIB6 (CYP2B6) est le principal isoenzyme impliquée dans la formation de l'hydroxybupropion, tandis que le cytochrome P450 les isoenzymes ne sont pas impliquées dans la formation du thréohydrobupropion. Oxydation de la chaîne latérale du bupropion entraîne la formation d'un conjugué glycine de l'acide méta-chlorobenzoïque, qui est ensuite excrété comme métabolite urinaire majeur. La puissance et la toxicité des métabolites par rapport au bupropion n'ont pas été entièrement caractérisé. Cependant, il a été démontré dans un antidépresseur test de dépistage chez la souris que l'hydroxybupropion est moitié moins puissant que le bupropion, alors que le thréohydrobupropion et l'érythrohydrobupropion sont 5 fois moins puissants que bupropion. Cela peut être d'une importance clinique, car les concentrations plasmatiques les métabolites sont aussi élevés ou plus élevés que ceux de bupropion
Parce que le bupropion est largement métabolisé, il existe un potentiel de médicament-médicament interactions, en particulier avec les agents métabolisés par le cytochrome Isoenzyme P450IIB6 (CYP2B6). Bien que le bupropion ne soit pas métabolisé par le cytochrome P450IID6 (CYP2D6), il existe un potentiel d'interactions médicament-médicament lorsque le bupropion est coadministré avec des médicaments métabolisés par cette isoenzyme (voir PRÉCAUTION: INTERACTIONS MÉDICAMENTEUSES).
Chez l'homme, les concentrations plasmatiques maximales d'hydroxybupropion se produisent approximativement 7 heures après l'administration de BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée). Administration suivante de BUDEPRION XL™ (comprimés de chlorhydrate de bupropion à libération prolongée), les concentrations plasmatiques maximales d'hydroxybupropion sont d'environ 7 fois le niveau maximal du médicament parent à l'état d'équilibre. La demi-vie d'élimination de l'hydroxybupropion est approximativement 20 (±5) heures, et son ASC à régulier l'état est environ 13 fois celui du bupropion. Les temps à des concentrations maximales pour les métabolites érythrohydrobupropion et thréohydrobupropion sont similaires à celle du métabolite d'hydroxybupropion. Cependant, leur demi-vie d'élimination sont plus longues, environ 33 (±10) et 37 (±13) heures, respectivement, et les ASC à l'état d'équilibre sont de 1.4 et 7 fois celle du bupropion, respectivement
Le Bupropion et ses métabolites présentent une cinétique linéaire après administration chronique de 300 à 450 mg/jour.
Élimination
Après administration orale de 200 mg de 14C-bupropion chez l'homme, 87% et 10% de la dose radioactive ont été récupérés dans l'urine et les fèces, respectivement. Cependant, la fraction de la dose orale de bupropion excrétée inchangée était seulement 0,5%, une conclusion compatible avec le métabolisme étendu du bupropion.


