












































Composición:
Solicitud:
Usado en tratamiento:
Revisión médica por Militian Inessa Mesropovna Última actualización de farmacia el 26.06.2023

¡Atención! ¡La información en la página es solo para profesionales médicos! ¡La información se recopila en Fuentes abiertas y puede contener errores significativos! ¡Tenga cuidado y vuelva a verificar toda la información de esta página!
Los 20 mejores medicamentos con los mismos ingredientes:


Formas de dosificación y fortalezas
Cápsulas
- 2 mg: cuerpo opaco azul claro con una tapa opaca azul claro con "2 MG" impreso en la tapa
- 4 mg: cuerpo opaco blanco con una tapa opaca azul con “4 MG "impreso en la tapa
- 6 mg: cuerpo opaco azul con una franja blanca y azul tapa opaca con "6 MG" impreso en la tapa
Tabletas
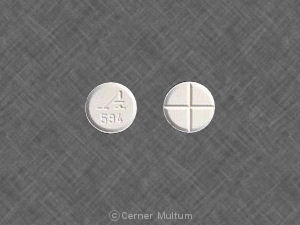
- 4 mg comprimidos blancos sin recubrimiento con una puntuación cuatricificante en un lado y grabado con "A594" en el otro lado
Almacenamiento y manejo
Zanaflex Capsules®
Cápsulas de Zanaflex® (clorhidrato de tizanidina) cápsulas están disponibles en tres puntos fuertes como cápsulas de gelatina dura de dos piezas que contienen clorhidrato de tizanidina 2.29 mg, 4.58 mg y 6.87 mg, equivalente a 2 mg, 4 mg y 6 mg de base de tizanidina.
- Las cápsulas de 2 mg tienen un cuerpo opaco azul claro con a tapa opaca azul claro con "2 MG" impreso en la tapa: frascos de 150 cápsulas (NDC 10144-602-15)
- Las cápsulas de 4 mg tienen un cuerpo opaco blanco con un opaco azul tapa con "4 MG" impreso en la tapa: frascos de 150 cápsulas (NDC 10144-604-15)
- Las cápsulas de 6 mg tienen un cuerpo azul opaco con un blanco franja y tapa opaca azul con "6 MG" impreso en las cápsulas: botellas de 150 cápsulas (NDC -10144-606-15)
Almacenar a 25 ° C (77 ° F); excursiones permitidas a 15–30 ° C (59–86 ° F). Dispensar en contenedores con cierre a prueba de niños.
Tabletas Zanaflex®
Zanaflex® (clorhidrato de tizanidina) son tabletas disponible en tabletas blancas sin recubrimiento de 4 mg que contienen clorhidrato de tizanidina 4,58 mg, equivalente a 4 mg de tizanidina base. Las tabletas tienen una cuadricificación anotar en un lado y están grabados con "A594" en el otro lado. Las tabletas son proporcionado de la siguiente manera: frascos de 150 tabletas (NDC -10144-594-15).
Almacenar a 25 ° C (77 ° F); excursiones permitidas a 15–30 ° C (59–86 ° F).
Dispensar en recipientes con cierre a prueba de niños.
Comercializado y distribuido por: Acorda Therapeutics Inc.Ardsley NY 10502. Revisado: noviembre de 2013.

Zanaflex is a central alpha-2-adrenergic agonist indicated for the management of spasticity. Because of the short duration of therapeutic effect, treatment with Zanaflex should be reserved for those daily activities and times when relief of spasticity is most important.

Información de dosificación
Se pueden recetar tabletas Zanaflex Capsules® o Zanaflex® con o sin comida. Una vez que se ha seleccionado la formulación y la decisión para tomar con o sin alimentos se ha hecho, este régimen no debe modificarse.
Los alimentos tienen efectos complejos sobre la farmacocinética de tizanidina que difieren con las diferentes formulaciones. Cápsulas Zanaflex y Zanaflex las tabletas son bioequivalentes entre sí en condiciones de ayuno (más de 3 horas después de una comida), pero no en condiciones de alimentación (dentro de los 30 minutos de a comida). Estas diferencias farmacocinéticas pueden dar lugar a un efecto clínicamente significativo diferencias al cambiar la administración de tabletas y cápsulas y cuándo cambiar la administración entre el estado alimentado o en ayunas. Estos cambios pueden dar como resultado un aumento de los eventos adversos, o un inicio de actividad retrasado o más rápido dependiendo de la naturaleza del interruptor. Por esta razón, el prescriptor debería Estar completamente familiarizado con los cambios en la cinética asociados con estos diferentes condiciones.
La dosis inicial recomendada es de 2 mg. Porque el efecto de los picos de Zanaflex a aproximadamente 1 a 2 horas después de la dosis y se disipa entre 3 y 6 horas después de la dosis, el tratamiento puede repetirse a las 6 a 8 horas intervalos, según sea necesario, hasta un máximo de tres dosis en 24 horas.
La dosis se puede aumentar gradualmente de 2 mg a 4 mg en cada una dosis, con 1 a 4 días entre aumentos de dosis, hasta una reducción satisfactoria del tono muscular se logra. La dosis diaria total no debe exceder los 36 mg. No se han estudiado dosis únicas superiores a 16 mg.
Dosificación en pacientes con insuficiencia renal
Zanaflex debe usarse con precaución en pacientes con insuficiencia renal (aclaramiento de creatinina <25 ml / min), según el aclaramiento reducido en más del 50%. En estos pacientes, durante la titulación, el individuo las dosis deben reducirse. Si se requieren dosis más altas, dosis individuales más bien que la frecuencia de dosificación debe aumentarse.
Dosificación en pacientes con insuficiencia hepática
Zanaflex debe usarse con precaución en pacientes con alguno insuficiencia hepática. En estos pacientes, durante la titulación, las dosis individuales debe ser reducido. Si se requieren dosis más altas, dosis individuales en lugar de la frecuencia de dosificación debe aumentarse. El monitoreo de los niveles de aminotransferasa es recomendado para el valor inicial y 1 mes después de alcanzar la dosis máxima, o si Se sospecha lesión hepática.
Discontinuación de drogas
Si la terapia necesita ser descontinuada, particularmente en pacientes que han estado recibiendo dosis altas (20 mg a 36 mg diarios) durante mucho tiempo períodos (9 semanas o más) o con quién puede estar en tratamiento concomitante narcóticos, la dosis debe reducirse lentamente (2 mg a 4 mg por día) a minimizar el riesgo de abstinencia e hipertensión de rebote, taquicardia y hipertonía.

Zanaflex está contraindicado en pacientes que se vuelven potentes inhibidores de CYP1A2, como fluvoxamina o ciprofloxacina.

ADVERTENCIAS
Incluido como parte de la PRECAUCIONES sección.
PRECAUCIONES
Hipotensión
La tizanidina es un agonista adrenérgico α2 que puede producir hipotensión. El síncope se ha informado en el entorno posterior a la comercialización. La posibilidad de hipotensión significativa posiblemente se puede minimizar mediante la valoración de la dosis y centrando la atención en los signos y síntomas de hipotensión previa al avance de la dosis. Además, los pacientes pasan de un supino a un fijo la posición vertical puede tener un mayor riesgo de hipotensión y ortostática efectos.
Monitoree la hipotensión cuando Zanaflex se usa en pacientes recibir terapia antihipertensiva concurrente. No se recomienda eso Zanaflex se utilizará con otros agonistas adrenérgicos α2. Clínicamente hipotensión significativa (disminución de la presión sistólica y diastólica) tiene se ha informado con administración concomitante de fluvoxamina o ciprofloxacina y dosis únicas de 4 mg de Zanaflex. Por lo tanto, uso concomitante de Zanaflex con fluvoxamina o con ciprofloxacina, inhibidores potentes de CYP1A2 está contraindicado.
Riesgo de lesiones hepáticas
Zanaflex puede causar daño hepático hepatocelular. Zanaflex debe usarse con precaución en pacientes con insuficiencia hepática.. Se recomienda monitorear los niveles de aminotransferasa para el valor inicial y 1 mes después de alcanzar la dosis máxima, o si se sospecha una lesión hepática.
Sedación
Zanaflex puede causar sedación, lo que puede interferir actividad cotidiana. En los estudios de dosis múltiples, la prevalencia de pacientes con sedación alcanzó su punto máximo después de la primera semana de titulación y luego permaneció estable durante la fase de mantenimiento del estudio. El CNS efectos depresores de Zanaflex con alcohol y otros depresores del SNC (p. ej., las benzodiacepinas, los opioides, los antidepresivos tricíclicos) pueden ser aditivos. Monitor pacientes que toman Zanaflex con otro depresor del SNC para detectar síntomas de exceso sedación.
Alucinosis / Síntomas psicóticos
El uso de Zanaflex se ha asociado con alucinaciones. Formadas, se han reportado alucinaciones visuales o delirios en 5 de 170 pacientes (3%) en dos estudios clínicos controlados en América del Norte. La mayor parte de la los pacientes sabían que los eventos eran irreales. Un paciente desarrollado psicosis en asociación con las alucinaciones. Un paciente entre estos 5 continuó teniendo problemas durante al menos 2 semanas después de la interrupción de tizanidina. Considere suspender Zanaflex en pacientes que desarrollan alucinaciones.
Interacción con inhibidores de CYP1A2
Debido a posibles interacciones farmacológicas, Zanaflex es contraindicado en pacientes que toman inhibidores potentes de CYP1A2, como fluvoxamina o ciprofloxacina. Reacciones adversas como hipotensión bradicardia o somnolencia excesiva puede ocurrir cuando se toma Zanaflex otros inhibidores de CYP1A2, como el zileuton, fluoroquinolonas que no sean ciprofloxacina (que está contraindicada), antiarritmias (amiodarona, mexiletina, propafenona), cimetidina, famotidina, anticonceptivos orales aciclovir y ticlopidina). Se debe evitar el uso concomitante a menos que el La necesidad de la terapia con Zanaflex es clínicamente evidente. En tal caso, usar con precaución.
Reacciones de hipersensibilidad
Zanaflex puede causar anafilaxia. Signos y síntomas incluyendo compromiso respiratorio, urticaria y angioedema de garganta y Se ha informado de lengua. Se debe informar a los pacientes sobre los signos y síntomas de reacciones alérgicas graves e instruidos para suspender Zanaflex y busque atención médica inmediata si se presentan estos signos y síntomas.
Mayor riesgo de reacciones adversas en pacientes con Deterioro renal
Zanaflex debe usarse con precaución en pacientes con insuficiencia renal (aclaramiento de creatinina <25 ml / min), según el aclaramiento reducido en más del 50%. En estos pacientes, durante la titulación, el individuo las dosis deben reducirse. Si se requieren dosis más altas, dosis individuales más bien que la frecuencia de dosificación debe aumentarse. Estos pacientes deben ser monitoreados estrechamente para el inicio o aumento de la gravedad de los eventos adversos comunes (seco boca, somnolencia, astenia y mareos) como indicadores de sobredosis potencial.
Retirada de reacciones adversas
Las reacciones adversas a la retirada incluyen rebote hipertensión, taquicardia e hipertonía. Para minimizar el riesgo de estos reacciones, particularmente en pacientes que han estado recibiendo dosis altas (20 a 28 mg diarios) durante largos períodos de tiempo (9 semanas o más) o quién puede estar encendido tratamiento concomitante con narcóticos, la dosis debe reducirse lentamente (2 a 4 mg por día).
Toxicología no clínica
Carcinogénesis, mutagénesis deterioro de la fertilidad
Carcinogénesis
Se administró tizanidina a ratones durante 78 semanas a dosis orales de hasta 16 mg / kg / día, que es 2 veces mayor dosis humana máxima recomendada (MRHD) en mg / m². La tizanidina fue administrado a ratas durante 104 semanas a dosis orales de hasta 9 mg / kg / día, que es 2.5 veces el MRHD en mg / m². No hubo aumento en los tumores en ninguno de los dos especie.
Mutagénesis
La tizanidina fue negativa in vitro (mutación inversa bacteriana [Ames], mutación genética de mamíferos y cromosómica prueba de aberración en células de mamíferos) e in vivo (micronúcleos de médula ósea, y ensayo de citogenética).
Deterioro de la fertilidad
Administración oral de La tizanidina resultó en una reducción de la fertilidad en ratas macho y hembra dosis de 30 y 10 mg / kg / día, respectivamente. No se observó ningún efecto sobre la fertilidad a dosis de 10 (hombres) y 3 (hembras) mg / kg / día, que son aproximadamente 8 y 3 veces, respectivamente, el MRHD en mg / m²).
Uso en poblaciones específicas
Embarazo
Embarazo Categoría C
Zanaflex no se ha estudiado en mujeres embarazadas. Zanaflex debe administrarse a mujeres embarazadas solo si el beneficio supera el riesgo para el feto no nacido. Estudios de reproducción realizados en ratas a una dosis de 3 mg / kg igual a la dosis humana máxima recomendada en mg / m² y en conejos a 30 mg / kg, 16 veces la dosis humana máxima recomendada en mg / m², no lo hizo mostrar evidencia de teratogenicidad. Tizanidina a dosis iguales y superiores a 8 veces la dosis humana máxima recomendada en mg / m² aumentó duración de la gestación en ratas. La pérdida prenatal y postnatal de cachorros aumentó y se produjo un retraso en el desarrollo. La pérdida posterior a la implantación aumentó en conejos a dosis de 1 mg / kg o más, iguales o superiores a 0,5 veces el dosis humana máxima recomendada en mg / m².
Madres lactantes
No se sabe si esta droga se excreta en humanos leche. Debido a que muchas drogas se excretan en la leche humana, se debe tener precaución ejercido cuando Zanaflex se administra a una mujer lactante.
Uso pediátrico
La seguridad y la eficacia en pacientes pediátricos no lo han hecho sido establecido.
Uso geriátrico
Se sabe que Zanaflex está sustancialmente excretado por el riñón, y el riesgo de reacciones adversas a este medicamento puede ser mayor en pacientes con insuficiencia renal. Porque los pacientes de edad avanzada son más probables para tener una función renal disminuida, se debe tener cuidado en la selección de dosis, y Puede ser útil controlar la función renal. Los estudios clínicos de Zanaflex sí no incluye un número suficiente de sujetos de 65 años o más para determinar si responden de manera diferente a las asignaturas más jóvenes. Comparación de estudios cruzados de datos farmacocinéticos después de la administración de una dosis única de 6 mg de Zanaflex demostró que los sujetos más jóvenes eliminaron la droga cuatro veces más rápido que el sujetos de edad avanzada. En pacientes de edad avanzada con insuficiencia renal (creatinina aclaramiento <25 ml / min), el aclaramiento de tizanidina se reduce en más del 50% en comparación con sujetos ancianos sanos; se esperaría que esto conduzca a a a mayor duración del efecto clínico. Durante la valoración, las dosis individuales debe ser reducido. Si se requieren dosis más altas, dosis individuales en lugar de la frecuencia de dosificación debe aumentarse. Monitoree a los pacientes de edad avanzada porque pueden hacerlo tener un mayor riesgo de reacciones adversas asociadas con Zanaflex.
Función renal deteriorada
Se sabe que Zanaflex está sustancialmente excretado por el riñón, y el riesgo de reacciones adversas a este medicamento puede ser mayor en pacientes con insuficiencia renal. En pacientes con insuficiencia renal (el aclaramiento de creatinina <25 ml / min) se redujo en más del 50%. En estos pacientes, durante la titulación, las dosis individuales deben reducirse. Si se requieren dosis más altas, las dosis individuales en lugar de la frecuencia de dosificación deberían hacerlo ser aumentado. Estos pacientes deben ser monitoreados de cerca para el inicio o aumento en la gravedad de los eventos adversos comunes (boca seca, somnolencia) astenia y mareos) como indicadores de sobredosis potencial.
Insuficiencia hepática
La influencia de la insuficiencia hepática en el No se ha evaluado la farmacocinética de tizanidina. Porque la tizanidina es metabolizado ampliamente en el hígado, se esperaría insuficiencia hepática tener efectos significativos sobre la farmacocinética de tizanidina..

Inhibidores de CYP1A2
La interacción entre Zanaflex y es muy probable que la fluvoxamina o la ciprofloxacina se deban a la inhibición de CYP1A2 por fluvoxamina o ciprofloxacina. El efecto de la fluvoxamina en el Se estudió la farmacocinética de una dosis única de 4 mg de Zanaflex en 10 sanos asignaturas. La Cmáx, el AUC y la vida media de la tizanidina aumentaron 12 veces 33 veces y 3 veces, respectivamente. El efecto de la ciprofloxacina en el Se estudió la farmacocinética de una dosis única de 4 mg de Zanaflex en 10 sanos asignaturas. La Cmáx y el AUC de la tizanidina aumentaron en 7 veces y 10 veces respectivamente.
Aunque no ha habido estudios clínicos que evalúan los efectos de otros inhibidores de CYP1A2 en tizanidina, otros inhibidores de CYP1A2, como el zileuton, otras fluoroquinolonas antiarritmias (amiodarona, mexiletina, propafenona y verapamilo), cimetidina, los anticonceptivos orales de famotidina, el aciclovir y la ticlopidina, también pueden conducir a aumentos sustanciales en las concentraciones sanguíneas de tizanidina.
Estudios in vitro de citocromo Las isoenzimas P450 que usan microsomas hepáticos humanos indican que ni la tizanidina ni los metabolitos principales pueden afectar el metabolismo de otras drogas metabolizado por isoenzimas del citocromo P450.
Anticonceptivos orales
No hay estudio farmacocinético específico se realizó para investigar la interacción entre anticonceptivos orales y Zanaflex. Análisis retrospectivo de los siguientes datos farmacocinéticos de la población Sin embargo, la administración de dosis única y múltiple de 4 mg de Zanaflex lo demostró Al mismo tiempo, las mujeres que tomaban anticonceptivos orales tenían un aclaramiento 50% menor tizanidina en comparación con las mujeres que no toman anticonceptivos orales.
Acetaminofén
La tizanidina retrasó el Tmax de acetaminofén por 16 minutos. El acetaminofeno no afectó la farmacocinética de tizanidina.
Alcohol
El alcohol aumentó el AUC de tizanidina en aproximadamente un 20%, al tiempo que aumenta su Cmax en aproximadamente el 15%. Esto se asoció con un aumento en los efectos secundarios de tizanidina. Los efectos depresores del SNC de la tizanidina y el alcohol son aditivos.

Embarazo Categoría C
Zanaflex no se ha estudiado en mujeres embarazadas. Zanaflex debe administrarse a mujeres embarazadas solo si el beneficio supera el riesgo para el feto no nacido. Estudios de reproducción realizados en ratas a una dosis de 3 mg / kg igual a la dosis humana máxima recomendada en mg / m² y en conejos a 30 mg / kg, 16 veces la dosis humana máxima recomendada en mg / m², no lo hizo mostrar evidencia de teratogenicidad. Tizanidina a dosis iguales y superiores a 8 veces la dosis humana máxima recomendada en mg / m² aumentó duración de la gestación en ratas. La pérdida prenatal y postnatal de cachorros aumentó y se produjo un retraso en el desarrollo. La pérdida posterior a la implantación aumentó en conejos a dosis de 1 mg / kg o más, iguales o superiores a 0,5 veces el dosis humana máxima recomendada en mg / m².

Las siguientes reacciones adversas se describen en otra parte en otras secciones de la información de prescripción:
- Hipotensión
- Lesiones hepáticas
- Sedación
- Alucinosis / Síntomas psicóticos
- Reacciones de hipersensibilidad
Experiencia en ensayos clínicos
Porque los estudios clínicos se realizan ampliamente condiciones variables, tasas de reacción adversas observadas en los estudios clínicos de un medicamento no se puede comparar directamente con las tasas en los estudios clínicos de otro fármaco y puede no reflejar las tasas observadas en la práctica clínica.
Tres doble ciego, aleatorizado, controlado con placebo -se realizaron estudios clínicos para evaluar el efecto de la tizanidina en control de espasticidad. Se realizaron dos estudios en pacientes con múltiples esclerosis y uno en pacientes con lesión de la médula espinal. Cada estudio tuvo 13 semanas período de tratamiento activo que incluyó una fase de titulación de 3 semanas al máximo dosis toleradas hasta 36 mg / día en tres dosis divididas, una fase de meseta de 9 semanas donde la dosis de tizanidina se mantuvo constante y una disminución de la dosis de 1 semana. En todos, 264 pacientes recibieron tizanidina y 261 pacientes recibieron placebo. Al otro lado las tres edades de los pacientes de los estudios oscilaron entre 15 y 69 años y el 51,4 por ciento lo fueron mujer. La dosis media durante la fase de meseta varió de 20 a 28 mg / día.
Las reacciones adversas más frecuentes informadas en múltiples dosis, estudios clínicos controlados con placebo con 264 pacientes la espasticidad era boca seca, somnolencia / sedación, astenia (debilidad, fatiga y / o cansancio) y mareos. Tres cuartos de los pacientes calificaron el eventos como leves a moderados y una cuarta parte de los pacientes calificaron los eventos como siendo severo. Estos eventos parecían estar relacionados con la dosis.
La Tabla 1 enumera los signos y síntomas que se informaron en mayor del 2% de los pacientes en tres estudios de dosis múltiples controlados con placebo quien recibió Zanaflex donde la frecuencia en el grupo Zanaflex fue mayor que el grupo placebo. Para fines de comparación, la frecuencia correspondiente de También se proporciona el evento (por 100 pacientes) entre los pacientes tratados con placebo.
Tabla 1: Dosis múltiple, estudios controlados por placebo: frecuentes
(> 2%) Reacciones adversas informadas para las cuales es la incidencia de tabletas Zanaflex
Mayor que Placebo
| Evento | Placebo N = 261 % |
Tableta Zanaflex N = 264 % |
| Boca seca | 10 | 49 |
| Somnolencia | 10 | 48 |
| Astenia * | 16 | 41 |
| Mareo | 4 | 16 |
| UTI | 7 | 10 |
| Infección | 5 | 6 |
| Estreñimiento | 1 | 4 |
| Anomalía en la prueba de hígado | 2 | 6 |
| Vómitos | 0 | 3 |
| Trastorno del habla | 0 | 3 |
| Ambliopía (visión borrosa) | <1 | 3 |
| Frecuencia urinaria | 2 | 3 |
| Síndrome de gripe | 2 | 3 |
| Discinesia | 0 | 3 |
| Nerviosismo | <1 | 3 |
| Faringitis | 1 | 3 |
| Rinitis | 2 | 3 |
| * (debilidad, fatiga y / o cansancio) |
En la dosis única, estudio controlado con placebo que involucra 142 pacientes con espasticidad debido a la esclerosis múltiple (Estudio 1), se les preguntó específicamente a los pacientes si habían experimentado alguno de las cuatro reacciones adversas más comunes: boca seca, somnolencia ( somnolencia) astenia (debilidad, fatiga y / o cansancio) y mareos. Además, se observaron hipotensión y bradicardia. La aparición de estas reacciones es resumido en la Tabla 2. Otros eventos fueron, en general, reportados a una tasa del 2% o menos.
Tabla 2: Dosis única, estudio controlado con placebo: común
Reacciones adversas informadas
| Evento | Placebo N = 48 % |
Tableta Zanaflex, 8mg N = 45 % |
Tableta Zanaflex,
16 mg, N = 49 % |
| Somnolencia | 31 | 78 | 92 |
| Boca seca | 35 | 76 | 88 |
| Astenia * | 40 | 67 | 78 |
| Mareo | 4 | 22 | 45 |
| Hipotensión | 0 | 16 | 33 |
| Bradicardia | 0 | 2 | 10 |
| * (debilidad, fatiga y / o cansancio) |
Experiencia posterior a la comercialización
Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de Zanaflex. Porque estas reacciones son reportadas voluntariamente de una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con el fármaco exposición.
Ciertos eventos, como somnolencia, boca seca hipotensión, disminución de la presión arterial, bradicardia, mareos, debilidad o astenia, espasmos musculares, alucinaciones, fatiga, prueba de función hepática Se han observado anormalidades y hepatotoxicidad en el postcomercialización y clínica ensayos y se discuten en secciones anteriores de este documento.
Se han identificado las siguientes reacciones adversas como ocurriendo en la experiencia post marketing de Zanaflex. Basado en el información proporcionada sobre estas reacciones, una relación causal con Zanaflex no puede ser completamente excluido. Los eventos se enumeran en orden de disminución de la importancia clínica; la gravedad en el entorno posterior a la comercialización no lo es reportado.
- Síndrome de Stevens Johnson
- Reacción anafiláctica
- Dermatitis exfoliativa
- Taquicardia ventricular
- Hepatitis
- Convulsión
- Depresión
- Artralgia
- Parestesia
- Sarpullido
- Temblor

Una revisión de la base de datos de vigilancia de seguridad revelada casos de sobredosis intencional y accidental de Zanaflex. Algunos de los casos resultó en fatalidad y muchas de las sobredosis intencionales fueron con múltiples medicamentos, incluidos los depresores del SNC. Las manifestaciones clínicas de la tizanidina la sobredosis fue consistente con su farmacología conocida. En la mayoría de los casos Se observó una disminución en el sensorium, incluyendo letargo, somnolencia, confusión y coma. También se observa función cardíaca deprimida, incluso con mayor frecuencia bradicardia e hipotensión. La depresión respiratoria es otra característica común de sobredosis de tizanidina.
Si se produce una sobredosis, pasos básicos para garantizar la adecuación de una vía aérea y el monitoreo de sistemas cardiovasculares y respiratorios debe ser emprendido. La tizanidina es un fármaco soluble en lípidos, que es único ligeramente soluble en agua y metanol. Por lo tanto, no es probable que la diálisis lo sea Un método eficiente para eliminar drogas del cuerpo. En general, síntomas resolver dentro de uno o tres días después de la interrupción de tizanidina y administración de terapia apropiada. Debido al mecanismo de acción similar, Los síntomas y el tratamiento de la sobredosis de tizanidina son similares a los siguientes sobredosis de clonidina. Para la información más reciente sobre la gestión de sobredosis, comuníquese con un centro de control de intoxicaciones.

Absorción y distribución
Después de la administración oral, la tizanidina es esencialmente completamente absorbido. La biodisponibilidad oral absoluta de tizanidina es aproximadamente 40% (CV = 24%), debido a un extenso metabolismo hepático de primer paso. La tizanidina se distribuye ampliamente por todo el cuerpo con una media constante volumen de distribución estatal de 2.4 L / kg (CV = 21%) después de la intravenosa administración en voluntarios adultos sanos. La tizanidina es aproximadamente del 30% unido a proteínas plasmáticas.
Diferencias entre Zanaflex Capsules® y Zanaflex® Tabletas
Las tabletas Zanaflex Capsules® y Zanaflex® son bioequivalente entre sí en condiciones de ayuno, pero no bajo alimentación condiciones. Se administró una dosis única de dos tabletas de 4 mg o dos cápsulas de 4 mg administrado en condiciones de alimentación y ayuno en una etiqueta abierta, cuatro períodos, estudio cruzado aleatorio en 96 voluntarios humanos, de los cuales 81 eran elegibles El análisis estadístico. Después de la administración oral de la tableta o cápsula (en ayunas), se produjeron concentraciones plasmáticas máximas de tizanidina 1.0 horas después de la dosificación con una vida media de aproximadamente 2 horas. Cuando dos 4 mg las tabletas se administraron con alimentos, la concentración plasmática máxima media fue aumentó en aproximadamente un 30%, y la mediana del tiempo hasta el pico del plasma la concentración aumentó en 25 minutos, a 1 hora y 25 minutos. En contraste, cuando se administraron dos cápsulas de 4 mg con alimentos, la media máxima la concentración plasmática disminuyó en un 20%, la mediana del tiempo hasta el pico del plasma la concentración aumentó de 2 a 3 horas. En consecuencia, la Cmax media para el cápsula cuando se administra con alimentos es aproximadamente el 66% de la Cmáx para el tableta cuando se administra con alimentos.
Los alimentos también aumentaron el grado de absorción para ambos tabletas y cápsulas. El aumento con la tableta (~ 30%) fue significativo mayor que con la cápsula (~ 10%). En consecuencia, cuando cada uno fue administrado con alimentos, la cantidad absorbida de la cápsula fue aproximadamente el 80% de la cantidad absorbido por la tableta. Administración del contenido de la cápsula rociado puré de manzana no era bioequivalente a la administración de una cápsula intacta debajo condiciones de ayuno. Administración del contenido de la cápsula en puré de manzana resultó en un aumento del 15% al 20% en la Cmáx y el AUC de tizanidina y 15 minutos disminución en el tiempo medio de retraso y el tiempo hasta la concentración máxima en comparación con administración de una cápsula intacta mientras ayuna.
Figura 1: Concentración media de tizanidina vs. Hora
Perfiles para tabletas y cápsulas de Zanaflex (2 Ã - 4 mg) en ayunas y alimentados
Condiciones
Metabolismo y excreción
La tizanidina tiene lineal farmacocinética sobre las dosis estudiadas en el desarrollo clínico (1–20 mg). La tizanidina tiene una vida media de aproximadamente 2.5 horas (CV = 33%). Aproximadamente El 95% de una dosis administrada se metaboliza. El citocromo primario P450 La isoenzima involucrada en el metabolismo de la tizanidina es CYP1A2. Metabolitos de tizanidina no se sabe que estén activos; sus vidas medias varían de 20 a 40 horas.
Siguiendo solo y múltiple dosificación oral de 14C-tizanidina, un promedio de 60% y 20% de la radiactividad total fue recuperado en la orina y las heces, respectivamente.



