















































































































































コンポーネント:
治療オプション:
Militian Inessa Mesropovna 、薬局による医学的評価、 最終更新日:26.06.2023

アテンション! そのこのページの情報は医療専門家のみを対象としています! その情報が収集したオープン源を含めることが可能である重大な誤差! 注意して、このページ上のすべての情報を再確認してください!
タブレット。
次のようにフィルムコーティングされた修飾卵錠:。
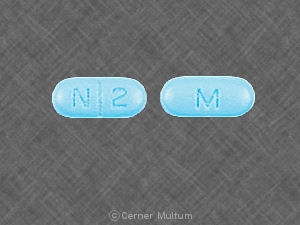
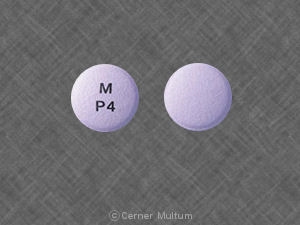
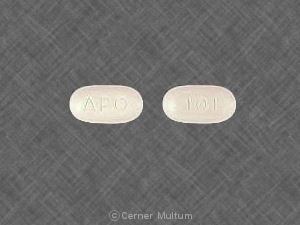
10 mg。 碑文POT 10が1つになっている白い錠剤。 側。. NDC。 54766-201-01 30個入りボトル。
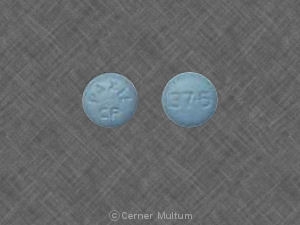
20 mg。 碑文POT 20がオンの濃いオレンジ色の錠剤。 片側。. タブレットは両側でスコアリングされます。. NDC。 54766-202-01 30個入りボトル。
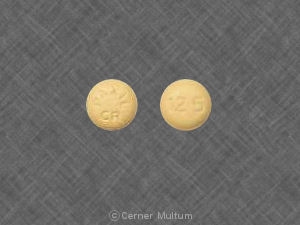
30 mg。 黄色の錠剤で、POT 30が1つになっています。 側。. NDC。 54766-203-01 30個入りボトル。
40 mg。 片側にPOT 40の碑文が書かれたバラの錠剤。. NDC。 54766-204-01 30個入りボトル。
湿度から保護します。. 25°C(77°F)で保管してください。 15°-30°C(59°および86°F)への遠足が許可されています。 (参照。 USP制御室。 温度。)
Sebela Pharmaceuticals Inc.により配布. 645ヘムブリー。 Parkway、Suite I Roswell、Georgia 30076。. www.sebelapharma.com。. フリーダイヤル。 1-844-732-3521。. 改訂:。 2017年1月。
大うつ病性障害。
PEXEVA®(パロキセチンメシル酸塩)が示されています。 MDDの治療
専攻の治療におけるパロキセチンの有効性。 うつ病エピソードは、外来患者の6週間の対照試験で確立されました。 その診断は、MDDのDSM-IIIカテゴリに最も密接に対応していました(参照。 臨床薬理学。)。. 大うつ病エピソードは、目立つことを意味します。 通常は干渉する比較的持続的なうつ病または不快感。 毎日の機能(ほぼ毎日、少なくとも2週間)。に含める必要があります。 次の8つの症状のうち少なくとも4つ:食欲の変化、睡眠の変化。 精神運動興奮または遅滞、通常の活動への関心の喪失または。 性的欲求の減少、疲労の増加、罪悪感、または。 価値のない、思考の鈍化または集中の障害、そして自殺未遂。 または自殺念慮。.
入院中のパロキセチンの影響は落ち込んでいます。 患者は十分に研究されていません。.
応答を維持する際のパロキセチンの有効性。 MDDが最長1年間、プラセボ対照試験で実証されました(参照。 臨床薬理学。)。. それにもかかわらず、使用することを選択した医師。 PEXEVA®(パロキセチンメシル酸塩)を長期間定期的に行う必要があります。 個々の患者に対する薬物の長期的な有用性を再評価します。.
強迫性障害。
PEXEVA®(パロキセチンメシル酸塩)が示されています。 で定義されているOCD患者の強迫と強迫の治療。 DSM-IV。強迫観念や強迫は著しい苦痛を引き起こします。 時間のかかる、または社会的または職業的障害を著しく妨害する。 機能しています。.
パロキセチンの有効性は2週間で確立されました。 診断が最も対応する強迫性外来患者による試験。 OCDのDSM-IIIRカテゴリに密接(参照。 臨床。 試験。).
OCDは、繰り返し発生する永続的なアイデアによって特徴付けられます。 自我論的および/またはである思考、衝動、または画像(執着)。 反復的で、意図的で、意図的な行動(衝動)です。 人によって過度または不合理として認識されます。.
有効性の長期維持は、 6か月の再発防止試験。. この試験では、患者が割り当てられました。 パロキセチンは、プラセボの患者と比較して再発率が低いことを示しました(参照。 臨床試験。)。. それにもかかわらず、医師。 PEXEVA®(メシル酸パロキセチン)を長期間使用することを選択した人は、 個人の薬物の長期的な有用性を定期的に再評価します。 患者(参照 投与量と投与。).
パニック障害。
PEXEVA®(パロキセチンメシル酸塩)が示されています。 DSM-IVで定義されている、広場恐怖症の有無にかかわらず、PDの治療。 PDです。 予期しないパニック発作の発生と関連付けが特徴です。 追加の攻撃に対する懸念、影響についての心配、または。 攻撃の結果、および/または関連する行動の大幅な変化。 攻撃。.
パロキセチンの有効性は3つの10からで確立されました。 診断がDSM-IIIRに対応するPD患者を対象とした12週間の試験。 PDのカテゴリ(参照。 臨床試験。).
PD(DSM-IV)は、予期しない再発を特徴としています。 パニック発作、すなわち、激しい恐怖または不快感の離散期間4。 以下の症状の(またはそれ以上)が突然発症し、10以内にピークに達します。 分:(1)動 ⁇ 、ドキドキする心臓、または加速した心拍数。 (2)。 発汗; (3)震えたり揺れたりする。 (4)息切れまたは感覚。 窒息; (5)窒息感; (6)胸の痛みまたは不快感; (7)吐き気または。 腹部苦痛; (8)めまい、不安定、立ちくらみ、またはかすかな感じ。 (9)。 脱現実(非現実感)または離人(切り離されている)。 自分); (10)コントロールを失うことへの恐怖; (11)死ぬことへの恐怖; (12)感覚異常。 (しびれやチクチクする感覚); (13)悪寒またはほてり。.
有効性の長期維持は、 3か月の再発防止試験。. この試験では、PDの患者が割り当てられました。 パロキセチンは、プラセボの患者と比較して再発率が低いことを示しました。 (参照。 臨床試験。)。. それにもかかわらず、 PEXEVA®(メシル酸パロキセチン)を長期間処方する医師。 薬物の長期的な有用性を定期的に再評価する必要があります。 個々の患者。.
全般性不安障害。
パロキセチンはGeneralizedの治療に使用されます。 DSM-IVで定義されている不安障害(GAD)。不安または緊張が関連しています。 日常生活のストレスで、通常、による治療は必要ありません。 抗不安薬。.
GADの治療におけるパロキセチンの有効性はそうでした。 GADの成人を対象とした2つの8週間のプラセボ対照試験で確立されました。 パロキセチンは、Generalizedの子供または青年では研究されていません。 不安障害(参照。 臨床試験。).
全般性不安障害(DSM-IV)は、 根強い過度の不安と心配(不安な期待)。 少なくとも6か月、その人が制御するのが難しいと感じるもの。. それはそうでなければなりません。 次の6つの症状のうち少なくとも3つに関連付けられています:落ち着きのなさまたは感情。 鍵をかけたり、端にしたり、簡単に疲労したり、集中したり、気にしたりします。 空白、イライラ、筋肉の緊張、睡眠障害。.
応答を維持する際のパロキセチンの有効性。 8週間の間に反応した全身性不安障害の患者。 パロキセチンを服用している間の急性治療段階、そしてその後観察されました。 最大24週間の期間の再発は、 プラセボ対照試験(参照。 臨床試験。)。. それにもかかわらず、パロキセチンを長期間使用することを選択した医師。 薬物の長期的な有用性を定期的に再評価する必要があります。 個々の患者(参照。 投与量と投与。).
大うつ病性障害。
通常の初期投与量。
PEXEVA®(パロキセチンメシル酸塩)は、 食事の有無にかかわらず、通常は朝に1日1回投与します。. 推奨。 初期用量は20 mg /日です。. 患者は20〜50 mg /日の範囲で投与されました。 におけるパロキセチンの有効性を実証する臨床試験。 MDDの治療。 MDDの治療に有効なすべての薬物と同様に、完全です。 効果が遅れることがあります。. 20 mgの用量に反応しない一部の患者は利益を得るかもしれません。 10 mg /日の増分で、最大50 mg /日まで、用量の増加から。. 用量の変更は、少なくとも1週間の間隔で行う必要があります。.
メンテナンスセラピー。
答えられる証拠はありません。 パロキセチンで治療された患者がどれくらいの期間その上に留まるべきかという質問。. MDDの急性エピソードには数か月または数か月かかると一般的に合意されています。 持続的な薬理療法のより長い。. 線量が誘発する必要があるかどうか。 寛解は、安楽死を維持および/または維持するために必要な用量と同じです。 不明です。.
パロキセチンの有効性の体系的な評価があります。 有効性は、1年までの期間、その用量で維持されることを示した。 平均約30mg。.
強迫性障害。
通常の初期投与量。
PEXEVA®(パロキセチンメシル酸塩)は、 食事の有無にかかわらず、通常は朝に1日1回投与します。. 推奨。 OCDの治療におけるパロキセチンの用量は、毎日40 mgです。. 患者はそうあるべきです。 20 mg /日から開始し、用量を10 mg /日の増分で増やすことができます。. 用量の変更は、少なくとも1週間の間隔で行う必要があります。. 患者に投与した。 を実証する臨床試験では、20〜60 mg /日の範囲です。 OCDの治療におけるパロキセチンの有効性。最大投与量はすべきです。 60 mg /日を超えない。.
メンテナンスセラピー。
有効性の長期維持は、 6か月の再発防止試験。. この試験では、OCDの患者が割り当てられました。 パロキセチンは、プラセボの患者と比較して再発率が低いことを示しました。 (参照。 臨床薬理学。)。. OCDは慢性状態であり、慢性状態です。 応答患者の継続を検討するのが合理的です。. 投与量。 患者を最低の効果に維持するために調整を行う必要があります。 投与量、および患者は定期的に再評価して必要性を判断する必要があります。 継続的な治療のため。.
パニック障害。
通常の初期投与量。
PEXEVA®(パロキセチンメシル酸塩)は、 食事の有無にかかわらず、通常は朝に1日1回投与します。. 目標線量。 PDの治療におけるパロキセチンの投与量は40 mg /日です。. 患者さんを始めましょう。 10 mg /日。. 用量の変更は、10 mg /日の増分で、および 少なくとも1週間の間隔。. 患者は10〜60 mg /日の範囲で投与されました。 パロキセチンの有効性を実証する臨床試験で。. 。 最大投与量は60 mg /日を超えてはなりません。.
メンテナンスセラピー。
有効性の長期維持は、 3か月の再発防止試験。. この試験では、PDの患者が割り当てられました。 パロキセチンは、プラセボの患者と比較して再発率が低いことを示しました。 (参照。 臨床薬理学。)。. PDは慢性状態であり、慢性状態です。 応答患者の継続を検討するのが合理的です。. 投与量。 患者を最低の効果に維持するために調整を行う必要があります。 投与量、および患者は定期的に再評価して必要性を判断する必要があります。 継続的な治療のため。.
全般性不安障害。
通常の初期投与量。
PEXEVA®(パロキセチンメシル酸塩)は、 食事の有無にかかわらず、通常は朝に1日1回投与します。. 臨床で。 試験パロキセチンの有効性は、aを投与された患者で実証されました。 20〜50 mg /日の範囲。. 推奨される開始用量と確立されたもの。 有効量は20 mg /日です。. aを示唆する十分な証拠がありません。 20 mg /日を超える用量へのより大きな利益。. 用量の変更は10回に発生する必要があります。 mg /日の増分、少なくとも1週間の間隔。.
メンテナンスセラピー。
継続中のパロキセチンの系統的評価。 服用中に反応したGAD患者の最長24週間の期間。 8週間の急性治療段階でのパロキセチンは、その利点を示しています。 そのようなメンテナンス(参照。 臨床試験。)。. それにもかかわらず、患者は必要性を判断するために定期的に再評価されるべきです。 メンテナンス治療用。.
特別な人口。
第三学期中の妊娠中の女性の治療。
パロキセチンおよび他のSSRIまたはSNRIに曝露された新生児。 妊娠後期の終わりに、長引く必要のある合併症が発生しました。 入院、呼吸サポート、およびチューブフィード(参照。 注意。)。. 妊娠第三期に妊娠中の女性をパロキセチンで治療する場合、 医師は、潜在的なリスクと利点を慎重に検討する必要があります。 治療。.
高齢者または衰弱した患者、および重度の患者のための投与量。 腎または肝障害。
推奨される初期用量は、高齢者の場合、10 mg /日です。 患者、衰弱した患者、および/または重度の腎または肝臓の患者。 障害。. 必要に応じて増加することがあります。. 投与量は40を超えてはなりません。 mg /日。.
患者をモノアミンオキシダーゼに切り替える。 精神障害を治療することを目的とした阻害剤(MAOI)。
中止の間に少なくとも14日が経過するはずです。 精神障害の治療と治療の開始を目的としたMAOI。 PEXEVA®。. 逆に、PEXEVA®を停止してから少なくとも14日間は許可する必要があります。 精神障害の治療を目的としたMAOIを開始する前に(参照。 禁 ⁇ 。).
LinezolidやMetylenなどの他のMAOIを使用したPEXEVA®の使用。 青い。
治療を受けている患者でPEXEVA®を開始しないでください。 リスクが高いため、リネゾリドまたは静脈内メチレンブルーを使用します。 セロトニン症候群。. より緊急の治療を必要とする患者。 精神状態、入院を含む他の介入は、すべきです。 考慮される(参照。 禁 ⁇ 。).
場合によっては、すでにPEXEVA®を受けている患者。 治療には、リネゾリドまたは静脈内メチレンによる緊急治療が必要な場合があります。 青い。. ラインゾリドまたは静脈内メチレンブルーの許容できる代替物。 治療は利用できず、リネゾリドまたはの潜在的な利点。 静脈内メチレンブルー処理は、リスクを上回ると判断されます。 特定の患者のセロトニン症候群、PEXEVA®は迅速に停止する必要があります。 リネゾリドまたは静脈内メチレンブルーを投与できます。. 患者。 セロトニン症候群の症状は2週間または24日まで監視する必要があります。 リネゾリドまたは静脈内メチレンブルーの最後の投与から数時間後のいずれか。 最初になります。. PEXEVA®による治療は、最後の投与から24時間後に再開することができます。 ラインゾリドまたは静脈内メチレンブルー(参照。 警告。).
メチレンブルーを投与するリスク。 非静脈内経路(経口錠剤や局所注射など)または内。 PEXEVA®で1 mg / kgをはるかに下回る静脈内投与量は不明です。. 。 それにもかかわらず、臨床医は緊急の可能性を認識している必要があります。 そのような使用によるセロトニン症候群の症状(参照。 警告。).
PEXEVA®(パロキセチン)による治療の中止。 メシル酸塩)。
パロキセチンの中止に関連する症状。 報告されている(参照 注意。)。. 患者は監視されるべきです。 適応症に関係なく、治療を中止するときのこれらの症状。 どのパロキセチンが処方されているか。. むしろ用量の段階的な減少。 可能な限り突然の中止よりも推奨されます。. 耐えられない症状の場合。 用量の減少後または治療の中止後に発生します。 次に、以前に処方された用量を再開することを検討することができます。. その後、。 医師は用量を減らし続けるかもしれませんが、より緩やかな速度で。.
精神障害の治療を目的としたMAOIの使用。 PEXEVA®を使用するか、PEXEVA®による中止治療から14日以内です。 セロトニン症候群のリスクが高いため禁 ⁇ 。. の使用。 精神科の治療を目的としたMAOIを停止してから14日以内にPEXEVA®。 障害も禁 ⁇ です(参照。 警告。 と。 投与量と。 管理。).
治療を受けている患者でPEXEVA®を開始します。 リネゾリドや静脈内メチレンブルーなどのMAOIも禁 ⁇ です。 セロトニン症候群のリスクの増加のため(参照。 警告。 と。 投薬。 そして管理。).
チオリダジンを服用している患者での併用はそうです。 禁 ⁇ (参照 警告。 と。 注意。).
ピモジドを服用している患者での併用は。 禁 ⁇ (参照 注意。).
PEXEVA®(メシル酸パロキセチン)錠剤は禁 ⁇ です。 パロキセチンまたは非活性剤のいずれかに対する過敏症の患者。 PEXEVA®(メシル酸パロキセチン)錠剤の成分。.
警告。
臨床的悪化と自殺のリスク。
大うつ病性障害(MDD)の患者、どちらも成人。 小児は、うつ病やうつ病の悪化を経験する可能性があります。 自殺念慮と行動(自殺)の出現または異常な変化。 彼らが抗うつ薬を服用しているかどうかにかかわらず、行動、そしてこれ。 リスクは、重大な寛解が発生するまで持続する可能性があります。. 自殺は既知のリスクです。 うつ病と他の特定の精神障害、およびこれらの障害。 彼ら自身が自殺の最も強い予測因子です。. 長年の経験があります。 しかし、抗うつ薬が悪化を誘発する役割を果たす可能性があることへの懸念。 うつ病と特定の患者の自殺の出現。 治療の初期段階。. 短期プラセボ対照のプールされた分析。 抗うつ薬(SSRIおよびその他)の試験では、これらの薬が示されました。 子供の自殺的思考と行動(自殺)のリスクを高めます。 青年、および大うつ病性障害(MDD)の青年(18〜24歳)。 その他の精神障害。. 短期的な研究では、増加は見られませんでした。 成人のプラセボと比較した抗うつ薬による自殺のリスク。 24歳を超えて;プラセボと比較して抗うつ薬の減少がありました。 65歳以上の成人。.
プラセボ対照試験のプールされた分析。 MDD、強迫性障害(OCD)の子供および青年、または。 その他の精神障害には、合計24件の短期試験9件が含まれていました。 4400人以上の患者の抗うつ薬。. のプールされた分析。 MDDまたはその他の精神障害のある成人を対象としたプラセボ対照試験。 合計295件の短期試験(2か月の中間期間)11件が含まれています。 77000人以上の患者における抗うつ薬。. かなりのばらつきがありました。 薬物間の自殺のリスクがあるが、増加する傾向。 研究されたほとんどすべての薬物の若い患者。. 違いがありました。 さまざまな適応症にわたる自殺の絶対リスク、最高。 MDDの発生率。ただし、リスクの違い(薬物対プラセボ)は比較的高かった。 年齢層内および適応症全体で安定しています。. これらのリスクの違い。 (1000あたりの自殺の症例数の薬物プラセボの違い。 治療を受けた患者)を表1に示します。.
表1。
| 年齢範囲。 | 治療された患者1000人あたりの自殺の症例数の薬物プラセボの違い。 |
| プラセボと比較して増加します。 | |
| <18。 | 14の追加ケース。 |
| 18-24。 | 5つの追加ケース。 |
| プラセボと比較して減少。 | |
| 25-64。 | 1少ないケース。 |
| ≥65。 | 6件少ないケース。 |
自殺は発生しなかった。 小児試験。. 成人裁判では自殺があったが、その数は自殺した。 自殺への薬物影響についての結論に達するには十分ではありません。.
かどうかは不明です。 自殺リスクは、長期使用、つまり数か月を超えて拡大します。. しかしながら。 プラセボ対照維持試験からの実質的な証拠があります。 抗うつ薬の使用が再発を遅らせることができるうつ病の大人。 うつ病の。.
治療されているすべての患者。 抗うつ薬を使用して、あらゆる適応症を適切に監視する必要があります。 臨床的悪化、自殺、および異常な変化について密接に観察されました。 行動、特に薬物療法のコースの最初の数か月の間。 または、用量変更時に、増加または減少する。.
次の症状、不安、興奮、パニック。 攻撃、不眠症、イライラ、敵意、攻撃性、衝動性、 akathisia(精神運動性落ち着きのなさ)、低 ⁇ 病、および ⁇ 病が報告されています。 成人および小児患者では、抗うつ薬でメジャー治療されています。 うつ病性障害、および精神医学的およびその他の適応症。 非精神医学。. そのような症状の出現の間の因果関係はありますが。 うつ病の悪化および/または自殺の出現。 衝動は確立されていません、そのような症状がかもしれないという懸念があります。 新たな自殺の前兆を表す。.
治療法の変更を検討する必要があります。 投薬の中止を含む可能性のあるレジメン。 うつ病は持続的に悪化している、または誰が緊急の自殺を経験しているか。 またはうつ病や自殺の悪化の前兆となる可能性のある症状。 特にこれらの症状が重度で、突然発症した場合、またはその一部ではなかった場合。 患者の症状。.
治療を中止する決定が下された場合。 薬は可能な限り迅速に、しかし認識して、先細りにする必要があります。 突然の停止は特定の症状に関連している可能性があること(参照)。 注意。 と。 投与量と投与。 -。 の中止。 リスクの説明のために、PEXEVA®(メシル酸パロキセチン)による治療。 PEXEVA®(メシル酸パロキセチン)の中止。))。.
治療を受けている患者の家族と介護者。 大うつ病性障害またはその他の適応症の抗うつ薬。 精神医学および非精神医学は、監視する必要性について警告されるべきです。 興奮、過敏性、異常な変化の出現のための患者。 行動、および上記の他の症状、ならびにその出現。 自殺、そしてそのような症状を医療提供者にすぐに報告すること。. このような監視には、家族や介護者による毎日の観察を含める必要があります。. 処方箋。 PEXEVA®(メシル酸パロキセチン)の場合、最小量で記述する必要があります。 リスクを低減するために、良好な患者管理と一致する錠剤の。 過剰摂取の。.
双極性障害の患者のスクリーニング。
大きなうつ病エピソードが最初の可能性があります。 双極性障害の提示。. それは一般的に信じられています(そうではありません。 対照試験で確立された)そのようなエピソードをで扱うこと。 抗うつ薬だけでも、aの沈殿の可能性が高まることがあります。 双極性障害のリスクがある患者の混合/ ⁇ 病エピソード。. どれか。 上記の症状は、そのような変換が不明であることを表しています。. しかしながら。 抗うつ薬による治療を開始する前に、うつ病患者。 症状が適切にスクリーニングされ、リスクがあるかどうかを判断する必要があります。 双極性障害;そのようなスクリーニングには、詳細な精神医学的歴史が含まれている必要があります。 自殺、双極性障害、うつ病の家族歴を含む。. それ。 PEXEVA®(メシル酸パロキセチン)の使用は承認されていません。 双極性うつ病の治療。.
セロトニン症候群。
生命を脅かす可能性のある開発。 セロトニン症候群は、PEXEVA®を含むSNRIおよびSSRIで報告されています。 単独ですが、特に他のセロトニン作動薬の併用が伴います。 (トリプタン、三環系抗うつ薬、フェンタニル、リチウム、トラマドールを含む。 トリプトファン、ブスピロン、アンフェタミン、および聖。. John's Wort)と薬物で。 セロトニンの代謝を損なう(特に、MAOI、両方を目的としたもの)。 精神障害や、リネゾリッドや静脈内などのその他の疾患を治療します。 メチレンブルー)。.
セロトニン症候群の症状には、精神状態が含まれる場合があります。 変更(例:.、興奮、幻覚、せん妄、 ⁇ 睡)、自律神経。 不安定性(例:.、頻脈、不安定な血圧、めまい、発汗、 紅潮、高体温)、神経筋症状(例:.、振戦、硬直、。 ミオクローヌス、過反射、協調不全)、発作、および/または消化管。 症状(例:.、吐き気、 ⁇ 吐、下 ⁇ )。. 患者は監視されるべきです。 セロトニン症候群の出現。.
PEXEVA®とMAOIの併用。 治療精神障害は禁 ⁇ です。. PEXEVA®も同様です。 linezolidやMAOIなどのMAOIで治療されている患者から始まりました。 静脈内メチレンブルー。. 提供されたメチレンブルーのすべてのレポート。 投与経路に関する情報には静脈内投与が含まれていました。 1 mg / kgから8 mg / kgの用量範囲。. 政権に関する報告はない。 他の経路によるメチレンブルーの(経口錠剤や局所組織注射など)。 または低用量で。. 開始が必要な場合があります。 ラインゾリドまたは静脈内メチレンブルーなどのMAOIによる治療。 PEXEVA®を服用している患者。. PEXEVA®は開始前に中止する必要があります。 MAOIによる治療(参照。 禁 ⁇ 。 と。 投与量と。 管理。).
PEXEVA®と他のセロトニン作動性を併用する場合。 トリプタン、三環系抗うつ薬、フェンタニル、リチウムなどの薬物。 トラマドール、ブスピロン、トリプトファン、アンフェタミン、セント. ジョンズワートは臨床的にです。 保証され、セロトニン症候群の潜在的なリスクの増加に注意してください。 特に治療の開始時と用量の増加時。.
PEXEVA®と併用セロトニン作動薬による治療。 上記のイベントが発生した場合、エージェントは直ちに中止する必要があります。 支持的な対症療法を開始する必要があります。.
角度閉鎖緑内障。
多くの使用後に発生する ⁇ 拡張。 Pexevaを含む抗うつ薬は、アングルクロージャー攻撃を引き起こす可能性があります。 特許 ⁇ 彩切除術を受けていない解剖学的に狭い角度の患者。.
チオリダジンとの潜在的な相互作用。
チオリダジン投与だけで生成されます。 深刻な心室に関連するQTc間隔の延長。 トルサードドポワント型不整脈などの不整脈、および突然死。. この効果は用量に関連しているようです。.
。 in vivo。 研究は、阻害する薬物を示唆しています。 パロキセチンなどのCYP2D6は、チオリダジンの血漿中濃度を上昇させます。. したがって、パロキセチンを組み合わせて使用 しないことをお勧めします。 チオリダジン(禁 ⁇ と注意を参照)。.
妊娠中の使用。
催奇形性の影響。
疫学研究は、乳児が暴露したことを示しています。 妊娠の最初の三半期にパロキセチンにすると、リスクが高まります。 先天性奇形、特に心血管奇形。. 。 これらの研究からの調査結果は以下に要約されています。
- スウェーデンの国家登録データに基づく調査。 妊娠中にパロキセチンに曝露された乳児(n = 815)が持っていたことを示した。 心血管奇形のリスクの増加(2%のリスク) パロキセチン曝露乳児)をレジストリ全体の人口と比較(1%。 リスク)、オッズ比(OR)が1.8の場合(95%信頼区間1.1〜2.8)。. 番号。 先天性奇形全体のリスクの増加は、 パロキセチン暴露乳児。. パロキセチン暴露の心臓奇形。 乳児は主に心室中隔欠損症(VSD)と心房中隔でした。 欠陥(ASD)。. 9月の欠陥は、解決するものからの重大度の範囲です。 自発的に手術を必要とする人に。.
- ユナイテッドからの別の回顧的コホート研究。 州(United Healthcareデータ)は、調剤された母親の乳児5,956人を評価しました。 最初の学期中の抗うつ薬(パロキセチンの場合はn = 815)。. この研究。 心血管奇形のリスク増加傾向を示した。 他の抗うつ薬(1%のリスク)と比較したパロキセチン(1.5%のリスク)。 ORが1.5(95%信頼区間0.8〜2.9)。. 12個のパロキセチン暴露。 心血管奇形のある乳児、9人はVSDを持っていました。. この研究も。 を含む全体的な主要な先天性奇形のリスクの増加を示唆した。 他の(2%のリスク)と比較したパロキセチンの心血管欠損(4%のリスク)。 抗うつ薬(OR 1.8; 95%信頼区間1.2〜2.8)。.
- 個別のデータベースを使用した2つの大きなケースコントロール研究。 それぞれが9,000を超える先天性欠損症のケースと4,000を超えるコントロールを持っていることがわかりました。 妊娠の最初の学期中のパロキセチンの母体使用はそうでした。 右心室流出路の2〜3倍の増加リスクに関連しています。 障害物。. ある研究では、ORは2.5(95%信頼区間、1.0〜6.0)でした。 7人の暴露された乳児)と他の研究では、ORは3.3(95%信頼度)でした。 間隔、1.3から8.8、6人の暴露された幼児)。.
- 他の研究では、かどうかに関してさまざまな結果が見つかりました。 全体的、心血管的、または特定の先天性のリスクが高まりました。 奇形。. 16年間の疫学データのメタ分析。 (1992年から2008年)には、合計20の異なる研究が含まれています。 上記の研究)心血管欠損症と両方の推定値を報告しました。 全体的な先天性奇形、3つの研究は推定値のみを報告しました。 心血管欠損症、および6つの研究は、全体についての推定のみを報告しました。 先天性奇形。. 制限がありますが、このメタ分析。 心血管奇形(有病率)の発生の増加を示唆した。 オッズ比[POR] 1.5; 95%信頼区間1.2〜1.9)および全体。 パロキセチン使用による奇形(POR 1.2; 95%信頼区間1.1〜1.4)。 最初の学期中。. このメタ分析では不可能でした。 心血管奇形がどの程度あるかを決定します。 全体的な奇形に寄与し、かどうかを判断することもできませんでした。 特定の種類の心血管奇形がすべてに寄与した。 心血管奇形。.
- パロキセチンの服用中に患者が妊娠した場合。 彼女は胎児への潜在的な害について助言されるべきです。. 利点がない限り。 母親へのパロキセチンの継続的な治療を正当化する、考慮すべきです。 パロキセチン療法を中止するか、別の療法に切り替える。 抗うつ薬(参照。 注意。-治療の中止。 PEXEVA®。)。. 妊娠するつもりか、最初の女性のために。 妊娠の三半期、パロキセチンは検討後にのみ開始されるべきです。 他の利用可能な治療オプションの。.
動物の発見。
生殖研究は50までの用量で行われた。 器官形成中に投与されたラットではmg / kg /日、ウサギでは6 mg / kg /日。. これらの用量は、mg /m²でMRHDの約8(ラット)および2(ウサギ)倍です。 基礎。. これらの研究は催奇形性の影響の証拠を明らかにしていません。. しかしながら。 ラットでは、最初の4日間の子犬の死亡が増加しました。 妊娠の最後の学期中に投与が行われたときの授乳。 授乳中ずっと続きました。. この効果は、1 mg / kg /日の用量で発生しました。 または、mg /m²ベースでMRHDの約6分の1。. 効果のない線量。 ラットの子犬の死亡率は決定されていません。. これらの死の原因はそうではありません。 知られています。.
非催奇形性効果。
PEXEVA®および他のSSRIまたはセロトニンに曝露された新生児。 そして、ノルエピネフリン再取り込み阻害剤(SNRI)、妊娠後期。 長期入院、呼吸を必要とする合併症を発症しました。 サポート、およびチューブフィード。. このような合併症はすぐに発生する可能性があります。 配達。. 報告された臨床所見には呼吸困難が含まれています。 チアノーゼ、無呼吸、発作、体温の不安定性、摂食困難、 ⁇ 吐、低血糖、低血圧、緊張 ⁇ 進、反射 ⁇ 進、振戦。 震え、イライラ、そして絶え間ない泣き声。. これらの機能は一貫しています。 SSRIとSNRIの直接的な毒性効果、または場合によっては薬物のいずれか。 中止症候群。. 場合によっては、臨床的であることに注意すべきです。 写真はセロトニン症候群と一致しています(参照。 警告。: セロトニン。 シンドローム。).
妊娠中のSSRIに曝露した乳児は、 新生児の持続的な肺高血圧症(PPHN)のリスクの増加。. PPHNは、一般人口の1,000人の出生あたり1〜2で発生し、 実質的な新生児の ⁇ 患率と死亡率に関連しています。. 最近いくつか。 疫学研究は、SSRI間の肯定的な統計的関連を示唆しています。 妊娠およびPPHNでの使用(PEXEVA®を含む)。他の研究は示していません。 重要な統計的関連。.
医師はまた、見込み客の結果に注意する必要があります。 大うつ病の病歴のある201人の妊婦の縦断的研究。 抗うつ薬を飲んでいたか、抗うつ薬を投与されたのが12人未満でした。 彼らの最後の月経期間の数週間前に、そして寛解していた。. 女性。 妊娠中の中止された抗うつ薬は有意を示した。 それらの女性と比較して彼らの大うつ病の再発の増加。 妊娠中ずっと抗うつ薬を投与されていました。.
妊娠中の女性をPEXEVA®で治療する場合、 医師は、SSRIを服用することの潜在的なリスクの両方を慎重に検討する必要があります。 うつ病を治療することの確立された利点とともに。 抗うつ薬。. この決定は、ケースバイケースでのみ行うことができます(参照)。 投薬。 そして管理。 と。 逆の反応。, 市販後レポート。).
注意。
一般的な。
マニア/ヒポマニアの活性化。
市販前のテスト中に、低 ⁇ 病または ⁇ 病が発生しました。 パロキセチン治療を受けた単極患者の約1.0%で1.1%と比較。 アクティブコントロールの0.3%とプラセボ治療単極患者の0.3%。. のサブセットで。 双極性として分類された患者は、 ⁇ 病エピソードの割合が2.2%でした。 パロキセチン、および結合されたアクティブコントロールグループの11.6%。. すべての薬と同様に。 MDDの治療に有効なパロキセチンは、慎重に使用する必要があります。 ⁇ 病の病歴のある患者。.
発作。
市販前テスト中に、発作は0.1%で発生しました。 パロキセチン治療患者、他の薬物に関連するものと同様の割合。 MDDの治療に効果的です。パロキセチンは慎重に使用する必要があります。 発作の病歴のある患者。. 患者さんには中止してください。 発作を起こす人。.
PEXEVA®(パロキセチン)による治療の中止。 メシル酸塩)。
承認されたさまざまな臨床試験をサポートする最近の臨床試験。 パロキセチンの適応症は、テーパー相レジメンではなく、 治療の突然の中止。. GADで使用されるテーパーフェーズレジメン。 PTSD臨床試験では、1日量が10ずつ減少しました。 週ごとの間隔でのmg /日。. 20 mg /日の1日量に達したとき。 患者は、治療が中止される前に、この用量を1週間継続した。.
これらの研究におけるこのレジメンでは、以下の不利な点があります。 イベントは、パロキセチンの発生率が2%以上であると報告されました。 プラセボについて報告した少なくとも2回の発生率:異常な夢、。 感覚異常、めまい。. 大多数の患者では、これらのイベントは軽度でした。 緩和し、自己制限的であり、医学的介入を必要としませんでした。.
パロキセチンおよびその他のSSRIおよびSNRIの販売中。 (セロトニンとノルエピネフリン再取り込み阻害剤)、自然発生的です。 これらの薬物の中止時に発生した有害事象の報告。 (特に突然)、以下を含む:不快感、気分。 過敏性、興奮、めまい、感覚障害(例:感覚異常など)。 感電感や耳鳴りとして)、不安、混乱、頭痛など。 ⁇ 眠、情緒不安定、不眠症、低 ⁇ 病。. これらのイベントがある間。 一般に自己制限的であり、深刻な中止の報告があります。 症状。.
患者はこれらの症状を監視する必要があります。 パロキセチンによる治療の中止。. 用量の段階的な減少、。 突然の停止ではなく、可能な限り推奨されます。. 耐えられない場合。 症状は、用量の減少後または中止時に発生します。 治療、その後、以前に処方された用量の再開を検討することができます。. その後、医師は用量を減らし続けるかもしれませんが、それ以上です。 段階的レート(参照。 投与量と投与。).
また見なさい。 注意。-有害な小児用。 小児科におけるパロキセチンによる治療の中止時に報告された事象。 患者。.
タモキシフェン。
いくつかの研究は、タモキシフェンの有効性が示されています。 乳がんの再発/死亡のリスクによって測定されるように、いつ減少する可能性があります。 パロキセチンの不可逆性の結果としてパロキセチンと共同処方。 CYP2D6の阻害(参照。 薬物相互作用。)。. ただし、他の研究。 そのようなリスクを示すことができませんでした。. かどうかは不明です。 パロキセチンとタモキシフェンの同時投与は、重大な悪影響を及ぼします。 タモキシフェンの有効性について。. タモキシフェンが治療に使用されるとき、または。 乳がんの予防、処方者は代替薬の使用を検討する必要があります。 CYP2D6阻害がほとんどまたはまったくない抗うつ薬。.
アカティシア。
パロキセチンまたは他のSSRIの使用が関連付けられています。 内面の感覚を特徴とするアカシジアの発達とともに。 座ったり立ったりできないなどの落ち着きのなさと精神運動の興奮。 まだ通常、主観的な苦痛に関連しています。. これは最も発生する可能性が高いです。 治療の最初の数週間以内。.
低ナトリウム血症。
低ナトリウム血症は、治療の結果として発生する可能性があります。 PEXEVA®(メシル酸パロキセチン)を含むSSRIおよびSNRI。. 多くの場合、これ。 低ナトリウム血症は不適切な症候群の結果であると思われます。 抗利尿ホルモン分 ⁇ (SIADH)。. 血清ナトリウムが110未満の症例。 mmol / Lが報告されています。. 高齢患者はより大きなリスクにさらされている可能性があります。 SSRIおよびSNRIによる低ナトリウム血症の発症。. また、利尿薬を服用している患者。 または、そうでなければボリュームが枯渇している人は、より大きなリスクにさらされる可能性があります(参照)。 老人。 使用する。)。. PEXEVA®(メシル酸パロキセチン)の中止を検討する必要があります。 症候性低ナトリウム血症と適切な医療介入のある患者。 設立されるべきです。.
低ナトリウム血症の兆候と症状には頭痛が含まれます。 集中困難、記憶障害、混乱、弱さ、そして。 落胆につながる可能性のある不安定さ。. 兆候と症状はもっと関連しています。 重度および/または急性の症例には、幻覚、失神、発作、 ⁇ 睡などがあります。 呼吸停止、そして死。.
異常な出血。
PEXEVA®(メシル酸パロキセチン)を含むSSRIおよびSNRI。 出血イベントのリスクを高める可能性があります。. アスピリンの併用。 非ステロイド性抗炎症薬、ワルファリン、およびその他の抗凝固剤は、 このリスクに追加します。. ケースレポートと疫学研究(ケースコントロールと コホート設計)は、薬物の使用との関連を示しています。 セロトニンの再取り込みと消化管の発生を妨害します。 出血。. SSRIおよびSNRIの使用に関連する出血イベントは、さまざまな範囲にあります。 斑状出血、血腫、鼻出血、点状出血から生命にかかわる。 出血。.
出血のリスクについては患者に注意する必要があります。 PEXEVA®(メシル酸パロキセチン)の併用に関連し、 NSAID、アスピリン、または凝固に影響を与えるその他の薬物。.
骨の骨折。
以下の骨折リスクに関する疫学研究。 SSRIを含む一部の抗うつ薬への曝露は、関連を報告しています。 抗うつ薬治療と骨折の間。. 複数可能です。 この観察の原因であり、骨折リスクがどの程度かは不明です。 SSRI治療に直接起因します。. 病理学的可能性。 骨折、つまり、患者の外傷が最小限であることによって生じる骨折。 骨ミネラル密度の低下は、治療を受けた患者で考慮する必要があります。 説明のつかない骨の痛み、点の圧痛、腫れを示すパロキセチン。 またはあざ。.
付随する病気の患者での使用。
患者におけるパロキセチンの臨床経験。 特定の付随する全身性疾患は限られています。. 使用には注意が必要です。 代謝に影響を与える可能性のある疾患または状態の患者のパロキセチン。 または血行力学的反応。.
パロキセチンは評価されておらず、使用されていません。 心筋 ⁇ 塞の最近の病歴のある患者でかなりの程度。 または不安定な心臓病。. これらの診断を受けた患者は除外されました。 製品の市販前試験中の臨床試験。. 評価。 二重盲検でパロキセチンを投与された682人の患者の心電図。 しかし、プラセボ対照試験は、パロキセチンがそうであることを示していませんでした。 重大なECG異常の発生に関連。. 同様に。 パロキセチンは、心拍数や臨床的に重要な変化を引き起こしません。 血圧。.
パロキセチンの血漿濃度の上昇が起こります。 重度の腎機能障害(クレアチニンクリアランス<30 ml / min)の患者または。 重度の肝機能障害。. そのような患者では、より低い開始用量を使用する必要があります。 (参照。 投与量と投与。).
患者さんのための情報。
PEXEVA®(メシル酸パロキセチン)は噛んだりしないでください。 粉砕し、丸ごと飲み込む必要があります。.
セロトニンのリスクについては、患者に注意する必要があります。 パロキセチンとトリプタン、トラマドール、またはの併用を伴う症候群。 他のセロトニン作動薬。.
患者は、Pexevaを服用すると原因となる可能性があることを通知する必要があります。 影響を受けやすい個人では、軽度の ⁇ 孔拡張が 角閉鎖緑内障のエピソード。. 既存の緑内障はほとんど常にです。 角度閉鎖緑内障は、診断されたときに治療できるため、開放隅角緑内障。 確実に ⁇ 摘出術で。. 開放隅角緑内障は危険因子ではありません。 角度閉鎖緑内障。. 患者は、検査を受けてかどうかを判断したいと思うかもしれません。 それらは角度閉鎖の影響を受けやすく、予防手順があります(例:.、。 ⁇ 摘出術)、影響を受けやすい場合。.
処方者または他の医療専門家は通知する必要があります。 患者、その家族、および介護者は、利益とリスクについて考えます。 PEXEVA®(メシル酸パロキセチン)による治療に関連しており、助言する必要があります。 適切な使用法でそれら。. 患者。 投薬ガイド。 「抗うつ薬。 薬、うつ病およびその他の深刻な精神疾患、および自殺念慮。 またはアクション」はPEXEVA®(パロキセチンメシル酸塩)で利用できます。. 処方者または。 医療専門家は患者、その家族、そして彼らに指示するべきです。 介護者は薬ガイドを読み、理解を支援する必要があります。 その内容。. 患者には内容について話し合う機会を与えるべきです。 の。 投薬ガイド。 そして、彼らが持つかもしれない質問への答えを得るために。. の全文。 投薬ガイド。 これで最後に転載されます。 文書。.
患者には以下の問題について助言する必要があります。 PEXEVA®(パロキセチン)を服用しているときにこれらが発生した場合は、処方者に警告するように求めました。 メシル酸塩)。.
臨床的悪化と自殺のリスク。
患者、その家族、および介護者はそうあるべきです。 不安、興奮、パニック発作の出現に警戒するよう奨励されました。 不眠症、イライラ、敵意、攻撃性、衝動性、アカシジア。 (精神運動不穏)、低 ⁇ 病、 ⁇ 病、その他の異常な変化。 行動、うつ病の悪化、自殺念慮、特に早期。 抗うつ薬治療中および用量を上下に調整したとき。. 患者の家族や介護者は、出現を探すように助言されるべきです。 変化が突然になる可能性があるため、そのような症状の日常的なもの。. そのような。 症状は患者の処方者または医療専門家に報告する必要があります。 特に、重度であるか、突然発症したか、その一部ではなかった場合。 患者の症状。. これらのような症状は、 自殺念慮と行動のリスクの増加と非常に必要性を示しています。 綿密なモニタリングとおそらく薬の変化。.
止血と干渉する薬物(NSAID、アスピリン、。 ワルファリンなど.)。
患者は併用されることについて注意する必要があります。 NSAID、アスピリン、または凝固に影響を与えるその他の薬物を含むパロキセチン。 セロトニンの再取り込みを妨げる向精神薬の併用。 そしてこれらの薬剤は出血のリスクの増加と関連しています。.
認知および運動パフォーマンスとの干渉。
精神活性薬物は、判断、思考、またはを損なう可能性があります。 運動能力。. 対照研究ではパロキセチンは示されていませんが。 精神運動能力を損なう、患者は手術について注意されるべきです。 自動車を含む危険な機械は、合理的に確実になるまで。 そのパロキセチン療法は、そのような活動に従事する能力に影響を与えません。.
治療コースを完了します。
患者はパロキセチンの改善に気づくかもしれませんが。 1〜4週間で治療を行う場合は、治療を継続するようにアドバイスする必要があります。 指示。.
併用薬。
患者は医師に通知するように助言されるべきです。 彼らは処方薬や市販薬を服用している、または服用する予定です。 相互作用の可能性があるためです。.
アルコール。
パロキセチンは増加することは示されていませんが。 アルコールによって引き起こされる精神的および運動能力の障害、患者はそうあるべきです。 PEXEVA®(パロキセチンメシル酸塩)を服用している間はアルコールを避けることをお勧めします。.
妊娠。
患者は医師に通知するように助言されるべきです。 彼らは妊娠するか、治療中に妊娠するつもりです(参照。 警告。 - 妊娠での使用。: 催奇形性と非催奇形性。 効果。).
看護。
患者は医師に通知するように助言されるべきです。 彼らは乳児に母乳を与えています(参照。 注意。 -。 授乳中の母親。).
実験室試験。
推奨される特定の実験室試験はありません。.
Paxil®(塩酸パロキセチン)。
PEXEVA®(パロキセチン)の有効成分であるパロキセチン。 メシル酸塩)は、Paxil®の有効成分でもあります。. したがって、これら2つのエージェント。 同時投与しないでください。.
発がん、変異誘発、生殖能力の障害。
発がん。
2年間の発がん性試験が行われた。 げっ歯類は、1、5、および25 mg / kg /日(マウス)および1、5で食事中にパロキセチンを投与されました。 および20 mg / kg /日(ラット)。. これらの用量は、最大2.4(マウス)および3.9(ラット)時間です。 mg /m²ベースのMDDおよびGADの最大推奨ヒト用量(MRHD)。. MDDのMRHDはOCDのMRHDよりもわずかに低いため(50 mg対60 mg)、 これらの発がん性試験で使用された用量は、2.0(マウス)と3.2のみでした。 (ラット)OCDのMRHDの倍数。男性の数がかなり多かった。 網状細胞肉腫(1 / 100、0 / 50、0 / 50、 対照群、低用量群、中用量群、高用量群のそれぞれ4/50)およびa。 発生のためにグループ間で線形傾向が大幅に増加しました。 オスのラットのリンパ系腫瘍。. 雌ラットは影響を受けなかった。. でも。 マウスの腫瘍の数に用量に関連した増加があり、ありませんでした。 腫瘍のあるマウスの数の薬物関連の増加。. これらの関連性。 人間への発見は不明です。.
変異誘発。
パロキセチンは、一連の遺伝毒性作用を示さなかった。 5。 in vitro。 および2。 in vivo。 以下を含むアッセイ:細菌変異。 アッセイ、マウスリンパ腫変異アッセイ、予定外のDNA合成アッセイ、および。 細胞遺伝性異常の検査。 in vivo。 マウスの骨髄と。 in vitro。 に。 ヒトリンパ球およびラットの主要な致死試験。.
不妊の障害。
一部の臨床試験では、SSRI(含む パロキセチン)は、SSRI治療中に精子の質に影響を与える可能性があり、影響を与える可能性があります。 一部の男性の生殖能力。.
妊娠率の低下が生殖で見つかりました。 15 mg / kg /日のパロキセチンの用量でのラットでの研究。 MDDおよびGADのMRHD、またはmg /m²ベースのOCDのMRHDの2.4倍。. 不可逆的な病変は、後に雄ラットの生殖管で発生した。 2〜52週間の毒性試験への投与。. これらの病変は以下から成っていた。 50 mg / kg /日の精巣上体尿細管上皮の空胞化および ⁇ 縮。 精子が逮捕された精巣の精細管の変化。
副作用。
治療の中止に関連。
治療を受けた患者の20%(1199/6145)。 MDDの世界的な臨床試験におけるパロキセチン、11.8%(64/542)、9.4%。 (44/469)、および世界中でパロキセチンで治療された患者の10.7%(79/735)。 OCD、PD、およびGADでの試験は、それぞれのために治療を中止しました。 有害事象。. 関連する最も一般的なイベント(≥1%)。 中止および薬物関連であると見なされます(つまり、関連するイベント)。 比較すると、パロキセチンの約2倍以上の割合で脱落します。 プラセボへ)以下が含まれています:。
| MDD。 | OCD。 | PD | GAD。 | |||||
| パロキセチン。 | プラセボ。 | パロキセチン。 | プラセボ。 | パロキセチン。 | プラセボ。 | パロキセチン。 | プラセボ。 | |
| CNS。 | ||||||||
| 傾眠。 | 2.3%。 | 0.7%。 | - | - | 1.9%。 | 0.3%。 | 2.0%。 | 0.2%。 |
| 不眠症。 | - | - | 1.7%。 | 0% | 1.3%。 | 0.3%。 | - | - |
| 興奮。 | 1.1%。 | 0.5%。 | - | - | - | - | - | - |
| 振戦。 | 1.1%。 | 0.3%。 | - | |||||
| めまい。 | - | - | 1.5%。 | 0% | - | - | 1.0%。 | 0.2%。 |
| 消化器。 | ||||||||
| 便秘。 | - | - | 1.1%。 | 0% | - | - | - | - |
| 吐き気。 | 3.2%。 | 1.1%。 | 1.9%。 | 0% | 3.2%。 | 1.2%。 | 2.0%。 | 0.2%。 |
| 下 ⁇ 。 | 1.0%。 | 0.3%。 | - | - | - | - | - | - |
| 口渇。 | 1.0%。 | 0.3%。 | - | - | - | - | - | - |
| ⁇ 吐。 | 1.0%。 | 0.3%。 | - | - | - | - | - | - |
| その他。 | ||||||||
| 無力症。 | 1.6%。 | 0.4%。 | 1.9%。 | 0.4%。 | - | - | 1.8%。 | 0.2%。 |
| 異常。 | 1.6%。 | 0% | 2.1%。 | 0% | - | - | 2.5%。 | 0.5%。 |
| 射精。1 | ||||||||
| 発汗。 | 1.0%。 | 0.3%。 | - | - | - | - | 1.1%。 | 0.2%。 |
| インポテンツ。1 | - | - | 1.5%。 | 0% | - | - | - | - |
| 数値が提供されていない場合、発生率。
パロキセチンで治療された患者の有害事象は1%以下であったか、またはそうではありませんでした。
プラセボの発生率の2倍以上。. 1 性別で修正された発生率。. |
||||||||
一般的に観察される有害事象。
大うつ病性障害。
最も一般的に観察されます。 パロキセチンの使用に関連する有害事象(5%の発生率または 得られたプラセボの2倍以上のパロキセチンの発生率。 以下の表2から)は、無力症、発汗、吐き気、食欲低下でした。 傾眠、めまい、不眠症、振戦、緊張、射精障害、 その他の男性性器障害。.
強迫性障害。
最も一般的に観察されます。 パロキセチンの使用に関連する有害事象(5%の発生率または 得られたプラセボの少なくとも2倍のパロキセチンの発生率。 以下の表3から)は、吐き気、口渇、食欲減退、便秘でした。 めまい、傾眠、振戦、発汗、インポテンス、異常な射精。.
パニック障害。
最も一般的に観察されます。 パロキセチンの使用に関連する有害事象(5%の発生率または 得られたプラセボの2倍以上のパロキセチンの発生率。 以下の表3から)は、無力症、発汗、食欲減退、性欲でした。 減少、振戦、異常な射精、女性性器障害、および。 インポテンツ。.
全般性不安障害。
最も一般的に観察されます。 パロキセチンの使用に関連する有害事象(5%の発生率または 得られたプラセボの2倍以上のパロキセチンの発生率。 表4)から:無力症、感染症、便秘、食欲減退、乾燥。 口、吐き気、性欲の低下、傾眠、振戦、発汗、異常。 射精。.
制御された臨床試験の発生率。
処方者は、の数字が 以下の表は、副作用の発生率を予測するために使用できません。 患者の特徴やその他の通常の医療コース。 臨床試験で優勢だった要因とは異なります。. 同様に、 引用された頻度は、他の臨床から得られた数値と比較することはできません。 さまざまな治療、使用、調査員を含む調査。. 。 ただし、引用された数値は、処方医師に何らかの根拠を提供します。 薬物および非薬物要因の相対的な寄与を推定するため。 調査した集団の副作用発生率。.
大うつ病性障害。
表2は、で発生した有害事象を列挙しています。 参加したパロキセチン治療患者の1%以上の発生率。 患者がaで投与された短期(6週間)プラセボ対照試験。 20〜50 mg /日の範囲。. 報告された有害事象はaを使用して分類されました。 標準のCOSTARTベースの辞書用語。.
表2:治療緊急有害経験。
MDDのプラセボ対照臨床試験の発生率。1
| ボディシステム。 | 優先用語。 | パロキセチン。 (n = 421)。 |
プラセボ。 (n = 421)。 |
| 全体としての体。 | 頭痛。 | 18%。 | 17%。 |
| 無力症。 | 15%。 | 6% | |
| 心血管。 | 動 ⁇ 。 | 3% | 1% |
| 血管拡張。 | 3% | 1% | |
| 皮膚科。 | 発汗。 | 11%。 | 2% |
| 発疹。 | 2% | 1% | |
| 消化器。 | 吐き気。 | 26%。 | 9% |
| 口渇。 | 18%。 | 12%。 | |
| 便秘。 | 14%。 | 9% | |
| 下 ⁇ 。 | 12%。 | 8% | |
| 食欲の低下。 | 6% | 2% | |
| ⁇ 腸。 | 4% | 2% | |
| Oropharynx障害。2 | 2% | 0% | |
| 消化不良。 | 2% | 1% | |
| 筋骨格。 | ミオパシー。 | 2% | 1% |
| 筋肉痛。 | 2% | 1% | |
| 筋無力症。 | 1% | 0% | |
| 神経系。 | 傾眠。 | 23%。 | 9% |
| めまい。 | 13%。 | 6% | |
| 不眠症。 | 13%。 | 6% | |
| 振戦。 | 8% | 2% | |
| 緊張。 | 5% | 3% | |
| 不安。 | 5% | 3% | |
| 感覚異常。 | 4% | 2% | |
| リビドーが減少しました。 | 3% | 0% | |
| 薬のような感じ。 | 2% | 1% | |
| 混乱。 | 1% | 0% | |
| 呼吸。 | あくび。 | 4% | 0% |
| 特別感覚。 | ぼやけたビジョン。 | 4% | 1% |
| 変態を味わう。 | 2% | 0% | |
| ⁇ 尿生殖器系。 | 射精障害。3,4。 | 13%。 | 0% |
| その他の男性性器障害。3,5。 | 10%。 | 0% | |
| 尿頻度。 | 3% | 1% | |
| 排尿障害。6 | 3% | 0% | |
| 女性性器障害。3,7。 | 2% | 0% | |
| 1 患者の少なくとも1%が報告したイベント。
パロキセチンで治療されたものが含まれていますが、以下のイベントがありました。
プラセボ≥パロキセチンの発生率:腹痛、興奮、腰痛、
胸痛、CNS刺激、発熱、食欲増進、ミオクローヌス、 ⁇ 頭炎など。
姿勢性低血圧、呼吸障害(主に「風邪の症状」または
「URI」)、トラウマ、 ⁇ 吐。. 2 主に「喉のしこり」と「喉の圧迫感」が含まれます。.」。 3 性別で修正された割合。. 4 主に「射精遅延。.」。 5 「無オルガスム」、「勃起困難」、「遅延」が含まれます。 射精/ ⁇ 覚」、「性機能障害」、「インポテンス。.」。 6 主に「排尿困難」と「尿」が含まれます。 ためらい。.」。 7 主に「無オルガスム」と「到達困難」を含みます。 クライマックス/オルガスム。.」。 |
強迫性障害そして。 パニック障害。
表3は、不利益を列挙しています。 オン中のOCD患者の間で2%以上の頻度で発生したイベント。 12週間のプラセボ対照試験に参加したパロキセチン。 患者は20〜60 mg /日の範囲で、または患者の間で投与されました。 10対のプラセボ対照試験に参加したパロキセチンのPD。 患者が10〜60 mg /日の範囲で投与された12週間の期間。.
表3:トリートメント緊急。
プラセボ対照臨床試験における有害経験の発生率。
強迫性障害およびパニック障害。1
| ボディシステム。 | 優先用語。 | 強迫性障害。 | パニック障害。 | ||
| パロキセチン。 (n = 542)。 |
プラセボ。 (n = 265)。 |
パロキセチン。 (n = 469)。 |
プラセボ。 (n = 324)。 |
||
| 全体としての体。 | 無力症。 | 22%。 | 14%。 | 14%。 | 5% |
| 腹痛。 | - | - | 4% | 3% | |
| 胸の痛み。 | 3% | 2% | - | - | |
| 背中の痛み。 | - | - | 3% | 2% | |
| 悪寒。 | 2% | 1% | 2% | 1% | |
| 心血管。 | 血管拡張。 | 4% | 1% | - | - |
| 動 ⁇ 。 | 2% | 0% | - | - | |
| 皮膚科。 | 発汗。 | 9% | 3% | 14%。 | 6% |
| 発疹。 | 3% | 2% | - | - | |
| 消化器。 | 吐き気。 | 23%。 | 10%。 | 23%。 | 17%。 |
| 口渇。 | 18%。 | 9% | 18%。 | 11%。 | |
| 便秘。 | 16%。 | 6% | 8% | 5% | |
| 下 ⁇ 。 | 10%。 | 10%。 | 12%。 | 7% | |
| 食欲の低下。 | 9% | 3% | 7% | 3% | |
| 食欲の増加。 | 4% | 3% | 2% | 1% | |
| 神経系。 | 不眠症。 | 24%。 | 13%。 | 18%。 | 10%。 |
| 傾眠。 | 24%。 | 7% | 19%。 | 11%。 | |
| めまい。 | 12%。 | 6% | 14%。 | 10%。 | |
| 振戦。 | 11%。 | 1% | 9% | 1% | |
| 緊張。 | 9% | 8% | - | - | |
| リビドーが減少しました。 | 7% | 4% | 9% | 1% | |
| 興奮。 | - | - | 5% | 4% | |
| 不安。 | - | - | 5% | 4% | |
| 異常な夢。 | 4% | 1% | - | - | |
| 濃度障害。 | 3% | 2% | - | - | |
| 離人。 | 3% | 0% | - | - | |
| ミオクローヌス。 | 3% | 0% | 3% | 2% | |
| 健忘症。 | 2% | 1% | - | - | |
| 呼吸器系。 | 鼻炎。 | - | - | 3% | 0% |
| 特別感覚。 | 異常なビジョン。 | 4% | 2% | - | - |
| 変態を味わう。 | 2% | 0% | - | - | |
| ⁇ 尿生殖器系。 | 異常な射精。2 | 23%。 | 1% | 21%。 | 1% |
| 女性性器障害。2 | 3% | 0% | 9% | 1% | |
| インポテンツ。2 | 8% | 1% | 5% | 0% | |
| 尿頻度。 | 3% | 1% | 2% | 0% | |
| 排尿障害。 | 3% | 0% | - | - | |
| 尿路感染症。 | 2% | 1% | 2% | 1% | |
| 1 OCDまたはPDの少なくとも2%によって報告されたイベント。
プラセボ≥パロキセチン[OCD]で発生した以下のイベントを除いて、パロキセチン治療患者が含まれています。
腹痛、興奮、不安、腰痛、咳の増加、うつ病、
頭痛、運動過多、感染症、感覚異常、 ⁇ 頭炎、呼吸器。
障害、鼻炎、副鼻腔炎。. [PD]:異常な夢、異常なビジョン、。
胸の痛み、咳の増加、離人、うつ病、月経困難症、
消化不良、インフルエンザ症候群、頭痛、感染症、筋肉痛、緊張、
動 ⁇ 、知覚異常、 ⁇ 頭炎、発疹、呼吸器疾患、副鼻腔炎。
味覚異常、外傷、排尿障害、血管拡張。. 2 性別で修正された割合。. |
全般性不安障害。
表4は、aで発生した有害事象を列挙しています。 参加したパロキセチンのGAD患者の2%以上の頻度。 患者がaで投与された8週間の期間のプラセボ対照試験。 10 mg /日から50 mg /日の範囲。.
表4:治療緊急有害経験。
全般性不安のプラセボ対照臨床試験の発生率。
障害。1
| ボディシステム。 | 優先用語。 | パロキセチン。 (n = 735)。 |
プラセボ。 (n = 529)。 |
| 全体としての体。 | 無力症。 | 14%。 | 6% |
| 頭痛。 | 17%。 | 14%。 | |
| 感染。 | 6% | 3% | |
| 心血管。 | 血管拡張。 | 3% | 1% |
| 皮膚科。 | 発汗。 | 6% | 2% |
| 消化器。 | 吐き気。 | 20%。 | 5% |
| 口渇。 | 11%。 | 5% | |
| 便秘。 | 10%。 | 2% | |
| 下 ⁇ 。 | 9% | 7% | |
| 食欲の低下。 | 5% | 1% | |
| ⁇ 吐。 | 3% | 2% | |
| 神経系。 | 不眠症。 | 11%。 | 8% |
| 傾眠。 | 15%。 | 5% | |
| めまい。 | 6% | 5% | |
| 振戦。 | 5% | 1% | |
| 緊張。 | 4% | 3% | |
| リビドーが減少しました。 | 9% | 2% | |
| 呼吸器系。 | 呼吸器疾患。 | 7% | 5% |
| 副鼻腔炎。 | 4% | 3% | |
| あくび。 | 4% | - | |
| 特別感覚。 | 異常なビジョン。 | 2% | 1% |
| ⁇ 尿生殖器系。 | 異常な射精。2 | 25%。 | 2% |
| 女性性器。2 | 4% | 1% | |
| 無力無力。2 | 4% | 3% | |
| 1 GADの少なくとも2%が報告したイベント。
以下のイベントを除いて、パロキセチンで治療された患者が含まれています。
プラセボ≥パロキセチンで発生した:腹痛、背中。
痛み、外傷、消化不良、筋肉痛、 ⁇ 頭炎。. 2 性別で修正された割合。. |
有害事象の用量依存性。
有害事象の比較。 パロキセチン10、20、30、および40 mg /日を比較した固定用量試験の率。 MDDの治療におけるプラセボは、一部の明確な用量依存性を明らかにしました。 に示されているように、パロキセチンの使用に関連するより一般的な有害事象。 次の表:。
表5:治療緊急。
治療における用量比較試験における有害経験の発生率。
MDD *。
| ボディシステム/優先用語。 | プラセボ。 n = 51。 |
パロキセチン。 | |||
| 10 mg。 n = 102。 |
20 mg。 n = 104。 |
30 mg。 n = 101。 |
40 mg。 n = 102。 |
||
| 全体としての体。 | |||||
| 無力症。 | 0.0%。 | 2.9%。 | 10.6%。 | 13.9%。 | 12.7%。 |
| 皮膚科。 | |||||
| 発汗。 | 2.0%。 | 1.0%。 | 6.7%。 | 8.9%。 | 11.8%。 |
| 消化器。 | |||||
| 便秘。 | 5.9%。 | 4.9%。 | 7.7%。 | 9.9%。 | 12.7%。 |
| 食欲の低下。 | 2.0%。 | 2.0%。 | 5.8%。 | 4.0%。 | 4.9%。 |
| 下 ⁇ 。 | 7.8%。 | 9.8%。 | 19.2%。 | 7.9%。 | 14.7%。 |
| 口渇。 | 2.0%。 | 10.8%。 | 18.3%。 | 15.8%。 | 20.6%。 |
| 吐き気。 | 13.7%。 | 14.7%。 | 26.9%。 | 34.7%。 | 36.3%。 |
| 神経系。 | |||||
| 不安。 | 0.0%。 | 2.0%。 | 5.8%。 | 5.9%。 | 5.9%。 |
| めまい。 | 3.9%。 | 6.9%。 | 6.7%。 | 8.9%。 | 12.7%。 |
| 緊張。 | 0.0%。 | 5.9%。 | 5.8%。 | 4.0%。 | 2.9%。 |
| 感覚異常。 | 0.0%。 | 2.9%。 | 1.0%。 | 5.0%。 | 5.9%。 |
| 傾眠。 | 7.8%。 | 12.7%。 | 18.3%。 | 20.8%。 | 21.6%。 |
| 振戦。 | 0.0%。 | 0.0%。 | 7.7%。 | 7.9%。 | 14.7%。 |
| 特別感覚。 | |||||
| ぼやけたビジョン。 | 2.0%。 | 2.9%。 | 2.9%。 | 2.0%。 | 7.8%。 |
| ⁇ 尿生殖器系。 | |||||
| 異常な射精。 | 0.0%。 | 5.8%。 | 6.5%。 | 10.6%。 | 13.0%。 |
| インポテンツ。 | 0.0%。 | 1.9%。 | 4.3%。 | 6.4%。 | 1.9%。 |
| 男性性器障害。 | 0.0%。 | 3.8。 | 8.7%。 | 6.4%。 | 3.7%。 |
| *不利な点を含めるためのルール。 表のイベント:パロキセチン群の1つで少なくとも5%の発生率、≥。 少なくとも1つのパロキセチン群のプラセボ発生率の2倍。. | |||||
固定用量の比較。 OCDの治療におけるプラセボとパロキセチン20、40、60 mgはありませんでした。 有害事象とパロキセチンの投与量との明確な関係。 患者が割り当てられました。. パロキセチンで新たな有害事象は観察されなかった。 他の治療グループと比較して60 mgの用量グループ。.
固定用量の比較。 PDの治療におけるプラセボとパロキセチン10、20、40 mgはありませんでした。 有害事象とパロキセチンの投与量との明確な関係。 無力症、口渇、不安、性欲を除いて、患者が割り当てられました。 減少、振戦、異常な射精。. 柔軟な投与量の研究では、新しいものはありません。 比較した60 mgのパロキセチンを投与された患者では有害事象が観察されました。 他の治療グループのいずれかへ。.
固定用量の比較。 GADの治療におけるプラセボと20および40 mgのパロキセチン。 有害事象、有害事象との明確な関係はありませんでした。 以下を除いて、患者が割り当てられたパロキセチンの用量。 有害事象:無力症、便秘、異常な射精。.
柔軟な線量研究では、いいえ。 パロキセチン60 mgを投与された患者では、新しい有害事象が観察されました。 他の治療グループと比較。.
特定のものへの適応。 有害事象。: 4〜6週間にわたって、適応の証拠がありました。 治療を継続したいくつかの有害事象(例:吐き気とめまい)に対して、しかし。 他の効果(口渇、傾眠、無力症など)にはあまり影響しません。.
男性と女性の性的。 SSRIの機能不全。: 性的欲求、性的パフォーマンス、およびの変化。 性的満足はしばしば精神障害の症状として発生します。 それらはまた、薬理学的治療の結果である可能性があります。. 特に、いくつか。 証拠は、SSRIがそのような厄介な性的経験を引き起こす可能性があることを示唆しています。.
の信頼できる推定。 性的欲求を含む不都合な経験の発生率と重症度。 ただし、一部にはパフォーマンスと満足度を得ることが困難です。 患者と医師はそれらについて話し合うことに消極的かもしれません。. したがって、。 引用された不都合な性的経験とパフォーマンスの発生率の推定。 製品のラベル付けでは、実際の発生率を過小評価する可能性があります。.
プラセボ対照臨床。 報告された発生率の範囲を3200人以上の患者が含む試験。 MDD、OCD、PD、社会不安を伴う男性と女性の性的副作用の。 障害、GAD、および心的外傷後ストレス障害(PTSD)を表6に示します。.
表6:の発生率。
制御された臨床試験における性的有害事象。
| パロキセチン。 | プラセボ。 | |
| n(男性)。 | 1446。 | 1042。 |
| リビドの減少。 | 6%-15%。 | 0%-5%。 |
| 射精障害。 | 13%-28%。 | 0%-2%。 |
| インポテンツ。 | 2%-9%。 | 0%-3%。 |
| n(女性)。 | 1822年。 | 1340。 |
| リビドの減少。 | 0%-9%。 | 0%-2%。 |
| オルガスム乱れ。 | 2%-9%。 | 0%-1%。 |
十分ではありません。 パロキセチン治療による性機能障害を調査するよく管理された研究。.
パロキセチン治療はされています。 持続勃起症のいくつかのケースに関連付けられています。. 既知の結果を持つそれらの場合、 患者は後遺症なしで回復した。.
知るのは難しいですが。 SSRIの使用に関連する性機能障害の正確なリスク。 医師は、そのような考えられる副作用について定期的に問い合わせる必要があります。.
重量とバイタルサイン。 変更。: 大幅な減量は、 一部の患者に対するパロキセチンによる治療の望ましくない結果。 平均して、対照試験の患者の体重減少は最小限(約1ポンド)でした。 プラセボとアクティブコントロールの小さな変化。. 大きな変化はありません。 バイタルサイン(収縮期および拡張期の血圧、脈拍、および温度)。 制御された臨床でパロキセチンで治療された患者で観察されました。 試験。.
ECGの変更。: で得られたECGの分析。 パロキセチンで治療された682人の患者とプラセボで治療された415人の患者。 対照臨床試験では、臨床的に有意な変化は見られませんでした。 いずれかのグループのECG。.
肝機能検査。: プラセボ対照。 臨床試験では、パロキセチンで治療された患者は異常な値を示しました。 肝機能検査は、プラセボ治療で見られる以上の割合ではありません。 患者。. 特に、アルカリ性のパロキセチン対プラセボの比較。 ホスファターゼ、SGOT、SGPT、ビリルビンには違いはありませんでした。 異常が著しい患者の割合。.
幻覚。: のプールされた臨床試験で。 即時放出塩酸パロキセチン、幻覚は22で観察されました。 薬物を受けている9089人の患者とプラセボを受けている3187人の患者のうち4人。.
のプレマーケティング評価中に観察されたその他のイベント。 パロキセチン。
MDDでの市販前評価中に、複数回投与。 パロキセチンのうち、フェーズ2および3の研究で6145人の患者に投与されました。. 。 パロキセチンへの暴露の条件と期間は大きく異なり、含まれています。 (重複するカテゴリー)オープンおよび二重盲検の研究、制御されていないおよび。 対照研究、入院および外来研究、固定用量および。 滴定研究。. OCD、PD、およびGADでの市販前臨床試験中。 542、469、および735人の患者は、それぞれ複数回投与されました。 パロキセチン。. この暴露に関連する不都合な出来事は、によって記録されました。 臨床研究者は、自分で選択した用語を使用しています。. その結果、。 の割合の意味のある見積もりを提供することはできません。 最初に同様のタイプをグループ化せずに有害事象を経験している個人。 少数の標準化されたイベントカテゴリへの不都合なイベント。.
以下の表では、有害事象が報告されています。 標準のCOSTARTベースの辞書用語を使用して分類されました。. 。 したがって、提示された頻度は9089人の患者の割合を表します。 タイプのイベントを経験したパロキセチンの複数回投与に曝された。 パロキセチンを受けている間に少なくとも1回は引用。. 報告されたすべてのイベント。 表2から4にすでにリストされているもの、報告されているものを除いて含まれています。 有益ではないほど一般的な用語、および薬物が引き起こすイベント。 リモートでした。.
イベントにもかかわらず、それを強調することが重要です。 報告されたのはパロキセチンによる治療中に発生しましたが、必ずしもそうではありませんでした。 それによって引き起こされます。.
イベントはさらにボディシステムによって分類され、リストされます。 減少順に。
妊娠カテゴリーD (参照。 警告。 - 使用法。 妊娠中。: 催奇形性と非催奇形性の影響。).
治療の中止に関連。
治療を受けた患者の20%(1199/6145)。 MDDの世界的な臨床試験におけるパロキセチン、11.8%(64/542)、9.4%。 (44/469)、および世界中でパロキセチンで治療された患者の10.7%(79/735)。 OCD、PD、およびGADでの試験は、それぞれのために治療を中止しました。 有害事象。. 関連する最も一般的なイベント(≥1%)。 中止および薬物関連であると見なされます(つまり、関連するイベント)。 比較すると、パロキセチンの約2倍以上の割合で脱落します。 プラセボへ)以下が含まれています:。
| MDD。 | OCD。 | PD | GAD。 | |||||
| パロキセチン。 | プラセボ。 | パロキセチン。 | プラセボ。 | パロキセチン。 | プラセボ。 | パロキセチン。 | プラセボ。 | |
| CNS。 | ||||||||
| 傾眠。 | 2.3%。 | 0.7%。 | - | - | 1.9%。 | 0.3%。 | 2.0%。 | 0.2%。 |
| 不眠症。 | - | - | 1.7%。 | 0% | 1.3%。 | 0.3%。 | - | - |
| 興奮。 | 1.1%。 | 0.5%。 | - | - | - | - | - | - |
| 振戦。 | 1.1%。 | 0.3%。 | - | |||||
| めまい。 | - | - | 1.5%。 | 0% | - | - | 1.0%。 | 0.2%。 |
| 消化器。 | ||||||||
| 便秘。 | - | - | 1.1%。 | 0% | - | - | - | - |
| 吐き気。 | 3.2%。 | 1.1%。 | 1.9%。 | 0% | 3.2%。 | 1.2%。 | 2.0%。 | 0.2%。 |
| 下 ⁇ 。 | 1.0%。 | 0.3%。 | - | - | - | - | - | - |
| 口渇。 | 1.0%。 | 0.3%。 | - | - | - | - | - | - |
| ⁇ 吐。 | 1.0%。 | 0.3%。 | - | - | - | - | - | - |
| その他。 | ||||||||
| 無力症。 | 1.6%。 | 0.4%。 | 1.9%。 | 0.4%。 | - | - | 1.8%。 | 0.2%。 |
| 異常。 | 1.6%。 | 0% | 2.1%。 | 0% | - | - | 2.5%。 | 0.5%。 |
| 射精。1 | ||||||||
| 発汗。 | 1.0%。 | 0.3%。 | - | - | - | - | 1.1%。 | 0.2%。 |
| インポテンツ。1 | - | - | 1.5%。 | 0% | - | - | - | - |
| 数値が提供されていない場合、発生率。
パロキセチンで治療された患者の有害事象は1%以下であったか、またはそうではありませんでした。
プラセボの発生率の2倍以上。. 1 性別で修正された発生率。. |
||||||||
一般的に観察される有害事象。
大うつ病性障害。
最も一般的に観察されます。 パロキセチンの使用に関連する有害事象(5%の発生率または 得られたプラセボの2倍以上のパロキセチンの発生率。 以下の表2から)は、無力症、発汗、吐き気、食欲低下でした。 傾眠、めまい、不眠症、振戦、緊張、射精障害、 その他の男性性器障害。.
強迫性障害。
最も一般的に観察されます。 パロキセチンの使用に関連する有害事象(5%の発生率または 得られたプラセボの少なくとも2倍のパロキセチンの発生率。 以下の表3から)は、吐き気、口渇、食欲減退、便秘でした。 めまい、傾眠、振戦、発汗、インポテンス、異常な射精。.
パニック障害。
最も一般的に観察されます。 パロキセチンの使用に関連する有害事象(5%の発生率または 得られたプラセボの2倍以上のパロキセチンの発生率。 以下の表3から)は、無力症、発汗、食欲減退、性欲でした。 減少、振戦、異常な射精、女性性器障害、および。 インポテンツ。.
全般性不安障害。
最も一般的に観察されます。 パロキセチンの使用に関連する有害事象(5%の発生率または 得られたプラセボの2倍以上のパロキセチンの発生率。 表4)から:無力症、感染症、便秘、食欲減退、乾燥。 口、吐き気、性欲の低下、傾眠、振戦、発汗、異常。 射精。.
制御された臨床試験の発生率。
処方者は、の数字が 以下の表は、副作用の発生率を予測するために使用できません。 患者の特徴やその他の通常の医療コース。 臨床試験で優勢だった要因とは異なります。. 同様に、 引用された頻度は、他の臨床から得られた数値と比較することはできません。 さまざまな治療、使用、調査員を含む調査。. 。 ただし、引用された数値は、処方医師に何らかの根拠を提供します。 薬物および非薬物要因の相対的な寄与を推定するため。 調査した集団の副作用発生率。.
大うつ病性障害。
表2は、で発生した有害事象を列挙しています。 参加したパロキセチン治療患者の1%以上の発生率。 患者がaで投与された短期(6週間)プラセボ対照試験。 20〜50 mg /日の範囲。. 報告された有害事象はaを使用して分類されました。 標準のCOSTARTベースの辞書用語。.
表2:治療緊急有害経験。
MDDのプラセボ対照臨床試験の発生率。1
| ボディシステム。 | 優先用語。 | パロキセチン。 (n = 421)。 |
プラセボ。 (n = 421)。 |
| 全体としての体。 | 頭痛。 | 18%。 | 17%。 |
| 無力症。 | 15%。 | 6% | |
| 心血管。 | 動 ⁇ 。 | 3% | 1% |
| 血管拡張。 | 3% | 1% | |
| 皮膚科。 | 発汗。 | 11%。 | 2% |
| 発疹。 | 2% | 1% | |
| 消化器。 | 吐き気。 | 26%。 | 9% |
| 口渇。 | 18%。 | 12%。 | |
| 便秘。 | 14%。 | 9% | |
| 下 ⁇ 。 | 12%。 | 8% | |
| 食欲の低下。 | 6% | 2% | |
| ⁇ 腸。 | 4% | 2% | |
| Oropharynx障害。2 | 2% | 0% | |
| 消化不良。 | 2% | 1% | |
| 筋骨格。 | ミオパシー。 | 2% | 1% |
| 筋肉痛。 | 2% | 1% | |
| 筋無力症。 | 1% | 0% | |
| 神経系。 | 傾眠。 | 23%。 | 9% |
| めまい。 | 13%。 | 6% | |
| 不眠症。 | 13%。 | 6% | |
| 振戦。 | 8% | 2% | |
| 緊張。 | 5% | 3% | |
| 不安。 | 5% | 3% | |
| 感覚異常。 | 4% | 2% | |
| リビドーが減少しました。 | 3% | 0% | |
| 薬のような感じ。 | 2% | 1% | |
| 混乱。 | 1% | 0% | |
| 呼吸。 | あくび。 | 4% | 0% |
| 特別感覚。 | ぼやけたビジョン。 | 4% | 1% |
| 変態を味わう。 | 2% | 0% | |
| ⁇ 尿生殖器系。 | 射精障害。3,4。 | 13%。 | 0% |
| その他の男性性器障害。3,5。 | 10%。 | 0% | |
| 尿頻度。 | 3% | 1% | |
| 排尿障害。6 | 3% | 0% | |
| 女性性器障害。3,7。 | 2% | 0% | |
| 1 患者の少なくとも1%が報告したイベント。
パロキセチンで治療されたものが含まれていますが、以下のイベントがありました。
プラセボ≥パロキセチンの発生率:腹痛、興奮、腰痛、
胸痛、CNS刺激、発熱、食欲増進、ミオクローヌス、 ⁇ 頭炎など。
姿勢性低血圧、呼吸障害(主に「風邪の症状」または
「URI」)、トラウマ、 ⁇ 吐。. 2 主に「喉のしこり」と「喉の圧迫感」が含まれます。.」。 3 性別で修正された割合。. 4 主に「射精遅延。.」。 5 「無オルガスム」、「勃起困難」、「遅延」が含まれます。 射精/ ⁇ 覚」、「性機能障害」、「インポテンス。.」。 6 主に「排尿困難」と「尿」が含まれます。 ためらい。.」。 7 主に「無オルガスム」と「到達困難」を含みます。 クライマックス/オルガスム。.」。 |
強迫性障害そして。 パニック障害。
表3は、不利益を列挙しています。 オン中のOCD患者の間で2%以上の頻度で発生したイベント。 12週間のプラセボ対照試験に参加したパロキセチン。 患者は20〜60 mg /日の範囲で、または患者の間で投与されました。 10対のプラセボ対照試験に参加したパロキセチンのPD。 患者が10〜60 mg /日の範囲で投与された12週間の期間。.
表3:トリートメント緊急。
プラセボ対照臨床試験における有害経験の発生率。
強迫性障害およびパニック障害。1
| ボディシステム。 | 優先用語。 | 強迫性障害。 | パニック障害。 | ||
| パロキセチン。 (n = 542)。 |
プラセボ。 (n = 265)。 |
パロキセチン。 (n = 469)。 |
プラセボ。 (n = 324)。 |
||
| 全体としての体。 | 無力症。 | 22%。 | 14%。 | 14%。 | 5% |
| 腹痛。 | - | - | 4% | 3% | |
| 胸の痛み。 | 3% | 2% | - | - | |
| 背中の痛み。 | - | - | 3% | 2% | |
| 悪寒。 | 2% | 1% | 2% | 1% | |
| 心血管。 | 血管拡張。 | 4% | 1% | - | - |
| 動 ⁇ 。 | 2% | 0% | - | - | |
| 皮膚科。 | 発汗。 | 9% | 3% | 14%。 | 6% |
| 発疹。 | 3% | 2% | - | - | |
| 消化器。 | 吐き気。 | 23%。 | 10%。 | 23%。 | 17%。 |
| 口渇。 | 18%。 | 9% | 18%。 | 11%。 | |
| 便秘。 | 16%。 | 6% | 8% | 5% | |
| 下 ⁇ 。 | 10%。 | 10%。 | 12%。 | 7% | |
| 食欲の低下。 | 9% | 3% | 7% | 3% | |
| 食欲の増加。 | 4% | 3% | 2% | 1% | |
| 神経系。 | 不眠症。 | 24%。 | 13%。 | 18%。 | 10%。 |
| 傾眠。 | 24%。 | 7% | 19%。 | 11%。 | |
| めまい。 | 12%。 | 6% | 14%。 | 10%。 | |
| 振戦。 | 11%。 | 1% | 9% | 1% | |
| 緊張。 | 9% | 8% | - | - | |
| リビドーが減少しました。 | 7% | 4% | 9% | 1% | |
| 興奮。 | - | - | 5% | 4% | |
| 不安。 | - | - | 5% | 4% | |
| 異常な夢。 | 4% | 1% | - | - | |
| 濃度障害。 | 3% | 2% | - | - | |
| 離人。 | 3% | 0% | - | - | |
| ミオクローヌス。 | 3% | 0% | 3% | 2% | |
| 健忘症。 | 2% | 1% | - | - | |
| 呼吸器系。 | 鼻炎。 | - | - | 3% | 0% |
| 特別感覚。 | 異常なビジョン。 | 4% | 2% | - | - |
| 変態を味わう。 | 2% | 0% | - | - | |
| ⁇ 尿生殖器系。 | 異常な射精。2 | 23%。 | 1% | 21%。 | 1% |
| 女性性器障害。2 | 3% | 0% | 9% | 1% | |
| インポテンツ。2 | 8% | 1% | 5% | 0% | |
| 尿頻度。 | 3% | 1% | 2% | 0% | |
| 排尿障害。 | 3% | 0% | - | - | |
| 尿路感染症。 | 2% | 1% | 2% | 1% | |
| 1 OCDまたはPDの少なくとも2%によって報告されたイベント。
プラセボ≥パロキセチン[OCD]で発生した以下のイベントを除いて、パロキセチン治療患者が含まれています。
腹痛、興奮、不安、腰痛、咳の増加、うつ病、
頭痛、運動過多、感染症、感覚異常、 ⁇ 頭炎、呼吸器。
障害、鼻炎、副鼻腔炎。. [PD]:異常な夢、異常なビジョン、。
胸の痛み、咳の増加、離人、うつ病、月経困難症、
消化不良、インフルエンザ症候群、頭痛、感染症、筋肉痛、緊張、
動 ⁇ 、知覚異常、 ⁇ 頭炎、発疹、呼吸器疾患、副鼻腔炎。
味覚異常、外傷、排尿障害、血管拡張。. 2 性別で修正された割合。. |
全般性不安障害。
表4は、aで発生した有害事象を列挙しています。 参加したパロキセチンのGAD患者の2%以上の頻度。 患者がaで投与された8週間の期間のプラセボ対照試験。 10 mg /日から50 mg /日の範囲。.
表4:治療緊急有害経験。
全般性不安のプラセボ対照臨床試験の発生率。
障害。1
| ボディシステム。 | 優先用語。 | パロキセチン。 (n = 735)。 |
プラセボ。 (n = 529)。 |
| 全体としての体。 | 無力症。 | 14%。 | 6% |
| 頭痛。 | 17%。 | 14%。 | |
| 感染。 | 6% | 3% | |
| 心血管。 | 血管拡張。 | 3% | 1% |
| 皮膚科。 | 発汗。 | 6% | 2% |
| 消化器。 | 吐き気。 | 20%。 | 5% |
| 口渇。 | 11%。 | 5% | |
| 便秘。 | 10%。 | 2% | |
| 下 ⁇ 。 | 9% | 7% | |
| 食欲の低下。 | 5% | 1% | |
| ⁇ 吐。 | 3% | 2% | |
| 神経系。 | 不眠症。 | 11%。 | 8% |
| 傾眠。 | 15%。 | 5% | |
| めまい。 | 6% | 5% | |
| 振戦。 | 5% | 1% | |
| 緊張。 | 4% | 3% | |
| リビドーが減少しました。 | 9% | 2% | |
| 呼吸器系。 | 呼吸器疾患。 | 7% | 5% |
| 副鼻腔炎。 | 4% | 3% | |
| あくび。 | 4% | - | |
| 特別感覚。 | 異常なビジョン。 | 2% | 1% |
| ⁇ 尿生殖器系。 | 異常な射精。2 | 25%。 | 2% |
| 女性性器。2 | 4% | 1% | |
| 無力無力。2 | 4% | 3% | |
| 1 GADの少なくとも2%が報告したイベント。
以下のイベントを除いて、パロキセチンで治療された患者が含まれています。
プラセボ≥パロキセチンで発生した:腹痛、背中。
痛み、外傷、消化不良、筋肉痛、 ⁇ 頭炎。. 2 性別で修正された割合。. |
有害事象の用量依存性。
有害事象の比較。 パロキセチン10、20、30、および40 mg /日を比較した固定用量試験の率。 MDDの治療におけるプラセボは、一部の明確な用量依存性を明らかにしました。 に示されているように、パロキセチンの使用に関連するより一般的な有害事象。 次の表:。
表5:治療緊急。
治療における用量比較試験における有害経験の発生率。
MDD *。
| ボディシステム/優先用語。 | プラセボ。 n = 51。 |
パロキセチン。 | |||
| 10 mg。 n = 102。 |
20 mg。 n = 104。 |
30 mg。 n = 101。 |
40 mg。 n = 102。 |
||
| 全体としての体。 | |||||
| 無力症。 | 0.0%。 | 2.9%。 | 10.6%。 | 13.9%。 | 12.7%。 |
| 皮膚科。 | |||||
| 発汗。 | 2.0%。 | 1.0%。 | 6.7%。 | 8.9%。 | 11.8%。 |
| 消化器。 | |||||
| 便秘。 | 5.9%。 | 4.9%。 | 7.7%。 | 9.9%。 | 12.7%。 |
| 食欲の低下。 | 2.0%。 | 2.0%。 | 5.8%。 | 4.0%。 | 4.9%。 |
| 下 ⁇ 。 | 7.8%。 | 9.8%。 | 19.2%。 | 7.9%。 | 14.7%。 |
| 口渇。 | 2.0%。 | 10.8%。 | 18.3%。 | 15.8%。 | 20.6%。 |
| 吐き気。 | 13.7%。 | 14.7%。 | 26.9%。 | 34.7%。 | 36.3%。 |
| 神経系。 | |||||
| 不安。 | 0.0%。 | 2.0%。 | 5.8%。 | 5.9%。 | 5.9%。 |
| めまい。 | 3.9%。 | 6.9%。 | 6.7%。 | 8.9%。 | 12.7%。 |
| 緊張。 | 0.0%。 | 5.9%。 | 5.8%。 | 4.0%。 | 2.9%。 |
| 感覚異常。 | 0.0%。 | 2.9%。 | 1.0%。 | 5.0%。 | 5.9%。 |
| 傾眠。 | 7.8%。 | 12.7%。 | 18.3%。 | 20.8%。 | 21.6%。 |
| 振戦。 | 0.0%。 | 0.0%。 | 7.7%。 | 7.9%。 | 14.7%。 |
| 特別感覚。 | |||||
| ぼやけたビジョン。 | 2.0%。 | 2.9%。 | 2.9%。 | 2.0%。 | 7.8%。 |
| ⁇ 尿生殖器系。 | |||||
| 異常な射精。 | 0.0%。 | 5.8%。 | 6.5%。 | 10.6%。 | 13.0%。 |
| インポテンツ。 | 0.0%。 | 1.9%。 | 4.3%。 | 6.4%。 | 1.9%。 |
| 男性性器障害。 | 0.0%。 | 3.8。 | 8.7%。 | 6.4%。 | 3.7%。 |
| *不利な点を含めるためのルール。 表のイベント:パロキセチン群の1つで少なくとも5%の発生率、≥。 少なくとも1つのパロキセチン群のプラセボ発生率の2倍。. | |||||
固定用量の比較。 OCDの治療におけるプラセボとパロキセチン20、40、60 mgはありませんでした。 有害事象とパロキセチンの投与量との明確な関係。 患者が割り当てられました。. パロキセチンで新たな有害事象は観察されなかった。 他の治療グループと比較して60 mgの用量グループ。.
固定用量の比較。 PDの治療におけるプラセボとパロキセチン10、20、40 mgはありませんでした。 有害事象とパロキセチンの投与量との明確な関係。 無力症、口渇、不安、性欲を除いて、患者が割り当てられました。 減少、振戦、異常な射精。. 柔軟な投与量の研究では、新しいものはありません。 比較した60 mgのパロキセチンを投与された患者では有害事象が観察されました。 他の治療グループのいずれかへ。.
固定用量の比較。 GADの治療におけるプラセボと20および40 mgのパロキセチン。 有害事象、有害事象との明確な関係はありませんでした。 以下を除いて、患者が割り当てられたパロキセチンの用量。 有害事象:無力症、便秘、異常な射精。.
柔軟な線量研究では、いいえ。 パロキセチン60 mgを投与された患者では、新しい有害事象が観察されました。 他の治療グループと比較。.
特定のものへの適応。 有害事象。: 4〜6週間にわたって、適応の証拠がありました。 治療を継続したいくつかの有害事象(例:吐き気とめまい)に対して、しかし。 他の効果(口渇、傾眠、無力症など)にはあまり影響しません。.
男性と女性の性的。 SSRIの機能不全。: 性的欲求、性的パフォーマンス、およびの変化。 性的満足はしばしば精神障害の症状として発生します。 それらはまた、薬理学的治療の結果である可能性があります。. 特に、いくつか。 証拠は、SSRIがそのような厄介な性的経験を引き起こす可能性があることを示唆しています。.
の信頼できる推定。 性的欲求を含む不都合な経験の発生率と重症度。 ただし、一部にはパフォーマンスと満足度を得ることが困難です。 患者と医師はそれらについて話し合うことに消極的かもしれません。. したがって、。 引用された不都合な性的経験とパフォーマンスの発生率の推定。 製品のラベル付けでは、実際の発生率を過小評価する可能性があります。.
プラセボ対照臨床。 報告された発生率の範囲を3200人以上の患者が含む試験。 MDD、OCD、PD、社会不安を伴う男性と女性の性的副作用の。 障害、GAD、および心的外傷後ストレス障害(PTSD)を表6に示します。.
表6:の発生率。
制御された臨床試験における性的有害事象。
| パロキセチン。 | プラセボ。 | |
| n(男性)。 | 1446。 | 1042。 |
| リビドの減少。 | 6%-15%。 | 0%-5%。 |
| 射精障害。 | 13%-28%。 | 0%-2%。 |
| インポテンツ。 | 2%-9%。 | 0%-3%。 |
| n(女性)。 | 1822年。 | 1340。 |
| リビドの減少。 | 0%-9%。 | 0%-2%。 |
| オルガスム乱れ。 | 2%-9%。 | 0%-1%。 |
十分ではありません。 パロキセチン治療による性機能障害を調査するよく管理された研究。.
パロキセチン治療はされています。 持続勃起症のいくつかのケースに関連付けられています。. 既知の結果を持つそれらの場合、 患者は後遺症なしで回復した。.
知るのは難しいですが。 SSRIの使用に関連する性機能障害の正確なリスク。 医師は、そのような考えられる副作用について定期的に問い合わせる必要があります。.
重量とバイタルサイン。 変更。: 大幅な減量は、 一部の患者に対するパロキセチンによる治療の望ましくない結果。 平均して、対照試験の患者の体重減少は最小限(約1ポンド)でした。 プラセボとアクティブコントロールの小さな変化。. 大きな変化はありません。 バイタルサイン(収縮期および拡張期の血圧、脈拍、および温度)。 制御された臨床でパロキセチンで治療された患者で観察されました。 試験。.
ECGの変更。: で得られたECGの分析。 パロキセチンで治療された682人の患者とプラセボで治療された415人の患者。 対照臨床試験では、臨床的に有意な変化は見られませんでした。 いずれかのグループのECG。.
肝機能検査。: プラセボ対照。 臨床試験では、パロキセチンで治療された患者は異常な値を示しました。 肝機能検査は、プラセボ治療で見られる以上の割合ではありません。 患者。. 特に、アルカリ性のパロキセチン対プラセボの比較。 ホスファターゼ、SGOT、SGPT、ビリルビンには違いはありませんでした。 異常が著しい患者の割合。.
幻覚。: のプールされた臨床試験で。 即時放出塩酸パロキセチン、幻覚は22で観察されました。 薬物を受けている9089人の患者とプラセボを受けている3187人の患者のうち4人。.
のプレマーケティング評価中に観察されたその他のイベント。 パロキセチン。
MDDでの市販前評価中に、複数回投与。 パロキセチンのうち、フェーズ2および3の研究で6145人の患者に投与されました。. 。 パロキセチンへの暴露の条件と期間は大きく異なり、含まれています。 (重複するカテゴリー)オープンおよび二重盲検の研究、制御されていないおよび。 対照研究、入院および外来研究、固定用量および。 滴定研究。. OCD、PD、およびGADでの市販前臨床試験中。 542、469、および735人の患者は、それぞれ複数回投与されました。 パロキセチン。. この暴露に関連する不都合な出来事は、によって記録されました。 臨床研究者は、自分で選択した用語を使用しています。. その結果、。 の割合の意味のある見積もりを提供することはできません。 最初に同様のタイプをグループ化せずに有害事象を経験している個人。 少数の標準化されたイベントカテゴリへの不都合なイベント。.
以下の表では、有害事象が報告されています。 標準のCOSTARTベースの辞書用語を使用して分類されました。. 。 したがって、提示された頻度は9089人の患者の割合を表します。 タイプのイベントを経験したパロキセチンの複数回投与に曝された。 パロキセチンを受けている間に少なくとも1回は引用。. 報告されたすべてのイベント。 表2から4にすでにリストされているもの、報告されているものを除いて含まれています。 有益ではないほど一般的な用語、および薬物が引き起こすイベント。 リモートでした。.
イベントにもかかわらず、それを強調することが重要です。 報告されたのはパロキセチンによる治療中に発生しましたが、必ずしもそうではありませんでした。 それによって引き起こされます。.
イベントはさらにボディシステムによって分類され、リストされます。 に従って頻度が減少する順に。
人間の経験。
米国でのパロキセチンの導入以来、342。 パロキセチン中の故意または偶発的な過剰摂取の自然発生的な症例。 治療は世界中で報告されています(1999年頃)。. これらには過剰摂取が含まれます。 パロキセチン単独および他の物質との併用。. これらのうち、48。 症例は致命的であり、死亡者のうち17人はパロキセチンを伴うようであった。 一人で。. 摂取したパロキセチンの量を記録した8つの致命的な症例。 一般に、他の薬物やアルコールの摂取によって混乱しました。 重要な併存疾患の存在。. 既知の145の非致命的なケースのうち。 結果、ほとんどが後遺症なしで回復した。. 関与する最大の既知の摂取。 2000 mgのパロキセチン(最大推奨日用量の33倍)。 回復した患者。.
に関連する一般的に報告された有害事象。 パロキセチンの過剰摂取には、傾眠、 ⁇ 睡、吐き気、振戦、頻脈などがあります。 混乱、 ⁇ 吐、めまい。. その他の注目すべき兆候と症状が観察されました。 パロキセチンを含む過剰摂取(単独または他の物質を含む)には、散 ⁇ が含まれます。 けいれん(てんかんを含む)、心室性不整脈(含む。 トルサードドポワント)、高血圧、攻撃的な反応、失神、低血圧、 ⁇ 迷、徐脈、ジストニア、横紋筋融解症、肝機能障害の症状。 (肝不全、肝壊死、黄 ⁇ 、肝炎、および肝を含む。 脂肪症)、セロトニン症候群、 ⁇ 反応、ミオクローヌス、急性腎。 失敗、および尿閉。.
過剰摂取管理。
パロキセチンの特定の解毒剤は知られていない。. 治療。 の管理に採用されている一般的な対策で構成する必要があります。 MDDの治療に有効な薬物の過剰摂取。
適切な気道、酸素化、換気を確保します。. 心臓のリズムとバイタルサインを監視します。. 一般的な支持的で症状のある。 対策もお勧めします。. ⁇ 吐の誘発は推奨されません。.
この薬の分布が大量にあるため、 強制利尿、透析、 ⁇ 流、および交換輸血はありそうにありません。 利益になること。.
特定の注意には、服用している、または服用している患者が含まれます。 最近、過剰な量のaを摂取する可能性のあるパロキセチンを服用しています。 三環系抗うつ薬。. そのような場合、親三環系が蓄積します。 および/または活性代謝物は、臨床的に重要な可能性を高める可能性があります。 sequelaeと綿密な医学的観察に必要な時間を延長します(参照。 薬物。 予防措置の下でチトクロームCYP2D6によって代謝されます。).
過剰摂取の管理では、その可能性を検討してください。 複数の薬物関与。. 医師は毒との接触を検討する必要があります。 過剰摂取の治療に関する追加情報のためのコントロールセンター。. 認定された毒物管理センターの電話番号は、医師に記載されています。 デスクリファレンス(PDR)。.
MDD、OCDの治療におけるパロキセチンの有効性。 パニック障害(PD)、および全般性不安障害(GAD)が推定されます。 中枢神経系におけるセロトニン作動性の増強に関連している。 セロトニンの神経再取り込みの阻害から生じる。 (5-ヒドロキシトリプタミン、5-HT)。. ヒトの臨床的に関連する用量での研究。 パロキセチンがセロトニンのヒトへの取り込みをブロックすることを実証しました。 血小板。. In vitro。 動物での研究はまた、パロキセチンが強力であることを示唆しています。 そして神経セロトニン再取り込みの非常に選択的な阻害剤であり、非常にしかありません。 ノルエピネフリンとドーパミン神経再取り込みに対する弱い影響。. In vitro。 放射性リガンド。 結合研究は、パロキセチンがムスカリンに対してほとんど親和性がないことを示しています。 alpha1-、alpha2-、β-アドレナリン作動性-、ドーパミン(D2)-、5-HT1-、5-HT2-、および。 ヒスタミン(H1)受容体;ムスカリン、ヒスタミン作動性、およびの ⁇ 抗作用。 alpha1-アドレナリン受容体は、さまざまな抗コリン作用と関連しています。 他の向精神薬の鎮静効果と心血管効果。.
パロキセチンのメジャーの相対的な効力があるからです。 代謝物は親化合物の最大1/50であり、本質的にそうです。 非アクティブ。.
メシル酸パロキセチンは経口後に完全に吸収されます。 メシル酸塩の投与。. 正常な男性被験者(n = 25)の研究。 24日間毎日パロキセチン30 mg錠剤を投与された、定常状態のパロキセチン。 濃度はほとんどの被験者で約13日で達成されました。 時折の患者ではかなり長くかかる場合があります。. 着実に。 Cmax、Tmax、Cmin、およびT½の状態、平均値は81.3 ng / ml(CV 41%)、8.1でした。 hr。. (CV 56%)、43.2 ng / ml(CV 52%)、および33.2時間。. (CV 52%)、それぞれ。. 。 定常状態のCmaxとCminの値は、約7倍と10倍でした。 単回投与試験から予測。. AUC0-24に基づく定常状態の薬物曝露。 単回投与データから予測されたよりも約10倍大きかった。 これらの主題で。. 過剰な蓄積は、その事実の結果です。 パロキセチンを代謝する酵素の1つは容易に飽和します。.
関与する定常状態の線量比例試験。 高齢者および非高齢患者、高齢者向けに毎日20〜40 mgの用量。 高齢者には毎日20〜50 mgの単線性が観察されました。 両方の集団、再び飽和可能な代謝経路を反映しています。. 比較すると。 1日20 mg後のCmin値まで、40 mg後の値は約2〜3でした。 倍より倍大きい。.
パロキセチンのバイオアベイラビリティに対する食品の影響。 食事の有無にかかわらず単回投与された被験者で研究されました。. AUC。 薬物が食物と一緒に投与されたとき、わずかに増加した(6%)がCmaxでした。 ピーク血漿濃度に達するまでの時間は減少しましたが、29%増加しました。 投与後6.4時間から4.9時間まで。.
パロキセチンは経口後に広範囲に代謝されます。 管理。. 主要な代謝産物は、極性で共役した製品です。 酸化とメチル化。これらは容易に除去されます。. 共役。 グルクロン酸と硫酸塩が優勢であり、主要な代謝産物が主流となっています。 分離され、識別されます。. データは、代謝物がそれ以上ないことを示しています。 セロトニンの取り込みを阻害する際の親化合物の効力1/50。. 。 パロキセチンの代謝は、チトクロームCYP2D6によって部分的に達成されます。. 臨床用量でのこの酵素の飽和は、 用量の増加と増加に伴うパロキセチン動態の非線形性。 治療期間。. パロキセチン代謝におけるこの酵素の役割も。 潜在的な薬物間相互作用を示唆しています(参照。 注意。).
30 mgの経口溶液投与量の約64%。 パロキセチンは、親化合物として2%、親化合物として62%で尿中に排 ⁇ されました。 投与後10日間の代謝物。. 約36%が排 ⁇ されました。 ⁇ 便(おそらく胆 ⁇ を介して)、主に代謝物として、1%未満。 投与後10日間の親化合物。.
で行われた4つの研究からのパロキセチンのメタ分析で。 男性、20 mg /日から40 mg /日の複数回投与後の健康なボランティア。 女性よりも大幅に低いCmaxまたはAUCを示さなかった。.
分布。
パロキセチンは、体を含む体全体に分布します。 CNS、血漿中に残っているのはわずか1%。.
タンパク質結合。
パロキセチンの約95%と93%が結合しています。 血漿タンパク質はそれぞれ100 ng / mlおよび400 ng / mlです。. 臨床中。 条件、パロキセチン濃度は通常400 ng / ml未満です。. パロキセチンは変化しません。 in vitro。 フェニトインのタンパク質結合または。 ワルファリン。.
腎および肝疾患。
パロキセチンの血漿濃度の上昇が起こります。 腎機能障害および肝機能障害のある被験者。. 中の平均血漿濃度。 クレアチニンクリアランスが30 ml / min未満の患者は約4倍でした。 通常のボランティアで見られるよりも大きい。. クレアチニンクリアランスの患者。 30〜60 ml / minと肝機能障害のある患者は約aでした。 血漿中濃度が2倍に増加(AUC、Cmax)。.
したがって、初期投与量を減らす必要があります。 重度の腎機能障害または肝機能障害、および上方滴定(ある場合)の患者。 必要に応じて、間隔をあけて行う必要があります(参照)。 投与量と投与。).
高齢患者。
毎日の高齢者の複数回投与試験。 20、30、40 mgのパロキセチン投与量、Cmin濃度は約70%でした。 高齢でない被験者のそれぞれのCmin濃度より80%高い。. したがって、高齢者の初期投与量を減らす必要があります(参照。 投薬。 そして管理。).


