
Komposition:
Anwendung:
Wird bei der Behandlung verwendet:
Medizinisch geprüft von Oliinyk Elizabeth Ivanovna, Apotheke Zuletzt aktualisiert am 26.06.2023

Achtung! Die Informationen auf der Seite sind nur für medizinisches Fachpersonal! Die Informationen werden in öffentlichen Quellen gesammelt und können aussagekräftige Fehler enthalten! Seien Sie vorsichtig und überprüfen Sie alle Informationen auf dieser Seite!


Darreichungsformen Und Stärken
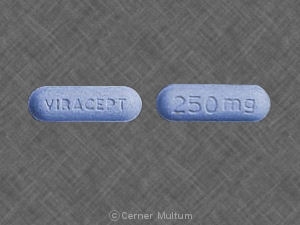
Viracept 250 mg Tablette: hellblau, kapselförmig Tabletten mit einer klaren filmbeschichtung graviert mit “VIRACEPT” auf einer Seite und “250 mg” auf der anderen Seite.
VIRACEPT 625 mg Tablette: Weiße Ovale Tablette mit einem klaren filmbeschichtung graviert mit “V” auf einer Seite und “625” auf der andere.
Viracept Pulver zum Einnehmen: Off-white Pulver mit 50 mg (als nelfinavir - freie Basis) in jeder Ebene scoopful (1 Gramm).
Lagerung Und Handhabung
VIRACEPT (nelfinavir mesylate) 250 mg: hellblaue, kapselförmige Tabletten mit klarem filmüberzug. mit “VIRACEPT” auf einer Seite und “250 mg” auf der anderen Seite.
Flaschen mit 300 (250 mg) Tabletten – NDR 63010-010-30
VIRACEPT (nelfinavir mesylate) 625 mg: Weiße Ovale Tablette mit einer klaren filmbeschichtung graviert mit “V” auf einer Seite und “625” auf der anderen Seite.
Flaschen mit 120 (625 mg) Tabletten – NDR 63010-027-70
VIRACEPT (nelfinavir mesylate) Pulver zum einnehmen ist als 50 mg/g Off-white-Pulver mit 50 mg (als nelfinavir freie Basis) in jeder Ebene scoopful (1 Gramm).
Mehrere Flaschen verwenden von 144 Gramm Pulver mit Schaufel …â€/.NDR 63010-011-90
VIRACEPT-Tabletten und oral Pulver sollte bei 15 gelagert werden° bis 30°C (59° bis 86°F).
Behälter dicht verschlossen Halten. Im Originalbehälter abgeben.
vertrieben Von: ViiV Healthcare Unternehmen, Research Triangle Park, NC 27709. Überarbeitet: März 2015

VIRACEPT in Kombination mit anderen antiretroviralen Mitteln ist zur Behandlung von HIV-1-Infektionen indiziert.

Erwachsene Und Jugendliche (Ab 13 Jahren)
Die empfohlene Dosis beträgt 1250 mg (fünf 250-mg-Tabletten oder zwei 625 mg Tabletten) zweimal täglich oder 750 mg (drei 250 mg Tabletten) dreimal täglich täglich. VIRACEPT sollte mit einer Mahlzeit eingenommen werden. Patienten können die 250 nicht schlucken oder 625 mg Tabletten können die Tabletten in einer kleinen Menge Wasser auflösen.
Pädiatrische Patienten (2 bis Unter 13 Jahre)
Bei Kindern ab 2 Jahren wird die empfohlene die orale Dosis von viracept Pulver zum Einnehmen oder 250 mg Tabletten beträgt 45 bis 55 mg / kg zweimal täglich oder 25 bis 35 mg/kg dreimal täglich. Alle Dosen sollten mit einem Mahlzeit. Dosen, die höher sind als die maximale Dosis für Erwachsene von 2500 mg pro Tag, wurden nicht studierte bei Kindern.
Für Kinder, die keine Tabletten schlucken können, viracept 250 mg Tablette (N) kann in einer kleinen Menge Wasser oder viracept Pulver zum Einnehmen gelöst werden kann verabreicht werden.
Der Gesundheitsdienstleister sollte angemessen beurteilen Formulierung und Dosierung für jeden Patienten. Die Tabellen 1 und 2 bieten Dosierung Richtlinien für VIRACEPT Tabletten und Pulver basierend auf Alter und Körpergewicht.max.0 < 10.5 10 2½ 6 1½ 10.max.
viracept Pulver zum Einnehmen
- viracept Pulver zum Einnehmen mit etwas Wasser Mischen, Milch, Formel, Soja-Formel, Sojamilch oder Nahrungsergänzungsmittel
- Einmal gemischt, muss der gesamte Inhalt in der Reihenfolge verbraucht werden um die volle Dosis zu erhalten.
- Wenn die Mischung nicht sofort verbraucht wird, muss es sein unter Kühlung gelagert, die Lagerung darf jedoch 6 Stunden nicht überschreiten.
- Saure Lebensmittel oder Saft (e.g., Orangensaft, Apfelsaft oder apfelsauce) werden nicht zum mischen von viracept Pulver zum Einnehmen empfohlen, da die Kombination kann zu einem bitteren Geschmack führen.
- viracept Pulver zum Einnehmen sollte nicht rekonstituiert werden mit Wasser in seinem ursprünglichen Behälter.
Leberfunktionsstörung
VIRACEPT kann bei Patienten mit leichter Lebererkrankung angewendet werden Beeinträchtigung ohne Dosisanpassung. VIRACEPT sollte nicht bei Patienten angewendet werden mit entweder mittelschwerer oder schwerer leberfunktionsstörung.

Coadministration von VIRACEPT ist kontraindiziert mit Medikamente, die für die clearance stark von CYP3A abhängig sind und für die erhöht sind Plasmakonzentrationen sind mit schwerwiegenden und / oder lebensbedrohlichen anl. Diese Medikamente und andere kontraindizierte Medikamente (die zu reduzierten Wirksamkeit von nelfinavir) sind in Tabelle 3 aufgeführt [siehe auch ARZNEIMITTELWECHSELWIRKUNGEN, Tabelle 6].
Tabelle 3: Arzneimittel, die mit VIRACEPT Kontraindiziert sind

WARNHINWEISE
Enthalten als Teil der VORSICHTSMAßNAHMEN Abschnitt.
VORSICHTSMAßNAHMEN
WARNUNG: informieren Sie sich über Medikamente, die nicht sein sollten mit VIRACEPT eingenommen. Diese Aussage ist auf dem Flaschenetikett des Produkts enthalten.
Risiko Schwerwiegender Nebenwirkungen aufgrund von Arzneimittelwechselwirkungen
Einleitung von VIRACEPT, einem CYP3A-inhibitor, bei Patienten empfangen von Medikamenten, die durch CYP3A metabolisiert werden, oder Einleitung von metabolisierten Medikamenten durch CYP3A bei Patienten, die bereits viracept erhalten, kann plasma erhöht werden Konzentrationen von Medikamenten, die durch CYP3A metabolisiert werden. Einleitung von Medikamenten dass hemmen oder induzieren CYP3A kann erhöhen oder verringern Konzentrationen von VIRACEPT, bzw.. Diese Wechselwirkungen können führen zu:
- Klinisch signifikante Nebenwirkungen, potenziell führt zu schweren, lebensbedrohlichen oder tödlichen Ereignissen durch höhere Exposition von begleitmedikamente.
- Klinisch signifikante Nebenwirkungen von größeren Aufnahmen von VIRACEPT.
- Verlust der therapeutischen Wirkung von VIRACEPT und möglich Entwicklung des Widerstands.
Siehe Tabelle 6 für Schritte, um diese zu verhindern oder zu verwalten. und bekannte signifikante arzneimittelwechselwirkungen, einschließlich dosierungsempfehlungen. Berücksichtigen Sie das Potenzial für arzneimittelwechselwirkungen vor und während DER viracept-Therapie; überprüfen Sie begleitmedikamente während der VIRACEPT Therapie; und überwachen Sie die Nebenwirkungen, die mit der begleitenden Medikament.
Leberfunktionsstörung
VIRACEPT sollte nicht bei Patienten mit entweder mittelschwere oder schwere leberfunktionsstörung (Child-Pugh B oder C, score größer als oder gleich 7).
Phenylketonurika
Viracept Pulver zum Einnehmen enthält Phenylalanin, eine Komponente von Aspartam. Jedes Gramm VIRACEPT-Pulver enthält 11,2 mg Phenylalanin. Phenylalanin kann für Patienten mit Phenylketonurie schädlich sein.
Diabetes Mellitus/Hyperglykämie
Neu einsetzender diabetes mellitus, Exazerbation vorbestehender diabetes mellitus und Hyperglykämie wurden während der postmarketing-überwachung berichtet bei HIV-infizierten Patienten, die protease-inhibitor-Therapie. Einige Patienten erforderlich entweder Einleitung oder Dosisanpassung von insulin oder orale hypoglykämische Mittel zur Behandlung dieser Ereignisse. In einigen Fällen hat diabetische Ketoazidose auftreten. Bei Patienten, die die protease-inhibitor-Therapie abgebrochen haben, Hyperglykämie Bestand in einigen Fällen. Weil diese Ereignisse gemeldet wurden freiwillig während der klinischen Praxis können keine Schätzungen der Häufigkeit vorgenommen werden und ein kausaler Zusammenhang zwischen der proteasehemmertherapie und diesen Ereignissen hat nicht etabliert.
Hämophilie
Es gab Berichte über erhöhte Blutungen, einschließlich spontane hauthämatome und hämarthrose bei Patienten mit Hämophilie Typ A und B mit proteaseinhibitoren behandelt. Bei einigen Patienten zusätzlicher Faktor VIII gegeben wurde. In mehr als der Hälfte der gemeldeten Fälle, Behandlung mit proteaseinhibitoren wurden fortgesetzt oder wieder eingeführt. Ein kausaler Zusammenhang hat nicht etabliert.
Fettverteilung
Umverteilung / Ansammlung von Körperfett einschließlich zentral Fettleibigkeit, dorsozervikale fettvergrößerung (“ Büffel Buckel”), periphere verschwenden, Gesichts verschwenden, Brustvergrößerung, und “cushingoide Aussehen” wurden beobachtet in Patienten, die eine antiretrovirale Therapie erhalten. Der Mechanismus und die langfristigen Folgen von diesen Ereignissen sind derzeit unbekannt. Ein kausaler Zusammenhang wurde nicht etablierten.
Immunrekonstitutionssyndrom
Immunrekonstitutionssyndrom wurde berichtet in Patienten, die mit einer antiretroviralen Kombinationstherapie behandelt wurden, einschließlich VIRACEPT. Während die Anfangsphase der kombinierten antiretroviralen Behandlung, Patienten, deren Immunsystem reagiert kann eine entzündliche Reaktion auf indolent entwickeln oder residuale opportunistische Infektionen [wie Mycobacterium avium-Infektion, Zytomegalievirus, Pneumocystis-jiroveci-Pneumonie (PCP) oder Tuberkulose], die kann eine weitere Bewertung und Behandlung erfordern.
Autoimmunerkrankungen (wie Morbus Basedow, polymyositis, und Guillain-Barr & eacute; Syndrom) wurden auch berichtet, um auftreten in die Einstellung der immunrekonstitution; die Zeit bis zum Beginn ist jedoch mehr variabel und kann viele Monate nach Beginn der Behandlung auftreten.
Patientenberatung Informationen
Siehe FDA-zugelassener patient Kennzeichnung (PATIENTENINFORMATION)
Eine Erklärung an Patienten und Gesundheitsdienstleister ist auf dem Flaschenetikett des Produkts enthalten: WARNUNG: Finden Sie heraus über Arzneimittel, die nicht mit VIRACEPT eingenommen werden sollten.
- Gebrauchsanweisung
Für optimale absorption, Patienten sollten geraten werden, VIRACEPT mit Nahrung einzunehmen.
Patienten sollen informiert werden dass viracept Tabletten filmbeschichtet sind und dass diese filmbeschichtung dazu bestimmt ist, machen Sie die Tabletten leichter zu schlucken.
Wenn eine Dosis von VIRACEPT ist daher sollten die Patienten die Dosis so schnell wie möglich einnehmen und dann zu Ihr normaler Zeitplan. Wenn jedoch eine Dosis übersprungen wird, sollte der patient nicht verdoppeln Sie die nächste Dosis.
Erwachsene oder Pädiatrische Patienten unfähig, die Tabletten zu schlucken, können die Tabletten in einer kleinen Menge von Wasser:
- viracept Tablette(N) Einlegen kleine Menge Wasser
- Einmal aufgelöst, mischen Sie die Mischung Flüssigkeit gut, und verbrauchen Sie es sofort.
- das Glas sollte gespült werden mit Wasser und die Spülung geschluckt, um sicherzustellen, dass die gesamte Dosis verbraucht wird
Pädiatrische Patienten nicht in der Lage schlucken Tabletten können auch die pulverformulierung verwenden:
- viracept Pulver zum Einnehmen Mit einem kleine Menge Wasser, Milch, Formel, Soja-Formel, Sojamilch oder Nahrungsergänzungsmittel
- Einmal gemischt, der gesamte Inhalt muss konsumiert werden, um die volle Dosis zu erhalten.
- Wenn die Mischung nicht verbraucht sofort muss es unter Kühlung gelagert werden, aber die Lagerung darf nicht überschreiten 6 Stunden.
- Saure Lebensmittel oder Saft (e.g., Orangensaft, Apfelsaft oder apfelsauce) werden nicht zum mischen empfohlen Viracept Pulver zum Einnehmen, da die Kombination zu einem bitteren Geschmack führen kann.
- viracept Pulver zum Einnehmen sollte nicht mit Wasser in seinem ursprünglichen Behälter rekonstituiert werden.
Wechselwirkungen mit Arzneimitteln
VIRACEPT kann mit einigen interagieren Drogen; daher sollte den Patienten geraten werden, Ihrem Arzt die Verwendung zu melden von anderen verschreibungspflichtigen, nicht verschreibungspflichtigen Medikamenten oder pflanzlichen Produkten, besonders Johanniskraut.
Patienten, die orale Verhütungsmittel sollten angewiesen werden, dass Alternative oder zusätzliche Verhütungsmittel Maßnahmen sollten während der Therapie mit VIRACEPT angewendet werden.
Patienten, die sildenafil, oder andere PDE5-Inhibitoren, und nelfinavir sollte darauf hingewiesen werden, dass Sie bei ein erhöhtes Risiko für PDE5-Inhibitor-assoziierte Nebenwirkungen, einschließlich Hypotonie, visuelle Veränderungen und verlängerte Erektion des Penis, und sollte sofort melden Sie alle Symptome Ihrem Arzt.
Leberfunktionsstörung
Patienten sollen informiert werden das VIRACEPT sollte nicht verwendet werden, wenn es moderate oder schwere Leber Wertminderung.
Phenylketonurie
Ärzte sollten alarmieren Patienten mit Phenylketonurie, bei DENEN viracept Pulver zum Einnehmen Phenylalanin enthält
Fettumverteilung
Patienten sollen informiert werden diese Umverteilung oder Ansammlung von Körperfett kann bei Patienten auftreten, die antiretrovirale Therapie, einschließlich PREZISTA / ritonavir, und dass die Ursache und langfristige gesundheitliche Auswirkungen dieser Zustände sind derzeit nicht bekannt
Das häufigste unerwünschte Ereignis verbunden mit VIRACEPT ist Durchfall, der normalerweise kontrolliert werden kann mit nicht verschreibungspflichtige Medikamente wie Loperamid, die den Magen-Darm-Trakt verlangsamen Motilität.
Allgemeine Informationen
VIRACEPT ist kein Heilmittel für HIV-1-Infektion und Patienten können weiterhin Krankheiten erleben mit HIV-1-Infektion, einschließlich opportunistischer Infektionen. Patienten sollten bleiben Sie bei der Anwendung von VIRACEPT unter der Obhut eines Arztes. Patienten sollten sein es wird empfohlen, Dinge zu vermeiden, die eine HIV-1-Infektion auf andere übertragen können.
- keine Nadeln teilen oder andere injektionsgeräte.
- teilen Sie keine persönlichen Gegenstände das kann Blut oder Körperflüssigkeiten haben, wie Zahnbürsten und Rasierklingen.
- haben Sie keine Art von sex ohne Schutz. immer sicher üben sex mit einem Latex-oder Polyurethan-Kondom, um die Wahrscheinlichkeit sexuellen Kontakts zu verringern mit Sperma, vaginalsekreten oder Blut.
- nicht stillen. Wir wissen nicht, ob VIRACEPT an Ihr baby weitergegeben werden kann Ihre Muttermilch und ob Sie Ihrem baby Schaden könnte. Auch Mütter mit HIV-1 sollte nicht stillen, da HIV-1 an das baby in der Brust weitergegeben werden kann Milch.
Den Patienten sollte gesagt werden, dass anhaltende Abnahmen der plasma-HIV-RNA waren mit einem verringerten Risiko verbunden von Fortschreiten zu AIDSÂ und Tod.
Patienten sollen unterversorgt bleiben die Pflege eines Arztes bei der Verwendung von VIRACEPT. Patienten sollten beraten werden nehmen Sie VIRACEPT und andere begleitende antiretrovirale Therapie jeden Tag als vorgeschriebenen. Patienten sollten die Dosis nicht ändern oder die Therapie ohne Rücksprache Abbrechen mit Ihrem Arzt.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung Der Fruchtbarkeit
Karzinogenitätsstudien an Mäusen und Ratten wurden durchgeführt mit nelfinavir in oralen Dosen bis zu 1000 mg / kg / Tag. Keine Hinweise auf einen Tumor Wirkung wurde bei Mäusen bei systemischer Exposition (Cmax) bis zu 9-Fach beobachtet. gemessen am Menschen in der empfohlenen therapeutischen Dosis (750 mg TID oder 1250 mg GEBOT). Bei Ratten waren schilddrüsenfollikelzelladenome und Karzinome erhöht bei Männern bei 300 mg / kg / Tag und höher und bei Frauen bei 1000 mg / kg/Tag. Systemisch Expositionen (Cmax) bei 300 und 1000 mg / kg / Tag waren 1-bis 3-Fach, beziehungsweise, diejenigen, die beim Menschen in der empfohlenen therapeutischen Dosis gemessen wurden. Wiederholen die Verabreichung von nelfinavir an Ratten erzeugte Wirkungen, die mit der Leber vereinbar waren mikrosomale enzyminduktion und erhöhte schilddrüsenhormonablagerung; diese Effekte prädisponieren Ratten, aber nicht Menschen, zu schilddrüsenfollikelzellneoplasmen. Nelfinavir zeigte keine Hinweise auf Mutagene oder clastogene Aktivität in einer Batterie der in vitro und in vivo genetische Toxikologie-assays. Diese Studien umfassten bakterielle mutations-assays in S. typhimurium und E. coli, eine Maus Lymphom-Tyrosinkinase-assay, ein chromosomenaberrationstest beim Menschen Lymphozyten und ein in vivo Maus-Knochenmark-Mikronukleus-assay.
Nelfinavir erzeugte keine Auswirkungen auf Männer oder Frauen Paarung und Fruchtbarkeit oder embryoüberleben bei Ratten bei systemischer Exposition vergleichbar zur menschlichen therapeutischen Exposition.
Verwendung In Bestimmten Populationen
Schwangerschaft
Schwangerschaft Kategorie B
VIRACEPT sollte während der Schwangerschaft nur angewendet werden, wenn die der potenzielle nutzen rechtfertigt das potenzielle Risiko für den Fötus. Es gibt keine angemessene und gut kontrollierte Studien bei schwangeren Frauen, die VIRACEPT einnehmen.
Es gab keine Auswirkungen auf die Entwicklung des Fötus oder der Mutter Toxizität, wenn nelfinavir schwangeren Ratten bei systemischer Exposition verabreicht wurde (AUC) vergleichbar mit der Exposition des Menschen. Verabreichung von nelfinavir an schwangere Kaninchen führten zu keinen fötalen entwicklungseffekten bis zu einer Dosis, bei der eine leichte Abnahme des mütterlichen Körpergewichts wurde beobachtet; jedoch selbst bei der höchsten Dosis bewertet, systemische Exposition bei Kaninchen war signifikant niedriger als beim Menschen Exposition. Zusätzliche Studien an Ratten zeigten, dass die Exposition gegenüber nelfinavir in Frauen von der Mitte der Schwangerschaft bis zur Stillzeit hatten keinen Einfluss auf das überleben, Wachstum und Entwicklung der Nachkommen zur Entwöhnung. Nachfolgende reproduktive die Leistung dieser Nachkommen wurde auch nicht durch mütterliche Exposition gegenüber nelfinavir.
Antiretrovirales Schwangerschaftsregister (APR)
Zur überwachung der Mutter-fötalen Ergebnisse schwangerer Frauen ausgesetzt VIRACEPT und anderen antiretroviralen Mitteln, einem Antiretroviralen Das schwangerschaftsregister wurde eingerichtet. Ärzte werden zur Anmeldung aufgefordert Patienten unter (800) 258-4263.
Stillende Mütter
Die Centers for Disease Control and Prevention empfiehlt, dass HIV-infizierte Mütter Ihre Säuglinge nicht stillen, um Risiken zu vermeiden postnatale übertragung von HIV. Studien an laktierenden Ratten haben gezeigt das nelfinavir wird in Milch ausgeschieden. Wegen des Potenzials für HIV übertragung und das Potenzial für schwerwiegende Nebenwirkungen bei stillenden Säuglingen, Mütter sollten angewiesen werden, nicht zu stillen, wenn SIE viracept erhalten.
Pädiatrische Anwendung
Sicherheit, Verträglichkeit, pharmakokinetisches Profil und die Wirksamkeit von VIRACEPT wurde bei HIV-infizierten pädiatrischen Patienten von 2 bis 13 Jahre in multizentrischen klinischen Studien, Studie 556 und PACTG 337. Bei Patienten unter 2 Jahren Alter, VIRACEPT wurde gefunden, um sicher zu sein in den Dosen studierte, aber zuverlässig wirksame Dosis konnte nicht festgestellt werden. Das pharmakokinetische Profil, Sicherheit und antivirale Aktivität von VIRACEPT bei Jugendlichen Patienten 13 Jahre und ältere wird durch Daten aus den klinischen Studien für Erwachsene unterstützt, in denen einige Studien zulässige Einschreibung von Fächern ab 13 Jahren. Somit sind die Daten für Jugendliche und Erwachsene wurden gemeinsam analysiert.
Geriatrische Anwendung
Klinische Studien mit VIRACEPT enthielten nicht ausreichend Anzahl der Probanden ab 65 Jahren, um festzustellen, ob Sie unterschiedlich reagieren von jüngeren Fächern.
Leberfunktionsstörung
VIRACEPT sollte nicht bei Patienten mit entweder mittelschwere oder schwere leberfunktionsstörung (Child-Pugh B oder C, score größer als oder gleich 7). Bei Patienten mit leichter Lebererkrankung ist keine Dosisanpassung von VIRACEPT erforderlich Beeinträchtigung (Child-Pugh A, Punktzahl 5-6).
Nierenfunktionsstörung
Die Sicherheit und Wirksamkeit von VIRACEPT wurden nicht etabliert bei Patienten mit Nierenfunktionsstörung.

CYP3A und CYP2C19 scheinen die vorherrschenden Enzyme zu sein das metabolisieren nelfinavir beim Menschen. Die potenzielle Fähigkeit von nelfinavir zu hemmen die wichtigsten menschlichen Cytochrom P450 Enzyme (CYP3A, CYP2C19, CYP2D6, CYP2C9, CYP1A2 und CYP2E1) wurde untersucht in vitro. Nur CYP3A wurde gehemmt in Konzentrationen im therapeutischen Bereich. Spezifische arzneimittelinteraktion Studien wurden mit nelfinavir und einer Reihe von Medikamenten durchgeführt. Tabelle 12 fasst zusammen die Auswirkungen von nelfinavir auf das geometrische Mittel AUC, Cmax und Cmin von verabreicht Medikamente. Tabelle 13 zeigt die Auswirkungen von coadministrierten Arzneimitteln auf die geometrischer Mittelwert AUC, Cmax und Cmin von nelfinavir.max.max.max

Schwangerschaft Kategorie B
VIRACEPT sollte während der Schwangerschaft nur angewendet werden, wenn die der potenzielle nutzen rechtfertigt das potenzielle Risiko für den Fötus. Es gibt keine angemessene und gut kontrollierte Studien bei schwangeren Frauen, die VIRACEPT einnehmen.
Es gab keine Auswirkungen auf die Entwicklung des Fötus oder der Mutter Toxizität, wenn nelfinavir schwangeren Ratten bei systemischer Exposition verabreicht wurde (AUC) vergleichbar mit der Exposition des Menschen. Verabreichung von nelfinavir an schwangere Kaninchen führten zu keinen fötalen entwicklungseffekten bis zu einer Dosis, bei der eine leichte Abnahme des mütterlichen Körpergewichts wurde beobachtet; jedoch selbst bei der höchsten Dosis bewertet, systemische Exposition bei Kaninchen war signifikant niedriger als beim Menschen Exposition. Zusätzliche Studien an Ratten zeigten, dass die Exposition gegenüber nelfinavir in Frauen von der Mitte der Schwangerschaft bis zur Stillzeit hatten keinen Einfluss auf das überleben, Wachstum und Entwicklung der Nachkommen zur Entwöhnung. Nachfolgende reproduktive die Leistung dieser Nachkommen wurde auch nicht durch mütterliche Exposition gegenüber nelfinavir.
Antiretrovirales Schwangerschaftsregister (APR)
Zur überwachung der Mutter-fötalen Ergebnisse schwangerer Frauen ausgesetzt VIRACEPT und anderen antiretroviralen Mitteln, einem Antiretroviralen Das schwangerschaftsregister wurde eingerichtet. Ärzte werden zur Anmeldung aufgefordert Patienten unter (800) 258-4263.

Weil klinische Studien unter Bedingungen durchgeführt werden unterschiedliche Bedingungen, Nebenwirkungen, die in den klinischen Studien eines Medikament kann nicht direkt mit raten in den klinischen Studien eines anderen verglichen werden Drogen und kann nicht die in der Praxis beobachteten raten widerspiegeln.
Klinische Studien Erfahrung: Erwachsene Und Jugendliche (13 Jahre und Älter)
Die Sicherheit von VIRACEPT wurde bei über 5000 Patienten untersucht wer erhielt Medikament entweder allein oder in Kombination mit Nukleosid-Analoga. Der die meisten unerwünschten Ereignisse waren von leichter Intensität. Die am häufigsten gemeldeten unerwünschtes Ereignis bei Patienten, die VIRACEPT erhielten, war Durchfall, der war im Allgemeinen von leichter bis mäßiger Intensität.
Arzneimittelbedingte klinische Nebenwirkungen von moderaten oder schwere Intensität bei ≥ 2% der mit VIRACEPT coadministrierten Patienten mit d4T und 3TC (Studie 542) für bis zu 48 Wochen, oder mit ZDV-plus 3TC (Studie 511) für bis zu 24 Wochen sind in Tabelle 4.max
Unerwünschte Ereignisse, die bei weniger als 2% der Patienten auftreten Erhalt von VIRACEPT in allen klinischen Studien der phase 2 und 3 und mindestens in Betracht gezogen möglicherweise Verwandte oder unbekannte Beziehung zur Behandlung und von mindestens mäßig sind unten aufgeführt.
Körper als Ganzes: Bauchschmerzen, versehentliche Verletzung, allergische Reaktion, Asthenie, Rückenschmerzen, Fieber, Kopfschmerzen, Unwohlsein, Schmerzen, und Umverteilung/Ansammlung von Körperfett.
Verdauungssystem: Anorexie, Dyspepsie, epigastrische Schmerzen, gastrointestinale Blutungen, hepatitis, Mundgeschwüre, Pankreatitis und Erbrechen.
Hämisches / Lymphatisches System: Anämie, Leukopenie und Thrombozytopenie.
Stoffwechsel - / Ernährungssystem: steigt in alkalische phosphatase, amylase, Kreatinphosphokinase, milchdehydrogenase, SGOT, SGPT und gamma-glutamyl transpeptidase; hyperlipämie, Hyperurikämie, Hyperglykämie, Hypoglykämie, Dehydratation und leberfunktionstests abnormal.
Bewegungsapparat: Arthralgie, arthritis, Krämpfe, Myalgie, Myasthenie und Myopathie.
Nervensystem: Angst, depression, Schwindel, emotionale Labilität, hyperkinesie, Schlaflosigkeit, Migräne, Parästhesien, Krampfanfälle, Schlafstörungen, Schläfrigkeit und Selbstmordgedanken.
Atemwege: Dyspnoe, pharyngitis, rhinitis und sinusitis.
Haut / Anhängsel: dermatitis, Follikulitis, Pilz dermatitis, makulopapulöser Hautausschlag, Juckreiz, Schwitzen und Urtikaria.
Spezielle Sinne: akute iritis und Augenerkrankung.
Urogenitalsystem: Niere Kalkül, sexuelle Dysfunktion und Urin Anomalie.
Laboranomalien
Der Prozentsatz der Patienten mit ausgeprägtem Labor Anomalien in den Studien 542 und 511 sind in Tabelle 5 dargestellt. Markiert laboranomalien sind definiert als Anomalie Grad 3 oder 4 bei einem Patienten mit einem normalen Ausgangswert oder einer Abnormalität des Grades 4 bei einem Patienten mit einem Grad 1 Anomalie zu Studienbeginn.max
VIRACEPT wurde in etwa 400 pädiatrischen Patienten in klinischen Studien von der Geburt bis zum Alter von 13 Jahren. Das unerwünschte ereignisprofil während pädiatrischen klinischen Studien gesehen war ähnlich wie bei Erwachsenen.
Die am häufigsten berichteten drogenbedingten, Behandlung-emergent unerwünschte Ereignisse in den pädiatrischen Studien berichtet enthalten: Durchfall, Leukopenie / Neutropenie, Hautausschlag, Anorexie und Bauchschmerzen. Durchfall, unabhängig von der Beziehung zum studienmedikament wurde in 39% bis 47 berichtet% von pädiatrischen Patienten, die VIRACEPT in 2 der größeren behandlungsstudien erhielten. Leukopenie / Neutropenie war die laboranomalie, über die am häufigsten berichtet wurde als ein bedeutendes Ereignis in den pädiatrischen Studien.
Postmarketing Erfahrung
Die folgenden Nebenwirkungen wurden identifiziert während der Anwendung von VIRACEPT nach der Genehmigung. Weil diese Reaktionen freiwillig gemeldet werden aus einer population von unsicherer Größe ist es nicht immer möglich, zuverlässig schätzen Sie Ihre Häufigkeit oder stellen Sie einen kausalen Zusammenhang zur drogenexposition her.
Körper als Ganzes: überempfindlichkeitsreaktionen (einschließlich Bronchospasmus, mittelschwerer bis schwerer Hautausschlag, Fieber und ödeme).
Herz-Kreislauf-System: QTc-Verlängerung, torsades de pointes.
Verdauungssystem: Gelbsucht.
Metabolisches / Ernährungssystem: bilirubinämie, metabolische Azidose.

Menschliche Erfahrung einer akuten überdosierung mit VIRACEPT ist begrenzte. Es gibt kein spezifisches Gegenmittel für eine überdosierung mit VIRACEPT. Wenn angegeben, die elimination des nicht absorbierten Arzneimittels sollte durch emesis oder Magenspülung erreicht werden. Die Verabreichung von Aktivkohle kann auch verwendet werden, um die Entfernung von nicht absorbierte Droge. Da nelfinavir stark proteingebunden ist, ist eine Dialyse unwahrscheinlich um das Medikament signifikant aus dem Blut zu entfernen.

Auswirkungen auf das Elektrokardiogramm
Die Wirkung von Viracept in der empfohlenen Dosis von 1250 mg zweimal täglich im QTcF-Intervall, das mit einer fettarmen Mahlzeit (20% Fett) verabreicht wurde, war bewertet in einem randomisierten, placebo und aktiv (moxifloxacin 400 mg einmal täglich) kontrollierte, crossover-Studie bei 66 gesunden Probanden. Das maximale Mittel Zeit-abgestimmt (95% upper confidence bound) Unterschiede im QTcF-Intervall von placebo nach baselinekorrektur war unter 10 Millisekunden, die Schwelle von klinisches Anliegen. Dieser Befund war unverändert, wenn eine einzelne supratherapeutische Dosis von Viracept 3125 mg wurde nach einer 3-tägigen Verabreichung von Viracept 1250 mg zweimal täglich. Die Exposition bei 3125 mg Betrug 1.4-Fach, dass bei 1250 mg. Die Dosis von 3125 mg in dieser Studie erreichte nicht die erwarteten Expositionen bei Patienten, die eine fettreiche Mahlzeit (50% Fett) einnehmen oder gleichzeitig verabreicht werden von Medikamenten, die die nelfinavir-Exposition erhöhen könnten.
Kein Subjekt in einer Gruppe hatte einen Anstieg der QTcF von ≥ 60 Millisekunden von Grundlinie. Kein Subjekt erlebte ein Intervall, das die potenziell klinisch relevante Schwelle von 500 Millisekunden.

Die pharmakokinetischen Eigenschaften von nelfinavir wurden evaluiert bei gesunden Freiwilligen und HIV-infizierten Patienten; keine wesentlichen Unterschiede wurden zwischen den beiden Gruppen beobachtet.
Absorption
Pharmakokinetische Parameter von nelfinavir (Bereich unter dem Plasmakonzentration - zeitkurve während einer 24-Stunden-Periode im stationären Zustand [AUC24], spitzenplasmakonzentrationen [Cmax], morgens und abends trogkonzentrationen [Ctrough]) aus einer pharmakokinetischen Studie an HIV-positiven Patienten nach multipler Dosierung mit 1250 mg (fünf 250-mg-Tabletten) zweimal täglich (BID) für 28 Tage (10 Patienten) und 750 mg (drei 250-mg-Tabletten) dreimal täglich (TID) für 28 Tage (11 Patienten) sind in Tabelle 7 zusammengefasst.
Tabelle 7: Zusammenfassung einer Pharmakokinetischen Studie in
HIV-positive Patienten mit Mehrfachdosierung von 1250 mg (Fünf 250 mg Tabletten).
für 28 Tage und 750 mg (Drei 250 mg Tabletten) TID für 28 Tage
| Medikamentenklasse | Medikamente innerhalb der Klasse, die mit VIRACEPT Kontraindiziert sind | Klinischer Kommentar |
| Alpha 1-adrenorezeptor-antagonist | Alfuzosin | Potenziell erhöhte alfuzosinkonzentrationen können zu Hypotonie führen. |
| Antiarrhythmika | Amiodaron, Chinidin | Potenzial für schwere und / oder lebensbedrohliche Herzrhythmusstörungen. |
| Antimykobakterielle Mittel | Rifampin | Plasmakonzentrationen von nelfinavir können durch gleichzeitige Anwendung von rifampin reduziert werden. Dies kann zum Verlust der therapeutischen Wirkung und zur möglichen Entwicklung einer Resistenz gegen VIRACEPT oder andere coadministrierte antiretrovirale Mittel führen. |
| Mutterkornderivate | Dihydroergotamin, Ergotamin, methylergonovin | Potenzial für schwerwiegende und / oder lebensbedrohliche Reaktionen wie mutterkorntoxizität, gekennzeichnet durch peripheren Vasospasmus und Ischämie der Extremitäten und anderer Gewebe. |
| GI-Motilität-Agent | Cisaprid | Potenzial für schwere und / oder lebensbedrohliche Reaktionen wie Herzrhythmusstörungen. |
| Pflanzliche Produkte | St. Johanniskraut (Hypericum perforatum) | die Plasmakonzentrationen von nelfinavir können durch gleichzeitige Anwendung des kräuterpräparats reduziert werden.. John’s Würze. Dies kann zum Verlust der therapeutischen Wirkung und zur möglichen Entwicklung einer Resistenz gegen VIRACEPT oder andere coadministrierte antiretrovirale Mittel führen. |
| HMG-CoA-Reduktase-Hemmer | Lovastatin, Simvastatin | Potenzial für schwerwiegende Reaktionen wie Myopathie einschließlich Rhabdomyolyse. |
| Neuroleptika | Pimozid | Potenzial für schwere und / oder lebensbedrohliche Reaktionen wie Herzrhythmusstörungen. |
| PDE5-Hemmer | Sildenafil (Revatio®) [für die Behandlung der pulmonalen arteriellen Hypertonie]a | eine sichere und wirksame Dosis wurde bei Anwendung mit nelfinavir nicht nachgewiesen. Es besteht ein erhöhtes Potenzial für Sildenafil-assoziierte Nebenwirkungen (einschließlich Sehstörungen, Hypotonie, verlängerte Erektion und Synkope). |
| Beruhigend / Hypnotisch s | Triazolam, orales midazolam | Potenzial für schwere und / oder lebensbedrohliche Reaktionen wie verlängerte oder erhöhte Sedierung oder Atemdepression. |
| a Siehe ARZNEIMITTELWECHSELWIRKUNGEN, Tabelle 6 für coadministration von sildenafil und tadalafil bei Dosierung für erektile Dysfunktion Dysfunktion. |
Der Unterschied zwischen morgens und nachmittags oder abends trogkonzentrationen für DIE TID-und BID-Therapien wurden auch bei gesunden beobachtet freiwillige, die in genau 8-oder 12-Stunden-Intervallen dosiert wurden.
Bei gesunden Probanden, die eine Einzeldosis von 1250 mg erhalten, die 625-mg-Tablette war nicht bioäquivalent zur 250-mg-tablettenformulierung. Unter gefastet Bedingungen (n=27), die AUC und Cmax waren 34% und 24% höher, jeweils für die 625-mg-Tabletten. In einer relativen Bioverfügbarkeit Bewertung unter fed-Bedingungen (n=28) war die AUC für die 625 mg Tablette um 24% höher; die Cmax war für beide Formulierungen vergleichbar. In HIV-1-infizierten Probanden (N=21) erhalten mehrere Dosen von 1250 mg BID unter fed-Bedingungen, die 625 mg Formulierung war bioäquivalent zur 250 mg Formulierung basierend auf ähnlichkeit im steady state die Exposition (Cmax und AUC).
Tabelle 8 zeigt die Zusammenfassung des stationären Zustands pharmakokinetische Parameter (Mittelwert & plusmn; SD) von nelfinavir nach Verabreichung mehrerer Dosen von 1250 mg BID (2 x 625 mg Tabletten) an HIV-infizierte Patienten (N=21) für 14 Days.
Tabelle 8: Zusammenfassung der Stationären Pharmakokinetik
Parameter (Mittelwert & plusmn; SD) von Nelfinavir Nach Mehrfachdosierung von 1250
mg BID (2 x 625 mg Tabletten) für HIV-infizierte Patienten (N=21) für 14 Tage.
| Regime | AUC24 mg & Stier;h / L |
Cmax mg/L |
Ctrough Morgen mg/L |
Ctrough Am Nachmittag oder Abend mg/L |
| 1250 mg GEBOT | 52.8 ± 15.7 | 4.0 ± 0.8 | 2.2 ± 1.3 | 0.7 ± 0.4 |
| 750 mg TID | 43.6 ± 17.8 | 3.0 ± 1.6 | 1.4 ± 0.6 | 1.0 ± 0.5 |
| Daten bedeuten ± SD |
Bei gesunden Probanden, die eine Einzeldosis von 750 mg erhalten unter diesen Bedingungen waren die nelfinavir-Konzentrationen nach der Verabreichung ähnlich von der 250 mg Tablette und Pulver zum einnehmen.
Wirkung von Lebensmitteln auf die Orale Resorption
Nahrung erhöht die nelfinavir-Exposition und nimmt ab nelfinavir pharmakokinetische Variabilität relativ zum nüchternen Zustand. In einem Studie, gesunde freiwillige erhielten eine Einzeldosis von 1250 mg viracept 250 mg Tabletten (5 Tabletten) unter Fasten-oder futterbedingungen (drei verschiedene Mahlzeiten). In in einer zweiten Studie erhielten gesunde freiwillige Einzeldosen von 1250 mg VIRACEPT (5 x 250 mg Tabletten) unter Fasten-oder futterbedingungen (zwei unterschiedliche Fettgehalte Mahlzeit). Die Ergebnisse der beiden Studien sind in Tabelle 9 und Tabelle 9 zusammengefasst 10, bzw..
Tabelle 9: Anstieg der AUC, Cmax und Tmax für Nelfinavir
im Gefütterten Zustand Relativ zum Nüchternen Zustand Folgende 1250 mg VIRACEPT (5 x 250 mg
Tabletten)
| Regime | AUC12 mg & Stier;h / L |
Cmax mg/L |
Cmin mg/L |
| 1250 mg GEBOT | 35.3 (16.4) | 4.7 (1.9) | 1.5 (1.0) |
| AUC12: Steady-state-AUC Cmax: Maximale Plasmakonzentration im steady-state Cmin: Minimale Plasmakonzentration im steady-state |
Tabelle 10: Anstieg der Nelfinavir AUC, Cmax und Tmax in
Gefüttert, wenig Fett (20%) im Vergleich zu Hohen Fettanteil (50%) Staat Relativ zum Nüchternen Zustand
Folgende 1250 mg VIRACEPT (5 x 250 mg Tabletten)
| Anzahl der Kcal | % Fett | Anzahl der Probanden | auc-fache Erhöhung | CMAX Falte erhöhen | Erhöhung der Tmax (hr) |
| 125 | 20 | n=21 | 2.2 | 2.0 | 1.00 |
| 500 | 20 | n=22 | 3.1 | 2.3 | 2.00 |
| 1000 | 50 | n=23 | 5.2 | 3.3 | 2.00 |
Die Nelfinavir-Exposition kann durch Erhöhung der Kalorien-oder Fettgehalt in Mahlzeiten, die mit VIRACEPT eingenommen werden.
Eine Studie zum lebensmitteleffekt wurde mit dem 625 nicht durchgeführt mg-Tablette. Basierend auf einem studienübergreifenden Vergleich (n=26 fed vs. n=26 fastet) nach einmaliger Verabreichung von nelfinavir 1250 mg beträgt die Größe von der lebensmitteleffekt für die 625 mg nelfinavir-Tablette scheint vergleichbar mit dem von die 250-mg-Tabletten. VIRACEPT sollte mit einer Mahlzeit eingenommen werden.
Verteilung
Das scheinbare Verteilungsvolumen nach der mündlichen die Verabreichung von nelfinavir Betrug 2-7 L / kg. Nelfinavir im serum ist weitgehend proteingebunden ( > 98%).
Stoffwechsel
Unverändertes nelfinavir umfasste 82-86% des gesamten Plasmas Radioaktivität nach einer oralen Einzeldosis von 750 mg 14C-nelfinavir. In vitro, mehrere Cytochrom P-450 Enzyme einschließlich CYP3A und CYP2C19 sind verantwortlich für Stoffwechsel von nelfinavir. Ein Haupt-und mehrere kleinere oxidative Metaboliten wurden im plasma gefunden. Der wichtigste oxidative Metabolit hat in vitro antiviral Aktivität vergleichbar mit der muttersubstanz.
Beseitigung
Die Terminale Halbwertszeit im plasma Betrug typischerweise 3,5 bis 5 Öffnungszeit. Die Mehrheit (87%) einer oralen 750 mg-Dosis, die 14C-nelfinavir enthielt, wurde wiederhergestellt im Kot, fäkale Radioaktivität Bestand aus zahlreichen oxidativen Metaboliten (78%) und unverändert nelfinavir (22%). Nur 1-2% der Dosis wurden in Urin, von dem unverändert nelfinavir der Hauptbestandteil war.

Verfügbar in Ländern
| Anzahl der Kcal | % Fett | Anzahl der Probanden | auc-fache Erhöhung | CMAX Falte erhöhen | Erhöhung der Tmax (hr) |
| 500 | 20 | n=22 | 3.1 | 2.5 | 1.8 |
| 500 | 50 | n=22 | 5.1 | 3.8 | 2.1 |



































