















































































































































Componentes:
Método de ação:
Opção de tratamento:
Medicamente revisado por Militian Inessa Mesropovna, Farmácia Última atualização em 26.06.2023

Atenção! As informações na página são apenas para profissionais de saúde! As informações são coletadas em fontes abertas e podem conter erros significativos! Tenha cuidado e verifique novamente todas as informações desta página!
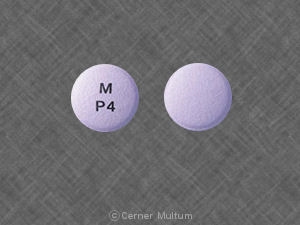
Comprimidos
Comprimidos revestidos por película, ovais modificados, como se segue:
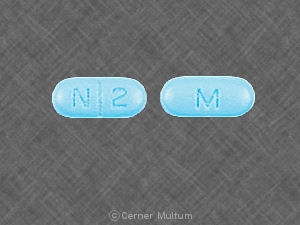
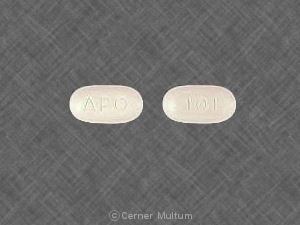
10 mg comprimidos brancos com a inscrição POT 10 em um lado. NDC 54766-201-01 Garrafas de 30
20 mg comprimidos de laranja escura com a inscrição POT 20 um lado. Os comprimidos são pontuados nos dois lados. NDC 54766-202-01 Garrafas de 30
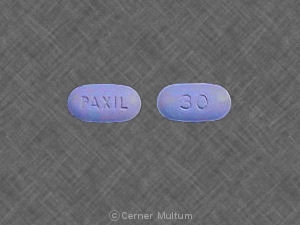
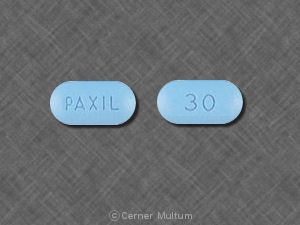
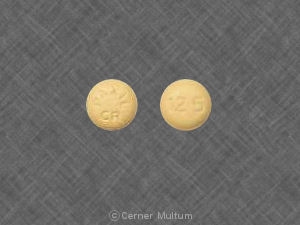
30 mg comprimidos amarelos com a inscrição POT 30 em um lado. NDC 54766-203-01 Garrafas de 30
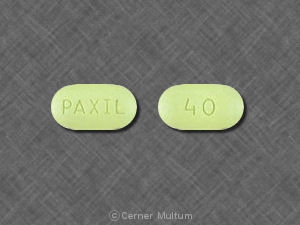
40 mg comprimidos de rosa com a inscrição POT 40 de um lado. NDC 54766-204-01 Garrafas de 30
Proteger da umidade. Armazenar a 25 ° C (77 ° F); excursões permitidas a 15 ° -30 ° C (59 ° e 86 ° F) (Vejo Sala Controlada da USP Temperatura)
Distribuído pela Sebela Pharmaceuticals Inc. 645 Hembree Parkway, Suíte I Roswell, Geórgia 30076. www.sebelapharma.com. Ligação gratuita 1-844-732-3521. Revisado: Jan 2017
Transtorno Depressivo Maior
PEXEVA® (mesilato de paroxetina) é indicado para o tratamento de MDD .
A eficácia da paroxetina no tratamento de um major episódio depressivo foi estabelecido em ensaios controlados de 6 semanas de pacientes ambulatoriais cujos diagnósticos correspondiam mais de perto à categoria DSM-III de MDD (ver FARMACOLOGIA CLÍNICA). Um episódio depressivo maior implica um destaque e humor deprimido ou disfórico relativamente persistente que geralmente interfere funcionamento diário (quase todos os dias por pelo menos 2 semanas); deve incluir em pelo menos 4 dos 8 sintomas a seguir: mudança de apetite, mudança de sono agitação ou retardo psicomotor, perda de interesse em atividades usuais ou diminuição do desejo sexual, aumento da fadiga, sentimentos de culpa ou inutilidade, pensamento lento ou concentração prejudicada e uma tentativa de suicídio ou ideação suicida.
Os efeitos da paroxetina na depressão hospitalizada os pacientes não foram adequadamente estudados.
A eficácia da paroxetina na manutenção de uma resposta O MDD por até 1 ano foi demonstrado em um estudo controlado por placebo (ver FARMACOLOGIA CLÍNICA). No entanto, o médico que decide usar O PEXEVA® (mesilato de paroxetina) por longos períodos deve periodicamente reavaliar a utilidade a longo prazo do medicamento para cada paciente.
Transtorno obsessivo-compulsivo
PEXEVA® (mesilato de paroxetina) é indicado para o tratamento de obsessões e compulsões em pacientes com TOC, conforme definido no DSM-IV. As obsessões ou compulsões causam sofrimento acentuado, são demorado ou interfere significativamente no social ou no profissional funcionando.
A eficácia da paroxetina foi estabelecida em duas 12 semanas ensaios com pacientes ambulatoriais obsessivos e compulsivos cujos diagnósticos correspondiam mais estreitamente com a categoria DSM-IIIR de TOC (ver Clínico Julgamentos).
O TOC é caracterizado por idéias recorrentes e persistentes pensamentos, impulsos ou imagens (obsessões) que são egodípticos e / ou comportamentos repetitivos, intencionais e intencionais (compulsões) que são reconhecido pela pessoa como excessivo ou irracional.
A manutenção a longo prazo da eficácia foi demonstrada em a Teste de prevenção de recaídas de 6 meses. Neste estudo, pacientes designados para a paroxetina mostrou uma taxa de recidiva mais baixa em comparação com os pacientes que receberam placebo (ver Ensaios Clínicos). No entanto, o médico quem optar por usar o PEXEVA® (mesilato de paroxetina) por longos períodos deve reavaliar periodicamente a utilidade a longo prazo do medicamento para o indivíduo paciente (ver DOSAGEM E ADMINISTRAÇÃO).
Transtorno de pânico
PEXEVA® (mesilato de paroxetina) é indicado para o tratamento da DP, com ou sem agorafobia, conforme definido no DSM-IV. DP é caracterizado pela ocorrência de ataques inesperados de pânico e associados preocupação em ter ataques adicionais, se preocupar com as implicações ou consequências dos ataques e / ou uma mudança significativa no comportamento relacionado os ataques.
A eficácia da paroxetina foi estabelecida em três a dez Ensaios de 12 semanas em pacientes com DP cujos diagnósticos correspondiam ao DSM-IIIR categoria de DP (ver Ensaios Clínicos).
PD (DSM-IV) é caracterizado por inesperado recorrente ataques de pânico, ou seja, um período discreto de intenso medo ou desconforto, no qual 4 (ou mais) dos seguintes sintomas se desenvolvem abruptamente e atingem um pico dentro de 10 minutos: (1) palpitações, batimento cardíaco ou frequência cardíaca acelerada; (2) suando; (3) tremendo ou tremendo; (4) sensações de falta de ar ou sufocante; (5) sensação de asfixia; (6) dor no peito ou desconforto; (7) náusea ou angústia abdominal; (8) sentir tonturas, instáveis, tontas ou fracas; (9) desrealização (sentimentos de irrealidade) ou despersonalização (sendo destacada a si mesmo); (10) medo de perder o controle; (11) medo de morrer; (12) parestesias (sensações de numbness ou formigamento); (13) calafrios ou afrontamentos.
A manutenção a longo prazo da eficácia foi demonstrada em a Teste de prevenção de recaídas de três meses. Neste estudo, pacientes com DP designados para a paroxetina demonstrou uma menor taxa de recidiva em comparação com os pacientes que receberam placebo (Vejo Ensaios Clínicos). No entanto, o médico que prescreve PEXEVA® (mesilato de paroxetina) por longos períodos deve reavaliar periodicamente a utilidade a longo prazo do medicamento para o paciente individual.
Transtorno de Ansiedade Generalizada
Paroxetina é indicada para o tratamento de Generalizado Transtorno de Ansiedade (TAG), conforme definido no DSM-IV. Ansiedade ou tensão associada com o estresse da vida cotidiana geralmente não requer tratamento com um ansiolítico.
A eficácia da paroxetina no tratamento da DAU foi estabelecido em dois ensaios controlados por placebo de 8 semanas em adultos com TAG A paroxetina não foi estudada em crianças ou adolescentes com generalização Transtorno de Ansiedade (ver Ensaios Clínicos).
O Transtorno de Ansiedade Generalizada (DSM-IV) é caracterizado por ansiedade e preocupação excessivas (expectativa apreensiva) que são persistentes pelo menos 6 meses e que a pessoa acha difícil de controlar. Deve ser associado a pelo menos 3 dos 6 sintomas a seguir: inquietação ou sensação com chave ou no limite, sendo facilmente cansada, dificuldade em se concentrar ou mente ficando em branco, irritabilidade, tensão muscular, distúrbio do sono.
A eficácia da paroxetina na manutenção de uma resposta pacientes com Transtorno de Ansiedade Generalizada, que responderam durante 8 semanas fase de tratamento agudo enquanto tomava paroxetina e foram então observadas recaída durante um período de até 24 semanas, foi demonstrada em a estudo controlado por placebo (ver Ensaios Clínicos). No entanto, o médico que decide usar paroxetina por longos períodos deve reavaliar periodicamente a utilidade a longo prazo do medicamento para o paciente individual (ver DOSAGEM E ADMINISTRAÇÃO).
Transtorno Depressivo Maior
Dosagem inicial usual
PEXEVA® (mesilato de paroxetina) deve ser administrado como a dose diária única com ou sem alimentos, geralmente de manhã. O recomendado a dose inicial é de 20 mg / dia. Os pacientes foram administrados em uma faixa de 20 a 50 mg / dia em os ensaios clínicos demonstrando a eficácia da paroxetina no tratamento de MDD. Como em todos os medicamentos eficazes no tratamento do MDD, o completo efeito pode estar atrasado. Alguns pacientes que não respondem a uma dose de 20 mg podem se beneficiar de aumentos de dose, em incrementos de 10 mg / dia, até um máximo de 50 mg / dia. Alterações de dose devem ocorrer em intervalos de pelo menos 1 semana.
Terapia de manutenção
Não há um corpo de evidência disponível para responder questão de quanto tempo o paciente tratado com paroxetina deve permanecer nele. É geralmente aceito que episódios agudos de MDD requerem vários meses ou mais tempo de terapia farmacológica sustentada. Se a dose é necessária para induzir a remissão é idêntica à dose necessária para manter e / ou sustentar a eutimia é desconhecido.
Avaliação sistemática da eficácia da paroxetina tem demonstrou que a eficácia é mantida por períodos de até 1 ano com doses que média de cerca de 30 mg.
Transtorno obsessivo-compulsivo
Dosagem inicial usual
PEXEVA® (mesilato de paroxetina) deve ser administrado como a dose diária única com ou sem alimentos, geralmente de manhã. O recomendado a dose de paroxetina no tratamento do TOC é de 40 mg por dia. Pacientes devem ser iniciado em 20 mg / dia e a dose pode ser aumentada em incrementos de 10 mg / dia. Alterações de dose devem ocorrer em intervalos de pelo menos 1 semana. Os pacientes foram administrados na faixa de 20 a 60 mg / dia nos ensaios clínicos que demonstram o eficácia da paroxetina no tratamento do TOC. A dose máxima deve não exceda 60 mg / dia.
Terapia de manutenção
A manutenção a longo prazo da eficácia foi demonstrada em a Teste de prevenção de recaídas de 6 meses. Neste estudo, pacientes com TOC designados para a paroxetina demonstrou uma menor taxa de recidiva em comparação com os pacientes que receberam placebo (Vejo FARMACOLOGIA CLÍNICA). O TOC é uma condição crônica, e é razoável considerar a continuação para um paciente que responde. Dosagem ajustes devem ser feitos para manter o paciente com a menor eficácia dosagem e pacientes devem ser reavaliados periodicamente para determinar a necessidade para tratamento continuado.
Transtorno de pânico
Dosagem inicial usual
PEXEVA® (mesilato de paroxetina) deve ser administrado como a dose diária única com ou sem alimentos, geralmente de manhã. A dose alvo de paroxetina no tratamento da DP é de 40 mg / dia. Os pacientes devem ser iniciados em 10 mg / dia. Alterações de dose devem ocorrer em incrementos de 10 mg / dia e em intervalos de pelo menos 1 semana. Os pacientes foram administrados em uma faixa de 10 a 60 mg / dia nos ensaios clínicos que demonstram a eficácia da paroxetina. O a dose máxima não deve exceder 60 mg / dia.
Terapia de manutenção
A manutenção a longo prazo da eficácia foi demonstrada em a Teste de prevenção de recaídas de três meses. Neste estudo, pacientes com DP designados para a paroxetina demonstrou uma menor taxa de recidiva em comparação com os pacientes que receberam placebo (Vejo FARMACOLOGIA CLÍNICA). PD é uma condição crônica, e é razoável considerar a continuação para um paciente que responde. Dosagem ajustes devem ser feitos para manter o paciente com a menor eficácia dosagem e pacientes devem ser reavaliados periodicamente para determinar a necessidade para tratamento continuado.
Transtorno de Ansiedade Generalizada
Dosagem inicial usual
PEXEVA® (mesilato de paroxetina) deve ser administrado como a dose diária única com ou sem alimentos, geralmente de manhã. Em clínica ensaios a eficácia da paroxetina foi demonstrada em doentes administrados em a intervalo de 20 a 50 mg / dia. A dose inicial recomendada e a estabelecida dosagem eficaz é de 20 mg / dia. Não há evidências suficientes para sugerir a maior benefício para doses superiores a 20 mg / dia. Alterações de dose devem ocorrer em 10 incrementos de mg / dia e em intervalos de pelo menos 1 semana.
Terapia de manutenção
Avaliação sistemática da paroxetina contínua para períodos de até 24 semanas em pacientes com DAU que responderam durante o tratamento a paroxetina durante uma fase de tratamento agudo de 8 semanas demonstrou um benefício de essa manutenção (ver Ensaios Clínicos). No entanto, os pacientes devem ser reavaliados periodicamente para determinar a necessidade para tratamento de manutenção.
Populações especiais
Tratamento de mulheres grávidas durante o terceiro trimestre
Neonatos expostos à paroxetina e outros ISRS ou SNRIs no final do terceiro trimestre, desenvolveram complicações que requerem prolongamento hospitalização, suporte respiratório e alimentação por sonda (ver PRECAUÇÕES). Ao tratar mulheres grávidas com paroxetina durante o terceiro trimestre, o o médico deve considerar cuidadosamente os riscos e benefícios potenciais de tratamento.
Dosagem para idosos ou debilitados e pacientes com gravidade Compromisso renal ou hepático
A dose inicial recomendada é de 10 mg / dia para idosos pacientes, pacientes debilitados e / ou pacientes com insuficiência renal ou hepática grave deficiência. Aumentos podem ser feitos se indicado. A dosagem não deve exceder 40 mg / dia.
Mudando um paciente para ou de uma monoamina oxidase Inibidor (MAOI) pretendia tratar distúrbios psiquiátricos
Pelo menos 14 dias devem decorrer entre a descontinuação de um MAOI destinado a tratar distúrbios psiquiátricos e iniciar o tratamento PEXEVA®. Por outro lado, pelo menos 14 dias devem ser permitidos após a interrupção do PEXEVA® antes de iniciar um MAOI destinado a tratar distúrbios psiquiátricos (ver CONTRA-INDICAÇÕES).
Uso de PEXEVA® com outros MAOIs, como Linezolid ou Methylene Azul
Não inicie o PEXEVA® em um paciente que está sendo tratado com azul de metileno linezolida ou intravenosa, porque há um risco aumentado de síndrome da serotonina. Em um paciente que requer tratamento mais urgente de a condição psiquiátrica, outras intervenções, incluindo hospitalização, deveriam ser considerado (ver CONTRA-INDICAÇÕES).
Em alguns casos, um paciente já está recebendo PEXEVA® a terapia pode exigir tratamento urgente com metileno linezolida ou intravenoso azul. Se alternativas aceitáveis ao azul de metileno linezolida ou intravenoso o tratamento não está disponível e os benefícios potenciais do linezolida ou o tratamento intravenoso de azul de metileno supera os riscos de síndrome da serotonina em um paciente em particular, o PEXEVA® deve ser interrompido imediatamente e azul de metileno linezolida ou intravenoso pode ser administrado. O paciente deve ser monitorado quanto a sintomas da síndrome da serotonina por 2 semanas ou até 24 horas após a última dose de azul de metileno linezolida ou intravenosa, o que for vem primeiro. A terapia com PEXEVA® pode ser retomada 24 horas após a última dose de azul de metileno linezolida ou intravenoso (ver AVISO).
O risco de administrar azul de metileno por rotas não intravenosas (como comprimidos orais ou injeção local) ou em doses intravenosas muito inferiores a 1 mg / kg com PEXEVA® não são claras. O o clínico deve, no entanto, estar ciente da possibilidade de emergência sintomas da síndrome da serotonina com esse uso (ver AVISO).
Descontinuação do tratamento com PEXEVA® (paroxetina mesilato)
Sintomas associados à descontinuação da paroxetina foram relatados (ver PRECAUÇÕES). Os pacientes devem ser monitorados estes sintomas ao interromper o tratamento, independentemente da indicação qual paroxetina está sendo prescrita. Uma redução gradual na dose que a interrupção abrupta é recomendada sempre que possível. Se sintomas intoleráveis ocorrer após uma diminuição da dose ou após a descontinuação do tratamento pode ser considerado o reatamento da dose prescrita anteriormente. Posteriormente, o médico pode continuar diminuindo a dose, mas a uma taxa mais gradual.
O uso de MAOIs destinados a tratar distúrbios psiquiátricos com PEXEVA® ou dentro de 14 dias após a interrupção do tratamento com PEXEVA® contra-indicado devido a um risco aumentado de síndrome da serotonina. O uso de PEXEVA® dentro de 14 dias após a interrupção de um MAOI destinado ao tratamento psiquiátrico distúrbios também são contra-indicados (ver AVISO e DOSAGEM E ADMINISTRAÇÃO).
Iniciando o PEXEVA® em um paciente que está sendo tratado MAOIs como linezolida ou azul de metileno intravenoso também são contra-indicados devido a um risco aumentado de síndrome da serotonina (ver AVISO e DOSAGEM E ADMINISTRAÇÃO).
O uso concomitante em pacientes em uso de tioridazina é contra-indicado (ver AVISO e PRECAUÇÕES).
O uso concomitante em pacientes em uso de pimozida é contra-indicado (ver PRECAUÇÕES).
Os comprimidos de PEXEVA® (mesilato de paroxetina) são contra-indicados em pacientes com hipersensibilidade à paroxetina ou a qualquer um dos inativos ingredientes em comprimidos de PEXEVA® (mesilato de paroxetina).
AVISO
Piora Clínica e Risco de Suicídio
Pacientes com transtorno depressivo maior (MDD), ambos adultos e pediátrico, pode sofrer agravamento da depressão e / ou da surgimento de ideação e comportamento suicidas (suicidalidade) ou mudanças incomuns comportamento, estejam ou não tomando medicamentos antidepressivos, e isso o risco pode persistir até que ocorra remissão significativa. O suicídio é um risco conhecido depressão e alguns outros distúrbios psiquiátricos, e esses distúrbios eles mesmos são os preditores mais fortes de suicídio. Há uma longa data preocupação, no entanto, de que os antidepressivos possam ter um papel na indução do agravamento depressão e surgimento de suicídio em certos pacientes durante o fases iniciais do tratamento. Análises combinadas de controle de placebo a curto prazo ensaios de medicamentos antidepressivos (ISRS e outros) mostraram que esses medicamentos aumentar o risco de pensamento e comportamento suicidas (suicidalidade) em crianças adolescentes e adultos jovens (18 a 24 anos) com transtorno depressivo maior (MDD) e outros distúrbios psiquiátricos. Estudos de curto prazo não mostraram aumento o risco de suicídio com antidepressivos em comparação com o placebo em adultos além dos 24 anos; houve uma redução com antidepressivos em comparação com o placebo em adultos com 65 anos ou mais.
As análises agrupadas de ensaios controlados por placebo em crianças e adolescentes com MDD, transtorno obsessivo-compulsivo (TOC) ou outros distúrbios psiquiátricos incluíram um total de 24 ensaios de curto prazo de 9 medicamentos antidepressivos em mais de 4400 pacientes. As análises agrupadas de ensaios controlados por placebo em adultos com MDD ou outros distúrbios psiquiátricos incluiu um total de 295 ensaios de curto prazo (duração média de 2 meses) de 11 medicamentos antidepressivos em mais de 77000 pacientes. Houve uma variação considerável em risco de suicídio entre drogas, mas uma tendência a um aumento no pacientes mais jovens para quase todos os medicamentos estudados. Havia diferenças em risco absoluto de suicídio entre as diferentes indicações, com as mais altas incidência em MDD. As diferenças de risco (droga vs placebo), no entanto, foram relativamente estável dentro dos estratos etários e entre as indicações. Essas diferenças de risco (diferença de drogas e placebo no número de casos de suicídio por 1000 pacientes tratados) são fornecidos na Tabela 1.
TABELA 1
| Faixa etária | Diferença de medicamento-Placebo no número de casos de suicídio por 1000 pacientes tratados |
| Aumentos em comparação com o placebo | |
| <18 | 14 casos adicionais |
| 18-24 | 5 casos adicionais |
| Diminui em comparação com o placebo | |
| 25-64 | 1 caso a menos |
| ≥ 65 | 6 casos a menos |
Nenhum suicídio ocorreu em nenhum dos ensaios pediátricos. Houve suicídios nos julgamentos de adultos, mas o número foi insuficiente para chegar a qualquer conclusão sobre o efeito das drogas no suicídio.
Não se sabe se o o risco de suicídio se estende ao uso a longo prazo, ou seja, além de vários meses. Contudo, há evidências substanciais de ensaios de manutenção controlados por placebo em adultos com depressão que o uso de antidepressivos pode atrasar a recorrência de depressão.
Todos os pacientes sendo tratados com antidepressivos para qualquer indicação deve ser monitorado adequadamente e observado de perto quanto a piora clínica, suicídio e alterações incomuns comportamento, especialmente durante os primeiros meses de um curso de terapia medicamentosa ou em momentos de alteração da dose, aumenta ou diminui.
Os seguintes sintomas, ansiedade, agitação, pânico ataques, insônia, irritabilidade, hostilidade, agressividade, impulsividade acatisia (inquietação psicomotora), hipomania e mania foram relatadas em pacientes adultos e pediátricos em tratamento com antidepressivos para maior transtorno depressivo, bem como para outras indicações, tanto psiquiátricas quanto não psiquiátrico. Embora um nexo de causalidade entre o surgimento de tais sintomas e o agravamento da depressão e / ou o surgimento de suicida impulsos não foram estabelecidos, existe a preocupação de que tais sintomas possam representam precursores da suicídio emergente.
Deve-se considerar a alteração da terapêutica regime, incluindo possivelmente a interrupção do medicamento, em pacientes cuja a depressão é persistentemente pior ou quem está experimentando suicídio emergente ou sintomas que possam ser precursores do agravamento da depressão ou da suicídio especialmente se esses sintomas forem graves, abruptos no início ou não fizerem parte o paciente está apresentando sintomas.
Se foi tomada a decisão de interromper o tratamento, a medicação deve ser afunilada, o mais rápido possível, mas com reconhecimento que a descontinuação abrupta pode estar associada a certos sintomas (ver PRECAUÇÕES e DOSAGEM E ADMINISTRAÇÃO - Descontinuação de Tratamento com PEXEVA® (mesilato de paroxetina), para uma descrição dos riscos de descontinuação de PEXEVA® (mesilato de paroxetina)).
Famílias e cuidadores de pacientes em tratamento antidepressivos para transtorno depressivo maior ou outras indicações, ambos psiquiátrico e não psiquiátrico, deve ser alertado sobre a necessidade de monitorar pacientes para o surgimento de agitação, irritabilidade, alterações incomuns comportamento e outros sintomas descritos acima, bem como o surgimento de suicídio e relatar esses sintomas imediatamente aos profissionais de saúde. Esse monitoramento deve incluir a observação diária de famílias e cuidadores. Prescrições para PEXEVA® (mesilato de paroxetina) deve ser escrito para a menor quantidade de comprimidos consistentes com o bom gerenciamento do paciente, a fim de reduzir o risco de overdose.
Triagem de pacientes para transtorno bipolar
Um episódio depressivo maior pode ser o inicial apresentação do transtorno bipolar. Geralmente é acreditado (embora não estabelecido em ensaios controlados) que trata esse episódio com um somente o antidepressivo pode aumentar a probabilidade de precipitação de a episódio misto / maníaco em pacientes em risco de transtorno bipolar. Se é que alguma os sintomas descritos acima representam que essa conversão é desconhecida. Contudo, antes de iniciar o tratamento com um antidepressivo, pacientes com depressivo os sintomas devem ser adequadamente rastreados para determinar se estão em risco transtorno bipolar; essa triagem deve incluir um histórico psiquiátrico detalhado incluindo um histórico familiar de suicídio, transtorno bipolar e depressão. Isto deve-se notar que o PEXEVA® (mesilato de paroxetina) não é aprovado para uso em tratamento da depressão bipolar.
Síndrome da serotonina
O desenvolvimento de um potencialmente fatal a síndrome da serotonina foi relatada com SNRIs e ISRSs, incluindo PEXEVA® sozinho, mas particularmente com o uso concomitante de outros medicamentos serotoninérgicos (incluindo triptanos, antidepressivos tricíclicos, fentanil, lítio, tramadol triptofano, buspirona, anfetaminas e St. John's Wort) e com drogas isso prejudicar o metabolismo da serotonina (em particular, MAOIs, ambos os que se destinam tratar distúrbios psiquiátricos e também outros, como linezolida e intravenosa azul de metileno).
Os sintomas da síndrome da serotonina podem incluir estado mental alterações (por exemplo,.agitação, alucinações, delírio e coma), autonômico instabilidade (por exemplo,.taquicardia, pressão arterial lábil, tontura, diaforese rubor, hipertermia), sintomas neuromusculares (por exemplo,.tremor, rigidez mioclonia, hiperreflexia, incoordenação), convulsões e / ou gastrointestinal sintomas (por exemplo,., náusea, vômito, diarréia). Os pacientes devem ser monitorados o surgimento da síndrome da serotonina.
O uso concomitante de PEXEVA® com MAOIs pretendido tratar distúrbios psiquiátricos é contra-indicado. PEXEVA® também não deve ser começou em um paciente que está sendo tratado com MAOIs como linezolid ou azul de metileno intravenoso. Todos os relatórios com azul de metileno fornecidos informações sobre a via de administração envolviam administração intravenosa no intervalo de doses de 1 mg / kg a 8 mg / kg. Nenhum relatório envolveu a administração de azul de metileno por outras vias (como comprimidos orais ou injeção local de tecido) ou em doses mais baixas. Pode haver circunstâncias em que é necessário iniciar tratamento com um MAOI, como linezolida ou azul de metileno intravenoso em a paciente a tomar PEXEVA®. O PEXEVA® deve ser descontinuado antes de iniciar tratamento com o MAOI (ver CONTRA-INDICAÇÕES e DOSAGEM E ADMINISTRAÇÃO).
Se o uso concomitante de PEXEVA® com outros sorotoninérgicos medicamentos incluindo triptanos, antidepressivos tricíclicos, fentanil, lítio, tramadol, buspirona, triptofano, anfetaminas e St. O erva de John é clinicamente justificado, esteja ciente de um risco potencial aumentado de síndrome da serotonina particularmente durante o início do tratamento e aumentos de dose.
Tratamento com PEXEVA® e qualquer serotoninérgico concomitante os agentes devem ser descontinuados imediatamente se os eventos acima ocorrerem e tratamento sintomático de suporte deve ser iniciado.
Glaucoma de fechamento angular
A dilatação pupilar que ocorre após o uso de muitos medicamentos antidepressivos, incluindo Pexeva, podem desencadear um ataque de fechamento angular em um paciente com ângulos anatomicamente estreitos que não possui iridectomia patente.
Interação potencial com Thioridazine
Somente a administração de tioridazina produz prolongamento do intervalo QTc, associado a ventrículo grave arritmias, como arritmias do tipo torsade de pointes e morte súbita. Este efeito parece estar relacionado à dose.
Um in vivo estudo sugere que drogas que inibem O CYP2D6, como a paroxetina, elevará os níveis plasmáticos de tioridazina. Portanto, recomenda-se que a paroxetina não seja usada em combinação com tioridazina (consulte CONTRAINDICAÇÕES e PRECAUÇÕES).
Uso na gravidez
Efeitos teratogênicos
Estudos epidemiológicos mostraram que os bebês foram expostos a paroxetina no primeiro trimestre de gravidez tem um risco aumentado de malformações congênitas, particularmente malformações cardiovasculares. O os resultados desses estudos estão resumidos abaixo :
- Um estudo baseado em dados de registro nacional sueco demonstrou que os bebês expostos à paroxetina durante a gravidez (n = 815) tiveram um risco aumentado de malformações cardiovasculares (risco de 2% em bebês expostos à paroxetina) em comparação com toda a população do registro (1% risco), para um odds ratio (OR) de 1,8 (intervalo de confiança de 95% 1,1 a 2,8). Não foi observado um aumento no risco de malformações congênitas gerais bebês expostos à paroxetina. As malformações cardíacas na paroxetina exposta os bebês eram principalmente defeitos do septo ventricular (VSDs) e do septo atrial defeitos (ASDs). Defeitos seculares variam em gravidade daqueles que resolvem espontaneamente àqueles que necessitam de cirurgia.
- Um estudo de coorte retrospectivo separado do United Os Estados (dados da United Healthcare) avaliaram 5.956 bebês de mães dispensadas antidepressivos durante o primeiro trimestre (n = 815 para paroxetina). Este estudo mostrou uma tendência para um risco aumentado de malformações cardiovasculares paroxetina (risco de 1,5%) em comparação com outros antidepressivos (risco de 1%), para um OR de 1,5 (intervalo de confiança de 95% 0,8 a 2,9). Dos 12 expostos à paroxetina bebês com malformações cardiovasculares, 9 tinham VSDs. Este estudo também sugeriu um risco aumentado de grandes malformações congênitas gerais, incluindo defeitos cardiovasculares da paroxetina (risco de 4%) em comparação com outros (risco de 2%) antidepressivos (OR 1,8; intervalo de confiança de 95% 1,2 a 2,8).
- Dois grandes estudos de controle de caso usando bancos de dados separados cada um com> 9.000 casos de defeitos congênitos e> 4.000 controles, descobriu isso o uso materno de paroxetina durante o primeiro trimestre de gravidez foi associado a um risco aumentado de 2 a 3 vezes o trato de saída do ventrículo direito obstruções. Em um estudo, a sala de cirurgia foi de 2,5 (intervalo de confiança de 95%, 1,0 a 6,0) 7 bebês expostos) e no outro estudo a sala de cirurgia foi de 3,3 (95% de confiança intervalo, 1,3 a 8,8, 6 bebês expostos).
- Outros estudos descobriram resultados variados sobre se houve um risco aumentado de congênito geral, cardiovascular ou específico malformações. Uma metanálise de dados epidemiológicos por um período de 16 anos (1992 a 2008) incluiu um total de 20 estudos distintos: 11 estudos (incluindo os estudos mencionados acima) relataram estimativas para defeitos cardiovasculares e malformações congênitas gerais, 3 estudos relataram estimativas apenas para defeitos cardiovasculares e 6 estudos relataram estimativas apenas para o geral malformações congênitas. Embora sujeito a limitações, esta metanálise sugeriu um aumento da ocorrência de malformações cardiovasculares (prevalência odds ratio [POR] 1,5; Intervalo de confiança de 95% 1,2 a 1,9) e no geral malformações (POR 1.2; intervalo de confiança de 95% 1.1 a 1.4) com uso de paroxetina durante o primeiro trimestre. Não foi possível nesta metanálise determinar até que ponto as malformações cardiovasculares podem ter contribuiu para malformações gerais, nem foi possível determinar se quaisquer tipos específicos de malformações cardiovasculares contribuíram para todos malformações cardiovasculares.
- Se um paciente engravidar enquanto estiver a tomar paroxetina, ela deve ser avisada do dano potencial ao feto. A menos que os benefícios da paroxetina para a mãe justifica o tratamento contínuo, deve-se considerar ser administrado para interromper a terapia com paroxetina ou mudar para outro antidepressivo (ver PRECAUÇÕES-Interrupção do tratamento com PEXEVA®). Para mulheres que pretendem engravidar ou estão em primeiro lugar trimestre de gravidez, a paroxetina só deve ser iniciada após consideração das outras opções de tratamento disponíveis.
Achados de animais
Estudos de reprodução foram realizados em doses de até 50 mg / kg / dia em ratos e 6 mg / kg / dia em coelhos administrados durante a organogênese. Essas doses são aproximadamente 8 (rato) e 2 (coelho) vezes o MRHD em um mg / m² base. Esses estudos não revelaram evidências de efeitos teratogênicos. Contudo, em ratos, houve um aumento nas mortes de filhotes durante os primeiros 4 dias de lactação quando a dosagem ocorreu durante o último trimestre de gestação e continuou durante a lactação. Este efeito ocorreu na dose de 1 mg / kg / dia ou aproximadamente um sexto do MRHD em uma base de mg / m². A dose sem efeito para filhotes de ratos, a mortalidade não foi determinada. A causa dessas mortes não é conhecido.
Efeitos não teratogênicos
Neonatos expostos ao PEXEVA® e outros ISRS ou serotonina e inibidores da recaptação de noradrenalina (SNRIs), no final do terceiro trimestre desenvolveram complicações que requerem hospitalização prolongada, respiratória suporte e alimentação por tubo. Tais complicações podem surgir imediatamente entrega. Os achados clínicos relatados incluíram dificuldade respiratória cianose, apneia, convulsões, instabilidade da temperatura, dificuldade de alimentação vômitos, hipoglicemia, hipotonia, hipertonia, hiperreflexia, tremor, nervosismo, irritabilidade e choro constante. Esses recursos são consistentes com um efeito tóxico direto dos ISRS e SNRIs ou, possivelmente, um medicamento síndrome de descontinuação. Note-se que, em alguns casos, o clínico a imagem é consistente com a síndrome da serotonina (ver AVISO: Serotonina Síndrome).
Bebês expostos a ISRSs durante a gravidez podem ter um risco aumentado de hipertensão pulmonar persistente do recém-nascido (PPHN). O PPHN ocorre em 1 - 2 por 1.000 nascidos vivos na população em geral e é associado a morbimortalidade neonatal substancial. Vários recentes estudos epidemiológicos sugerem uma associação estatística positiva entre o ISRS uso (incluindo PEXEVA®) na gravidez e PPHN. Outros estudos não mostram a associação estatística significativa.
Os médicos também devem observar os resultados de uma perspectiva estudo longitudinal de 201 mulheres grávidas com histórico de depressão maior que estavam em antidepressivos ou receberam antidepressivos menores que 12 semanas antes do último período menstrual e estavam em remissão. Mulheres que medicação antidepressiva descontinuada durante a gravidez mostrou um significativo aumento da recaída de sua depressão maior em comparação com as mulheres que permaneceu em medicação antidepressiva durante a gravidez.
Ao tratar uma mulher grávida com PEXEVA®, o o médico deve considerar cuidadosamente os riscos potenciais de tomar um ISRS juntamente com os benefícios estabelecidos do tratamento da depressão com um antidepressivo. Esta decisão só pode ser tomada caso a caso (ver DOSAGEM E ADMINISTRAÇÃO e REAÇÕES ADVERSAS, Relatórios de pós-comercialização).
PRECAUÇÕES
Geral
Ativação de Mania / Hipomania
Durante o teste de pré-comercialização, ocorreu hipomania ou mania em aproximadamente 1,0% dos pacientes unipolares tratados com paroxetina, em comparação com 1,1% de controle ativo e 0,3% dos pacientes unipolares tratados com placebo. Em um subconjunto de pacientes classificados como bipolares, a taxa de episódios maníacos foi de 2,2% para paroxetina e 11,6% para os grupos combinados de controle ativo. Como em todas as drogas eficaz no tratamento da MDD, a paroxetina deve ser usada com cautela pacientes com histórico de mania.
Convulsões
Durante os testes de pré-comercialização, ocorreram convulsões em 0,1% pacientes tratados com paroxetina, uma taxa semelhante à associada a outros medicamentos eficaz no tratamento de MDD. A paroxetina deve ser usada com cautela pacientes com histórico de convulsões. Deve ser descontinuado em qualquer paciente quem desenvolve convulsões.
Descontinuação do tratamento com PEXEVA® (paroxetina mesilato)
Ensaios clínicos recentes que apóiam os vários aprovados as indicações para paroxetina empregavam um regime de fase cônica, em vez de um descontinuação abrupta do tratamento. O regime de fase cônica usado no GAD e Os ensaios clínicos de TEPT envolveram uma diminuição incremental da dose diária em 10 mg / dia em intervalos semanais. Quando uma dose diária de 20 mg / dia foi atingida os pacientes continuaram com essa dose por 1 semana antes da interrupção do tratamento.
Com esse regime nesses estudos, os seguintes adversos foram relatados eventos com uma incidência de 2% ou mais para paroxetina em an incidência pelo menos duas vezes a relatada para placebo: sonhos anormais parestesia e tontura. Na maioria dos pacientes, esses eventos foram leves moderar e autolimitar e não exigiu intervenção médica.
Durante a comercialização de paroxetina e outros ISRS e SNRIs (inibidores da recaptação de serotonina e noradrenalina), houve espontânea relatos de eventos adversos que ocorrem com a descontinuação desses medicamentos (particularmente quando abrupto), incluindo o seguinte: humor disfórico irritabilidade, agitação, tontura, distúrbios sensoriais (por exemplo, parestesias como sensações de choque elétrico e zumbido), ansiedade, confusão, dor de cabeça letargia, instabilidade emocional, insônia e hipomania. Enquanto esses eventos são geralmente autolimitando, houve relatos de descontinuação grave sintomas.
Os pacientes devem ser monitorados quanto a esses sintomas quando interrupção do tratamento com paroxetina. Uma redução gradual na dose em vez de cessação abrupta, é recomendado sempre que possível. Se intolerável os sintomas ocorrem após uma diminuição na dose ou após a descontinuação de tratamento, então a retomada da dose prescrita anteriormente pode ser considerada. Posteriormente, o médico pode continuar diminuindo a dose, mas de forma mais taxa gradual (ver DOSAGEM E ADMINISTRAÇÃO).
Veja também PRECAUÇÕES-Uso pediátrico para adversos eventos relatados após a descontinuação do tratamento com paroxetina em pediatria pacientes.
Tamoxifeno
Alguns estudos demonstraram que a eficácia do tamoxifeno, medido pelo risco de recidiva / mortalidade do câncer de mama, pode ser reduzido quando co-prescrito com paroxetina como resultado do irreversível da paroxetina inibição do CYP2D6 (ver INTERAÇÕES DE DROGAS). No entanto, outros estudos falharam em demonstrar esse risco. É incerto se o a administração concomitante de paroxetina e tamoxifeno tem um efeito adverso significativo sobre a eficácia do tamoxifeno. Quando o tamoxifeno é usado para o tratamento ou prevenção do câncer de mama, os prescritores devem considerar o uso de uma alternativa antidepressivo com pouca ou nenhuma inibição do CYP2D6.
Akathisia
O uso de paroxetina ou outros ISRSs foi associado com o desenvolvimento da acatisia, caracterizada por um sentido interno de inquietação e agitação psicomotor, como incapacidade de sentar ou ficar de pé ainda geralmente associado a sofrimento subjetivo. É mais provável que isso ocorra nas primeiras semanas de tratamento.
Hiponatremia
Hiponatremia pode ocorrer como resultado do tratamento com SSRIs e SNRIs, incluindo PEXEVA® (mesilato de paroxetina). Em muitos casos, isso a hiponatremia parece ser o resultado da síndrome de inapropriado secreção de hormônio antidiurético (SIADH). Casos com sódio sérico inferior a 110 mmol / L foram relatados. Pacientes idosos podem estar em maior risco de desenvolvimento de hiponatremia com SSRIs e SNRIs. Além disso, pacientes tomando diuréticos ou que, de outra forma, o volume esgotado pode estar em maior risco (ver Geriátrico Usar). A descontinuação do PEXEVA® (mesilato de paroxetina) deve ser considerada em pacientes com hiponatremia sintomática e intervenção médica apropriada deve ser instituído.
Sinais e sintomas de hiponatremia incluem dor de cabeça dificuldade de concentração, comprometimento da memória, confusão, fraqueza e instabilidade, que pode levar a quedas. Sinais e sintomas associados a mais casos graves e / ou agudos incluíram alucinação, síncope, convulsão, coma parada respiratória e morte.
Sangramento anormal
SSRIs e SNRIs, incluindo PEXEVA® (mesilato de paroxetina) pode aumentar o risco de eventos hemorrágicos. Uso concomitante de aspirina medicamentos anti-inflamatórios não esteróides, varfarina e outros anti-coagulantes podem adicione a esse risco. Relatos de casos e estudos epidemiológicos (controle de casos e projeto de coorte) demonstraram uma associação entre o uso de drogas que interferir na recaptação da serotonina e na ocorrência de gastrointestinal sangrando. Eventos hemorrágicos relacionados ao uso de SSRIs e SNRIs variaram de equimoses, hematomas, epistaxe e petéquias com risco de vida hemorragias.
Os pacientes devem ser advertidos sobre o risco de sangramento associado ao uso concomitante de PEXEVA® (mesilato de paroxetina) e AINEs, aspirina ou outros medicamentos que afetam a coagulação.
Fratura óssea
Estudos epidemiológicos sobre o risco de fratura óssea a seguir a exposição a alguns antidepressivos, incluindo ISRS, relatou uma associação entre tratamento antidepressivo e fraturas. Existem vários possíveis causa essa observação e não se sabe até que ponto o risco de fratura é diretamente atribuível ao tratamento com ISRS. A possibilidade de um patológico fratura, isto é, uma fratura produzida por trauma mínimo em um paciente com diminuição da densidade mineral óssea, deve ser considerada em pacientes tratados com paroxetina que se apresenta com dor óssea inexplicável, sensibilidade pontual, inchaço ou machucado.
Use em pacientes com doença concomitante
Experiência clínica com paroxetina em pacientes com certa doença sistêmica concomitante é limitada. É aconselhável cautela ao usar paroxetina em pacientes com doenças ou condições que podem afetar o metabolismo ou respostas hemodinâmicas.
A paroxetina não foi avaliada ou usada para nenhum extensão apreciável em pacientes com histórico recente de infarto do miocárdio ou doença cardíaca instável. Pacientes com esses diagnósticos foram excluídos estudos clínicos durante o teste de pré-mercado do produto. Avaliação de eletrocardiogramas de 682 pacientes que receberam paroxetina em dupla ocultação estudos controlados por placebo, no entanto, não indicaram que a paroxetina é associado ao desenvolvimento de anormalidades significativas no ECG. Da mesma forma a paroxetina não causa alterações clinicamente importantes na frequência cardíaca ou pressão arterial.
Ocorrem concentrações plasmáticas aumentadas de paroxetina doentes com compromisso renal grave (depuração da creatinina <30 ml / min) ou compromisso hepático grave. Uma dose inicial mais baixa deve ser usada nesses pacientes (Vejo DOSAGEM E ADMINISTRAÇÃO).
Informações para pacientes
O PEXEVA® (mesilato de paroxetina) não deve ser mastigado ou esmagado e deve ser engolido inteiro.
Os pacientes devem ser advertidos sobre o risco de serotonina síndrome com o uso concomitante de paroxetina e triptanos, tramadol ou outros agentes serotoninérgicos.
Os pacientes devem ser avisados de que tomar Pexeva pode causar dilatação pupilar leve, que em indivíduos suscetíveis, pode levar a uma episódio de glaucoma de fechamento angular. O glaucoma preexistente é quase sempre glaucoma de ângulo aberto porque o glaucoma de fechamento angular, quando diagnosticado, pode ser tratado definitivamente com iridectomia. O glaucoma de ângulo aberto não é um fator de risco para glaucoma de fechamento de ângulo. Os pacientes podem querer ser examinados para determinar se são suscetíveis ao fechamento do ângulo e têm um procedimento profilático (por exemplo,., iridectomia), se forem suscetíveis.
Prescritores ou outros profissionais de saúde devem informar pacientes, suas famílias e seus cuidadores sobre os benefícios e riscos associado ao tratamento com PEXEVA® (mesilato de paroxetina) e deve aconselhar eles em seu uso apropriado. Um paciente Guia de Medicamentos sobre “Antidepressivo Medicamentos, Depressão e outras Doenças Mentais Graves e Pensamentos Suicidas ou Ações ”está disponível para PEXEVA® (mesilato de paroxetina). O prescritor ou o profissional de saúde deve instruir os pacientes, suas famílias e seus cuidadores para ler o Guia de Medicamentos e devem ajudá-los a entender seu conteúdo. Os pacientes devem ter a oportunidade de discutir o conteúdo do Guia de Medicamentos e obter respostas para quaisquer perguntas que possam ter. O texto completo do Guia de Medicamentos é reimpresso no final disso documento.
Os pacientes devem ser avisados dos seguintes problemas e solicitado a alertar o seu médico se estes ocorrerem enquanto estiver a tomar PEXEVA® (paroxetina mesilato).
Piora Clínica e Risco de Suicídio
Pacientes, suas famílias e seus cuidadores devem estar encorajado a estar alerta para o surgimento de ansiedade, agitação, ataques de pânico insônia, irritabilidade, hostilidade, agressividade, impulsividade, acatisia (desamparo psicomotor), hipomania, mania, outras mudanças incomuns comportamento, agravamento da depressão e ideação suicida, especialmente cedo durante o tratamento antidepressivo e quando a dose é ajustada para cima ou para baixo. Famílias e cuidadores de pacientes devem ser aconselhados a procurar o surgimento desses sintomas no dia-a-dia, pois as alterações podem ser abruptas. Tal os sintomas devem ser relatados ao médico ou profissional de saúde do paciente especialmente se forem graves, abruptos no início ou não fizerem parte do paciente apresentando sintomas. Sintomas como esses podem estar associados a um aumento do risco de pensamento e comportamento suicidas e indicar uma necessidade de muito monitoramento rigoroso e possivelmente alterações no medicamento.
Drogas que interferem na hemostase (AINEs, aspirina, Varfarina, etc.)
Os pacientes devem ser advertidos sobre o uso concomitante de paroxetina com AINEs, aspirina ou outros medicamentos que afetam a coagulação desde então o uso combinado de drogas psicotrópicas que interferem na recaptação da serotonina e esses agentes foram associados a um risco aumentado de sangramento.
Interferência no desempenho cognitivo e motor
Qualquer droga psicoativa pode prejudicar o julgamento, o pensamento ou habilidades motoras. Embora em estudos controlados não tenha sido demonstrado que a paroxetina prejudicar o desempenho psicomotor, os pacientes devem ser advertidos sobre a operação máquinas perigosas, incluindo automóveis, até que sejam razoavelmente certas que a terapia com paroxetina não afeta sua capacidade de se envolver em tais atividades.
Conclusão do Curso de Terapia
Embora os pacientes possam notar melhora com paroxetina terapia em 1 a 4 semanas, eles devem ser aconselhados a continuar a terapia como dirigido.
Medicação concomitante
Os pacientes devem ser aconselhados a informar seu médico se eles estão tomando ou planejam tomar qualquer receita ou medicamentos vendidos sem receita já que existe um potencial para interações.
Álcool
Embora a paroxetina não tenha demonstrado aumentar a comprometimento das habilidades mentais e motoras causadas pelo álcool, os pacientes devem estar aconselhado a evitar o álcool enquanto estiver a tomar PEXEVA® (mesilato de paroxetina).
Gravidez
Os pacientes devem ser aconselhados a notificar seu médico se engravidam ou pretendem engravidar durante o tratamento (ver AVISO - Uso na gravidez: Teratogênico e Não Teratogênico Efeitos).
Enfermagem
Os pacientes devem ser aconselhados a notificar seu médico se eles estão amamentando uma criança (ver PRECAUÇÕES - Mães de enfermagem).
Testes de laboratório
Não há testes laboratoriais específicos recomendados.
Paxil® (cloridrato de paroxetina)
Paroxetina, o ingrediente ativo do PEXEVA® (paroxetina mesilato), também é o ingrediente ativo do Paxil®. Assim, esses dois agentes não deve ser co-administrado.
Carcinogênese, Mutagênese, Comprometimento de Fertilidade
Carcinogênese
Foram realizados estudos de carcinogenicidade de dois anos roedores que receberam paroxetina na dieta a 1, 5 e 25 mg / kg / dia (camundongos) e 1, 5 , e 20 mg / kg / dia (ratos). Essas doses são de até 2,4 (camundongo) e 3,9 (rato) vezes a dose máxima humana recomendada (MRHD) para MDD e GAD em mg / m². Porque o MRHD para MDD é um pouco menor que o do TOC (50 mg vs 60 mg) as doses utilizadas nesses estudos de carcinogenicidade foram de apenas 2,0 (camundongo) e 3,2 (rato) vezes o MRHD para TOC. Havia um número significativamente maior de homens ratos do grupo de altas doses com sarcomas de células reticulares (1/100, 0/50, 0/50, e 4/50 para grupos controle, doses baixas, médias e altas, respectivamente) e a aumento significativo da tendência linear entre os grupos para a ocorrência de tumores linforreticulares em ratos machos. Ratos fêmeas não foram afetados. Apesar houve um aumento relacionado à dose no número de tumores em camundongos, não houve aumento relacionado a drogas no número de camundongos com tumores. A relevância destes descobertas para humanos são desconhecidas.
Mutagênese
A paroxetina não produziu efeitos genotóxicos em uma bateria de 5) in vitro e 2 in vivo ensaios que incluíram o seguinte: mutação bacteriana ensaio, ensaio de mutação de linfoma de camundongo, ensaio de síntese de DNA não programado e testes para aberrações citogenéticas in vivo na medula óssea do rato e in vitro no linfócitos humanos e em um teste letal dominante em ratos.
Compromisso de fertilidade
Alguns estudos clínicos mostraram que os ISRSs (incluindo paroxetina) pode afetar a qualidade do esperma durante o tratamento com ISRS, o que pode afetar fertilidade em alguns homens.
Uma taxa de gravidez reduzida foi encontrada na reprodução estudos em ratos com uma dose de paroxetina de 15 mg / kg / dia, que é 2,9 vezes a MRHD para MDD e GAD ou 2,4 vezes o MRHD para TOC em mg / m². Lesões irreversíveis ocorreram no trato reprodutivo de ratos machos depois dosagem em estudos de toxicidade por 2 a 52 semanas. Essas lesões consistiram em vacuolação do epitélio tubular epididimal a 50 mg / kg / dia e atrófica alterações nos túbulos seminíferos dos testículos com espermatog preso
EFEITOS SECUNDÁRIOS
Associado à descontinuação do tratamento
Vinte por cento (1199/6145) dos pacientes tratados paroxetina em ensaios clínicos mundiais em MDD e 11,8% (64/542), 9,4% (44/469) e 10,7% (79/735) dos pacientes tratados com paroxetina em todo o mundo ensaios em TOC, DP e GAD, respectivamente, interromperam o tratamento devido a um evento adverso. Os eventos mais comuns (≥ 1%) associados descontinuação e considerado relacionado a medicamentos (ou seja, os eventos associados com abandono a uma taxa aproximadamente duas vezes ou mais para paroxetina em comparação para placebo) incluiu o seguinte :
| MDD | TOC | PD | TAG | |||||
| Paroxetina | Placebo | Paroxetina | Placebo | Paroxetina | Placebo | Paroxetina | Placebo | |
| CNS | ||||||||
| Sonolência | 2,3% | 0,7% | - | - | 1,9% | 0,3% | 2,0% | 0,2% |
| Insônia | - | - | 1,7% | 0% | 1,3% | 0,3% | - | - |
| Agitação | 1,1% | 0,5% | - | - | - | - | - | - |
| Tremor | 1,1% | 0,3% | - | |||||
| Tontura | - | - | 1,5% | 0% | - | - | 1,0% | 0,2% |
| Gastrointestinal | ||||||||
| Constipação | - | - | 1,1% | 0% | - | - | - | - |
| Náusea | 3,2% | 1,1% | 1,9% | 0% | 3,2% | 1,2% | 2,0% | 0,2% |
| Diarréia | 1,0% | 0,3% | - | - | - | - | - | - |
| Boca seca | 1,0% | 0,3% | - | - | - | - | - | - |
| Vômitos | 1,0% | 0,3% | - | - | - | - | - | - |
| De outros | ||||||||
| Astenia | 1,6% | 0,4% | 1,9% | 0,4% | - | - | 1,8% | 0,2% |
| Anormal | 1,6% | 0% | 2,1% | 0% | - | - | 2,5% | 0,5% |
| Ejaculação1 | ||||||||
| Suando | 1,0% | 0,3% | - | - | - | - | 1,1% | 0,2% |
| Impotência1 | - | - | 1,5% | 0% | - | - | - | - |
| Onde os números não são fornecidos, a incidência do
eventos adversos em pacientes tratados com paroxetina não foram> 1% ou não foram
maior ou igual a duas vezes a incidência de placebo. 1 Incidência corrigida para gênero. |
||||||||
Eventos adversos comumente observados
Transtorno Depressivo Maior
O mais comumente observado eventos adversos associados ao uso de paroxetina (incidência de 5% ou maior e incidência de paroxetina pelo menos duas vezes a do placebo, derivada da Tabela 2 abaixo) foram: astenia, sudorese, náusea, diminuição do apetite sonolência, tontura, insônia, tremor, nervosismo, distúrbio ejaculatório e outros distúrbios genitais masculinos.
Transtorno obsessivo-compulsivo
O mais comumente observado eventos adversos associados ao uso de paroxetina (incidência de 5% ou maior e incidência de paroxetina pelo menos duas vezes a do placebo, derivada da Tabela 3 abaixo) foram: náusea, boca seca, diminuição do apetite, constipação tontura, sonolência, tremor, sudorese, impotência e ejaculação anormal.
Transtorno de pânico
O mais comumente observado eventos adversos associados ao uso de paroxetina (incidência de 5% ou maior e incidência de paroxetina pelo menos duas vezes a do placebo, derivada da Tabela 3 abaixo) foram: astenia, sudorese, diminuição do apetite, libido diminuição, tremor, ejaculação anormal, distúrbios genitais femininos e impotência.
Transtorno de Ansiedade Generalizada
O mais comumente observado eventos adversos associados ao uso de paroxetina (incidência de 5% ou maior e incidência de paroxetina pelo menos duas vezes a do placebo, derivada da Tabela 4) foram: astenia, infecção, constipação, diminuição do apetite, seco boca, náusea, libido diminuída, sonolência, tremor, sudorese e anormal ejaculação.
Incidência em ensaios clínicos controlados
O prescritor deve estar ciente de que as figuras no as tabelas a seguir não podem ser usadas para prever a incidência de efeitos colaterais no curso da prática médica usual, onde características do paciente e outras os fatores diferem daqueles que prevaleceram nos ensaios clínicos. Da mesma forma, o as frequências citadas não podem ser comparadas com as figuras obtidas de outras clínicas investigações envolvendo diferentes tratamentos, usos e investigadores. O os números citados, no entanto, fornecem ao médico prescritor alguma base para estimar a contribuição relativa de fatores medicamentosos e não medicamentosos para o taxa de incidência de efeitos colaterais nas populações estudadas.
Transtorno Depressivo Maior
A Tabela 2 enumera eventos adversos que ocorreram em um incidência de 1% ou mais entre pacientes tratados com paroxetina que participaram ensaios controlados por placebo a curto prazo (6 semanas), nos quais os pacientes foram administrados em um intervalo de 20 a 50 mg / dia. Os eventos adversos relatados foram classificados usando a terminologia padrão do dicionário baseado em COSTART.
TABELA 2: Experiência Adversa Emergente ao Tratamento
Incidência em ensaios clínicos controlados por placebo para MDD1
| Sistema Corporal | Termo preferido | Paroxetina (n = 421) |
Placebo (n = 421) |
| Corpo como um todo | Dor de cabeça | 18% | 17% |
| Astenia | 15% | 6% | |
| Cardiovascular | Palpitações | 3% | 1% |
| Vasodilatação | 3% | 1% | |
| Dermatológico | Suando | 11% | 2% |
| Erupção cutânea | 2% | 1% | |
| Gastrointestinal | Náusea | 26% | 9% |
| Boca seca | 18% | 12% | |
| Constipação | 14% | 9% | |
| Diarréia | 12% | 8% | |
| Apetite diminuído | 6% | 2% | |
| Flatulência | 4% | 2% | |
| Transtorno da Orofaringe2 | 2% | 0% | |
| Dispepsia | 2% | 1% | |
| Musculoesquelético | Miopatia | 2% | 1% |
| Mialgia | 2% | 1% | |
| Miastenia | 1% | 0% | |
| Sistema Nervoso | Sonolência | 23% | 9% |
| Tontura | 13% | 6% | |
| Insônia | 13% | 6% | |
| Tremor | 8% | 2% | |
| Nervosismo | 5% | 3% | |
| Ansiedade | 5% | 3% | |
| Parestesia | 4% | 2% | |
| Libido diminuiu | 3% | 0% | |
| Sentimento drogado | 2% | 1% | |
| Confusão | 1% | 0% | |
| Respiração | Bocejo | 4% | 0% |
| Sentidos especiais | Visão turva | 4% | 1% |
| Proversão de sabor | 2% | 0% | |
| Sistema Urogenital | Perturbação ejaculatória3,4 | 13% | 0% |
| Outros distúrbios genitais masculinos3,5 | 10% | 0% | |
| Frequência urinária | 3% | 1% | |
| Transtorno de micção6 | 3% | 0% | |
| Distúrbios genitais femininos3,7 | 2% | 0% | |
| 1 Eventos relatados por pelo menos 1% dos pacientes
tratados com paroxetina estão incluídos, exceto os seguintes eventos que tiveram um
incidência no placebo ≥ paroxetina: dor abdominal, agitação, dor nas costas,
dor no peito, estimulação do SNC, febre, aumento do apetite, mioclonia, faringite
hipotensão postural, distúrbio respiratório (inclui principalmente "sintomas do resfriado" ou
"URI"), trauma e vômito. 2 Inclui principalmente "golpe na garganta" e "aperto na garganta." 3 Porcentagem corrigida para o sexo. 4 Principalmente “atraso ejaculatório." 5 Inclui "anorgasmia", "dificuldades eréteis", "atrasado ejaculação / orgasmo ”e“ disfunção sexual ”e“ impotência." 6 Inclui principalmente "dificuldade com micção" e "urinária" hesitação." 7 inclui principalmente "anorgasmia" e "dificuldade em alcançar clímax / orgasmo." |
Transtorno obsessivo-compulsivo e Transtorno de pânico
A Tabela 3 enumera adversos eventos que ocorreram com uma frequência de 2% ou mais entre pacientes com TOC paroxetina que participou de ensaios controlados por placebo com duração de 12 semanas em que os pacientes foram administrados na faixa de 20 a 60 mg / dia ou entre os pacientes com DP em paroxetina que participou de estudos controlados por placebo de 10 a Duração de 12 semanas em que os pacientes foram administrados na faixa de 10 a 60 mg / dia.
TABELA 3: Tratamento-emergente
Experiência Adversa Incidência em Ensaios Clínicos Controlados por Placebo para
Transtorno obsessivo-compulsivo e transtorno do pânico1
| Sistema Corporal | Termo preferido | Transtorno obsessivo-compulsivo | Transtorno de pânico | ||
| Paroxetina (n = 542) |
Placebo (n = 265) |
Paroxetina (n = 469) |
Placebo (n = 324) |
||
| Corpo como um todo | Astenia | 22% | 14% | 14% | 5% |
| Dor abdominal | - | - | 4% | 3% | |
| Dor no peito | 3% | 2% | - | - | |
| Dor nas costas | - | - | 3% | 2% | |
| Calafrios | 2% | 1% | 2% | 1% | |
| Cardiovascular | Vasodilatação | 4% | 1% | - | - |
| Palpitações | 2% | 0% | - | - | |
| Dermatológico | Suando | 9% | 3% | 14% | 6% |
| Erupção cutânea | 3% | 2% | - | - | |
| Gastrointestinal | Náusea | 23% | 10% | 23% | 17% |
| Boca seca | 18% | 9% | 18% | 11% | |
| Constipação | 16% | 6% | 8% | 5% | |
| Diarréia | 10% | 10% | 12% | 7% | |
| Apetite diminuído | 9% | 3% | 7% | 3% | |
| Apetite aumentado | 4% | 3% | 2% | 1% | |
| Sistema Nervoso | Insônia | 24% | 13% | 18% | 10% |
| Sonolência | 24% | 7% | 19% | 11% | |
| Tontura | 12% | 6% | 14% | 10% | |
| Tremor | 11% | 1% | 9% | 1% | |
| Nervosismo | 9% | 8% | - | - | |
| Libido diminuiu | 7% | 4% | 9% | 1% | |
| Agitação | - | - | 5% | 4% | |
| Ansiedade | - | - | 5% | 4% | |
| Sonhos anormais | 4% | 1% | - | - | |
| Concentração prejudicada | 3% | 2% | - | - | |
| Despersonalização | 3% | 0% | - | - | |
| Myoclonus | 3% | 0% | 3% | 2% | |
| Amnésia | 2% | 1% | - | - | |
| Sistema Respiratório | Rinite | - | - | 3% | 0% |
| Sentidos especiais | Visão anormal | 4% | 2% | - | - |
| Proversão de sabor | 2% | 0% | - | - | |
| Sistema Urogenital | Ejaculação anormal2 | 23% | 1% | 21% | 1% |
| Transtorno Genital Feminino2 | 3% | 0% | 9% | 1% | |
| Impotência2 | 8% | 1% | 5% | 0% | |
| Frequência urinária | 3% | 1% | 2% | 0% | |
| Urinação prejudicada | 3% | 0% | - | - | |
| Infecção do trato urinário | 2% | 1% | 2% | 1% | |
| 1 Eventos relatados por pelo menos 2% do TOC ou DP
pacientes tratados com paroxetina são incluídos, exceto os seguintes eventos que tiveram incidência de placebo ≥ paroxetina [TOC] :
dor abdominal, agitação, ansiedade, dor nas costas, tosse aumentada, depressão
dor de cabeça, hipercinesia, infecção, parestesia, faringite, respiratória
desordem, rinite e sinusite. [PD]: sonhos anormais, visão anormal
dor no peito, tosse aumentada, despersonalização, depressão, dismenorreia
dispepsia, síndrome da gripe, dor de cabeça, infecção, mialgia, nervosismo
palpitações, parestesia, faringite, erupção cutânea, distúrbio respiratório, sinusite
perversão do paladar, trauma, micção prejudicada e vasodilatação. 2 Porcentagem corrigida para o sexo. |
Transtorno de Ansiedade Generalizada
A Tabela 4 enumera eventos adversos que ocorreram em a frequência de 2% ou mais entre pacientes com DAU em paroxetina que participaram ensaios controlados por placebo com duração de 8 semanas, nos quais os pacientes foram administrados em a intervalo de 10 mg / dia a 50 mg / dia.
TABELA 4: Experiência Adversa Emergente ao Tratamento
Incidência em ensaios clínicos controlados por placebo para ansiedade generalizada
Desordem1
| Sistema Corporal | Termo preferido | Paroxetina (n = 735) |
Placebo (n = 529) |
| Corpo como um todo | Astenia | 14% | 6% |
| Dor de cabeça | 17% | 14% | |
| Infecção | 6% | 3% | |
| Cardiovascular | Vasodilatação | 3% | 1% |
| Dermatológico | Suando | 6% | 2% |
| Gastrointestinal | Náusea | 20% | 5% |
| Boca seca | 11% | 5% | |
| Constipação | 10% | 2% | |
| Diarréia | 9% | 7% | |
| Apetite diminuído | 5% | 1% | |
| Vômitos | 3% | 2% | |
| Sistema Nervoso | Insônia | 11% | 8% |
| Sonolência | 15% | 5% | |
| Tontura | 6% | 5% | |
| Tremor | 5% | 1% | |
| Nervosismo | 4% | 3% | |
| Libido diminuiu | 9% | 2% | |
| Sistema Respiratório | Transtorno Respiratório | 7% | 5% |
| Sinusite | 4% | 3% | |
| Bocejo | 4% | - | |
| Sentidos especiais | Visão anormal | 2% | 1% |
| Sistema Urogenital | Ejaculação anormal2 | 25% | 2% |
| Genital feminino2 | 4% | 1% | |
| Impotência do Transtorno2 | 4% | 3% | |
| 1 Eventos relatados por pelo menos 2% do GAD
pacientes tratados com paroxetina estão incluídos, exceto os seguintes eventos
que teve uma incidência no placebo ≥ paroxetina: dor abdominal nas costas
dor, trauma, dispepsia, mialgia e faringite. 2 Porcentagem corrigida para o sexo. |
Dependência da dose de eventos adversos
Uma comparação de eventos adversos taxas em um estudo de dose fixa comparando paroxetina 10, 20, 30 e 40 mg / dia com o placebo no tratamento do MDD revelou uma clara dependência da dose para alguns os eventos adversos mais comuns associados ao uso de paroxetina, conforme mostrado no seguinte tabela:
TABELA 5: Tratamento-emergente
Experiência adversa Incidência em um estudo de comparação de doses no tratamento de
MDD *
| Sistema Corporal / Termo Preferido | Placebo n = 51 |
Paroxetina | |||
| 10 mg n = 102 |
20 mg n = 104 |
30 mg n = 101 |
40 mg n = 102 |
||
| Corpo como um todo | |||||
| Astenia | 0,0% | 2,9% | 10,6% | 13,9% | 12,7% |
| Dermatologia | |||||
| Suando | 2,0% | 1,0% | 6,7% | 8,9% | 11,8% |
| Gastrointestinal | |||||
| Constipação | 5,9% | 4,9% | 7,7% | 9,9% | 12,7% |
| Apetite diminuído | 2,0% | 2,0% | 5,8% | 4,0% | 4,9% |
| Diarréia | 7,8% | 9,8% | 19,2% | 7,9% | 14,7% |
| Boca seca | 2,0% | 10,8% | 18,3% | 15,8% | 20,6% |
| Náusea | 13,7% | 14,7% | 26,9% | 34,7% | 36,3% |
| Sistema Nervoso | |||||
| Ansiedade | 0,0% | 2,0% | 5,8% | 5,9% | 5,9% |
| Tontura | 3,9% | 6,9% | 6,7% | 8,9% | 12,7% |
| Nervosismo | 0,0% | 5,9% | 5,8% | 4,0% | 2,9% |
| Parestesia | 0,0% | 2,9% | 1,0% | 5,0% | 5,9% |
| Sonolência | 7,8% | 12,7% | 18,3% | 20,8% | 21,6% |
| Tremor | 0,0% | 0,0% | 7,7% | 7,9% | 14,7% |
| Sentidos especiais | |||||
| Visão turva | 2,0% | 2,9% | 2,9% | 2,0% | 7,8% |
| Sistema Urogenital | |||||
| Ejaculação anormal | 0,0% | 5,8% | 6,5% | 10,6% | 13,0% |
| Impotência | 0,0% | 1,9% | 4,3% | 6,4% | 1,9% |
| Distúrbios genitais masculinos | 0,0% | 3.8 | 8,7% | 6,4% | 3,7% |
| * Regra para incluir adversos eventos na tabela: incidência de pelo menos 5% para um dos grupos paroxetina e ≥ duas vezes a incidência de placebo para pelo menos um grupo de paroxetina. | |||||
Em um estudo de dose fixa comparando placebo e paroxetina 20, 40 e 60 mg no tratamento do TOC, não houve clara relação entre eventos adversos e a dose de paroxetina à qual pacientes foram designados. Não foram observados novos eventos adversos na paroxetina Grupo de dose de 60 mg em comparação com qualquer um dos outros grupos de tratamento.
Em um estudo de dose fixa comparando placebo e paroxetina 10, 20 e 40 mg no tratamento da DP, não houve clara relação entre eventos adversos e a dose de paroxetina à qual pacientes foram designados, exceto astenia, boca seca, ansiedade, libido diminuição, tremor e ejaculação anormal. Em estudos de doses flexíveis, não há novidades eventos adversos foram observados em pacientes recebendo 60 mg de paroxetina em comparação para qualquer outro grupo de tratamento.
Em um estudo de dose fixa comparando placebo e 20 e 40 mg de paroxetina no tratamento de DAU, durante a maior parte do tempo eventos adversos, não havia uma relação clara entre eventos adversos e o dose de paroxetina à qual os pacientes foram designados, exceto o seguinte eventos adversos: astenia, constipação e ejaculação anormal.
Em estudos de doses flexíveis, não novos eventos adversos foram observados em pacientes recebendo paroxetina 60 mg comparado a qualquer outro grupo de tratamento.
Adaptação a Certas Eventos adversos: Durante um período de 4 a 6 semanas, houve evidências de adaptação a alguns eventos adversos com terapia continuada (por exemplo, náusea e tontura), mas menos para outros efeitos (por exemplo, boca seca, sonolência e astenia).
Sexual masculino e feminino Disfunção com SSRIs: Embora mudanças no desejo sexual, desempenho sexual e a satisfação sexual geralmente ocorre como manifestações de um distúrbio psiquiátrico eles também podem ser uma conseqüência do tratamento farmacológico. Em particular, alguns evidências sugerem que os ISRSs podem causar experiências sexuais desagradáveis.
Estimativas confiáveis do incidência e gravidade de experiências desagradáveis envolvendo desejo sexual desempenho e satisfação são difíceis de obter, no entanto, em parte porque pacientes e médicos podem relutar em discuti-los. Consequentemente, estimativas da incidência de experiência e desempenho sexual indesejáveis citados na rotulagem do produto é provável que subestime sua incidência real.
Em clínica controlada por placebo ensaios envolvendo mais de 3200 pacientes, os intervalos para a incidência relatada de efeitos colaterais sexuais em homens e mulheres com MDD, TOC, DP, ansiedade social desordem, TAG e transtorno de estresse pós-traumático (TEPT) são exibidos na Tabela 6.
TABELA 6: Incidência de
Eventos adversos sexuais em ensaios clínicos controlados
| Paroxetina | Placebo | |
| n (homens) | 1446 | 1042 |
| Libido diminuído | 6% -15% | 0% - 5% |
| Perturbação ejaculatória | 13% -28% | 0% - 2% |
| Impotência | 2% - 9% | 0% - 3% |
| n (mulheres) | 1822 | 1340 |
| Libido diminuído | 0% - 9% | 0% - 2% |
| Perturbação orgásmica | 2% - 9% | 0% - 1% |
Não há adequado e estudos bem controlados que examinam a disfunção sexual com tratamento com paroxetina.
O tratamento com paroxetina tem sido associado a vários casos de priapismo. Nesses casos, com um resultado conhecido pacientes recuperados sem sequelas.
Embora seja difícil saber o risco preciso de disfunção sexual associada ao uso de ISRSs os médicos devem consultar rotineiramente sobre esses possíveis efeitos colaterais.
Peso e sinal vital Alterações: Perda de peso significativa pode ser um resultado indesejável do tratamento com paroxetina em alguns pacientes, mas em diante em média, os pacientes em ensaios controlados tiveram uma perda de peso mínima (cerca de 1 libra) vs alterações menores no placebo e controle ativo. Nenhuma mudança significativa em sinais vitais (pressão arterial sistólica e diastólica, pulso e temperatura) foram observados em pacientes tratados com paroxetina em clínica controlada ensaios.
Alterações no ECG: Em uma análise dos ECGs obtidos em 682 pacientes tratados com paroxetina e 415 pacientes tratados com placebo ensaios clínicos controlados, não foram observadas alterações clinicamente significativas no ECGs de qualquer grupo.
Testes de função hepática: Em controlado por placebo ensaios clínicos, pacientes tratados com paroxetina exibiram valores anormais testes de função hepática em taxa não superior à observada em tratados com placebo pacientes. Em particular, as comparações de paroxetina vs placebo para alcalino fosfatase, SGOT, SGPT e bilirrubina não revelaram diferenças no porcentagem de pacientes com anormalidades acentuadas.
Alucinações: Em ensaios clínicos combinados de cloridrato de paroxetina de liberação imediata, alucinações foram observadas em 22 de 9089 pacientes recebendo medicamento e 4 de 3187 pacientes recebendo placebo.
Outros eventos observados durante a avaliação de pré-comercialização de Paroxetina
Durante sua avaliação de pré-comercialização no MDD, doses múltiplas de paroxetina foram administrados a 6145 pacientes em estudos de fase 2 e 3. O as condições e a duração da exposição à paroxetina variaram bastante e incluíram (em categorias sobrepostas) estudos abertos e duplo-cegos, não controlados e estudos controlados, estudos de pacientes internados e ambulatoriais e doses fixas e estudos de titulação. Durante os ensaios clínicos pré-comercialização em TOC, DP e GAD, 542, 469 e 735 pacientes, respectivamente, receberam doses múltiplas de paroxetina. Eventos indesejáveis associados a essa exposição foram registrados por investigadores clínicos usando terminologia de sua própria escolha. Consequentemente, não é possível fornecer uma estimativa significativa da proporção de indivíduos que experimentam eventos adversos sem primeiro agrupar tipos semelhantes de eventos indesejáveis em um número menor de categorias de eventos padronizadas.
Nas tabulações a seguir, relataram eventos adversos foram classificados usando uma terminologia padrão do dicionário baseada em COSTART. O as frequências apresentadas representam, portanto, a proporção dos 9089 pacientes exposto a várias doses de paroxetina que sofreram um evento do tipo citado em pelo menos uma ocasião ao receber paroxetina. Todos os eventos relatados estão incluídos, exceto aqueles já listados nas Tabelas 2 a 4, aqueles relatados em termos tão gerais que não são informativos e aqueles eventos em que uma droga causa era remoto.
É importante enfatizar isso, embora os eventos relatados ocorreram durante o tratamento com paroxetina, eles não eram necessariamente causado por ele.
Os eventos são categorizados ainda mais pelo sistema corporal e listados em ordem de diminuir
Categoria de gravidez D (Vejo AVISO - Uso na gravidez: Efeitos teratogênicos e não teratogênicos).
Associado à descontinuação do tratamento
Vinte por cento (1199/6145) dos pacientes tratados paroxetina em ensaios clínicos mundiais em MDD e 11,8% (64/542), 9,4% (44/469) e 10,7% (79/735) dos pacientes tratados com paroxetina em todo o mundo ensaios em TOC, DP e GAD, respectivamente, interromperam o tratamento devido a um evento adverso. Os eventos mais comuns (≥ 1%) associados descontinuação e considerado relacionado a medicamentos (ou seja, os eventos associados com abandono a uma taxa aproximadamente duas vezes ou mais para paroxetina em comparação para placebo) incluiu o seguinte :
| MDD | TOC | PD | TAG | |||||
| Paroxetina | Placebo | Paroxetina | Placebo | Paroxetina | Placebo | Paroxetina | Placebo | |
| CNS | ||||||||
| Sonolência | 2,3% | 0,7% | - | - | 1,9% | 0,3% | 2,0% | 0,2% |
| Insônia | - | - | 1,7% | 0% | 1,3% | 0,3% | - | - |
| Agitação | 1,1% | 0,5% | - | - | - | - | - | - |
| Tremor | 1,1% | 0,3% | - | |||||
| Tontura | - | - | 1,5% | 0% | - | - | 1,0% | 0,2% |
| Gastrointestinal | ||||||||
| Constipação | - | - | 1,1% | 0% | - | - | - | - |
| Náusea | 3,2% | 1,1% | 1,9% | 0% | 3,2% | 1,2% | 2,0% | 0,2% |
| Diarréia | 1,0% | 0,3% | - | - | - | - | - | - |
| Boca seca | 1,0% | 0,3% | - | - | - | - | - | - |
| Vômitos | 1,0% | 0,3% | - | - | - | - | - | - |
| De outros | ||||||||
| Astenia | 1,6% | 0,4% | 1,9% | 0,4% | - | - | 1,8% | 0,2% |
| Anormal | 1,6% | 0% | 2,1% | 0% | - | - | 2,5% | 0,5% |
| Ejaculação1 | ||||||||
| Suando | 1,0% | 0,3% | - | - | - | - | 1,1% | 0,2% |
| Impotência1 | - | - | 1,5% | 0% | - | - | - | - |
| Onde os números não são fornecidos, a incidência do
eventos adversos em pacientes tratados com paroxetina não foram> 1% ou não foram
maior ou igual a duas vezes a incidência de placebo. 1 Incidência corrigida para gênero. |
||||||||
Eventos adversos comumente observados
Transtorno Depressivo Maior
O mais comumente observado eventos adversos associados ao uso de paroxetina (incidência de 5% ou maior e incidência de paroxetina pelo menos duas vezes a do placebo, derivada da Tabela 2 abaixo) foram: astenia, sudorese, náusea, diminuição do apetite sonolência, tontura, insônia, tremor, nervosismo, distúrbio ejaculatório e outros distúrbios genitais masculinos.
Transtorno obsessivo-compulsivo
O mais comumente observado eventos adversos associados ao uso de paroxetina (incidência de 5% ou maior e incidência de paroxetina pelo menos duas vezes a do placebo, derivada da Tabela 3 abaixo) foram: náusea, boca seca, diminuição do apetite, constipação tontura, sonolência, tremor, sudorese, impotência e ejaculação anormal.
Transtorno de pânico
O mais comumente observado eventos adversos associados ao uso de paroxetina (incidência de 5% ou maior e incidência de paroxetina pelo menos duas vezes a do placebo, derivada da Tabela 3 abaixo) foram: astenia, sudorese, diminuição do apetite, libido diminuição, tremor, ejaculação anormal, distúrbios genitais femininos e impotência.
Transtorno de Ansiedade Generalizada
O mais comumente observado eventos adversos associados ao uso de paroxetina (incidência de 5% ou maior e incidência de paroxetina pelo menos duas vezes a do placebo, derivada da Tabela 4) foram: astenia, infecção, constipação, diminuição do apetite, seco boca, náusea, libido diminuída, sonolência, tremor, sudorese e anormal ejaculação.
Incidência em ensaios clínicos controlados
O prescritor deve estar ciente de que as figuras no as tabelas a seguir não podem ser usadas para prever a incidência de efeitos colaterais no curso da prática médica usual, onde características do paciente e outras os fatores diferem daqueles que prevaleceram nos ensaios clínicos. Da mesma forma, o as frequências citadas não podem ser comparadas com as figuras obtidas de outras clínicas investigações envolvendo diferentes tratamentos, usos e investigadores. O os números citados, no entanto, fornecem ao médico prescritor alguma base para estimar a contribuição relativa de fatores medicamentosos e não medicamentosos para o taxa de incidência de efeitos colaterais nas populações estudadas.
Transtorno Depressivo Maior
A Tabela 2 enumera eventos adversos que ocorreram em um incidência de 1% ou mais entre pacientes tratados com paroxetina que participaram ensaios controlados por placebo a curto prazo (6 semanas), nos quais os pacientes foram administrados em um intervalo de 20 a 50 mg / dia. Os eventos adversos relatados foram classificados usando a terminologia padrão do dicionário baseado em COSTART.
TABELA 2: Experiência Adversa Emergente ao Tratamento
Incidência em ensaios clínicos controlados por placebo para MDD1
| Sistema Corporal | Termo preferido | Paroxetina (n = 421) |
Placebo (n = 421) |
| Corpo como um todo | Dor de cabeça | 18% | 17% |
| Astenia | 15% | 6% | |
| Cardiovascular | Palpitações | 3% | 1% |
| Vasodilatação | 3% | 1% | |
| Dermatológico | Suando | 11% | 2% |
| Erupção cutânea | 2% | 1% | |
| Gastrointestinal | Náusea | 26% | 9% |
| Boca seca | 18% | 12% | |
| Constipação | 14% | 9% | |
| Diarréia | 12% | 8% | |
| Apetite diminuído | 6% | 2% | |
| Flatulência | 4% | 2% | |
| Transtorno da Orofaringe2 | 2% | 0% | |
| Dispepsia | 2% | 1% | |
| Musculoesquelético | Miopatia | 2% | 1% |
| Mialgia | 2% | 1% | |
| Miastenia | 1% | 0% | |
| Sistema Nervoso | Sonolência | 23% | 9% |
| Tontura | 13% | 6% | |
| Insônia | 13% | 6% | |
| Tremor | 8% | 2% | |
| Nervosismo | 5% | 3% | |
| Ansiedade | 5% | 3% | |
| Parestesia | 4% | 2% | |
| Libido diminuiu | 3% | 0% | |
| Sentimento drogado | 2% | 1% | |
| Confusão | 1% | 0% | |
| Respiração | Bocejo | 4% | 0% |
| Sentidos especiais | Visão turva | 4% | 1% |
| Proversão de sabor | 2% | 0% | |
| Sistema Urogenital | Perturbação ejaculatória3,4 | 13% | 0% |
| Outros distúrbios genitais masculinos3,5 | 10% | 0% | |
| Frequência urinária | 3% | 1% | |
| Transtorno de micção6 | 3% | 0% | |
| Distúrbios genitais femininos3,7 | 2% | 0% | |
| 1 Eventos relatados por pelo menos 1% dos pacientes
tratados com paroxetina estão incluídos, exceto os seguintes eventos que tiveram um
incidência no placebo ≥ paroxetina: dor abdominal, agitação, dor nas costas,
dor no peito, estimulação do SNC, febre, aumento do apetite, mioclonia, faringite
hipotensão postural, distúrbio respiratório (inclui principalmente "sintomas do resfriado" ou
"URI"), trauma e vômito. 2 Inclui principalmente "golpe na garganta" e "aperto na garganta." 3 Porcentagem corrigida para o sexo. 4 Principalmente “atraso ejaculatório." 5 Inclui "anorgasmia", "dificuldades eréteis", "atrasado ejaculação / orgasmo ”e“ disfunção sexual ”e“ impotência." 6 Inclui principalmente "dificuldade com micção" e "urinária" hesitação." 7 inclui principalmente "anorgasmia" e "dificuldade em alcançar clímax / orgasmo." |
Transtorno obsessivo-compulsivo e Transtorno de pânico
A Tabela 3 enumera adversos eventos que ocorreram com uma frequência de 2% ou mais entre pacientes com TOC paroxetina que participou de ensaios controlados por placebo com duração de 12 semanas em que os pacientes foram administrados na faixa de 20 a 60 mg / dia ou entre os pacientes com DP em paroxetina que participou de estudos controlados por placebo de 10 a Duração de 12 semanas em que os pacientes foram administrados na faixa de 10 a 60 mg / dia.
TABELA 3: Tratamento-emergente
Experiência Adversa Incidência em Ensaios Clínicos Controlados por Placebo para
Transtorno obsessivo-compulsivo e transtorno do pânico1
| Sistema Corporal | Termo preferido | Transtorno obsessivo-compulsivo | Transtorno de pânico | ||
| Paroxetina (n = 542) |
Placebo (n = 265) |
Paroxetina (n = 469) |
Placebo (n = 324) |
||
| Corpo como um todo | Astenia | 22% | 14% | 14% | 5% |
| Dor abdominal | - | - | 4% | 3% | |
| Dor no peito | 3% | 2% | - | - | |
| Dor nas costas | - | - | 3% | 2% | |
| Calafrios | 2% | 1% | 2% | 1% | |
| Cardiovascular | Vasodilatação | 4% | 1% | - | - |
| Palpitações | 2% | 0% | - | - | |
| Dermatológico | Suando | 9% | 3% | 14% | 6% |
| Erupção cutânea | 3% | 2% | - | - | |
| Gastrointestinal | Náusea | 23% | 10% | 23% | 17% |
| Boca seca | 18% | 9% | 18% | 11% | |
| Constipação | 16% | 6% | 8% | 5% | |
| Diarréia | 10% | 10% | 12% | 7% | |
| Apetite diminuído | 9% | 3% | 7% | 3% | |
| Apetite aumentado | 4% | 3% | 2% | 1% | |
| Sistema Nervoso | Insônia | 24% | 13% | 18% | 10% |
| Sonolência | 24% | 7% | 19% | 11% | |
| Tontura | 12% | 6% | 14% | 10% | |
| Tremor | 11% | 1% | 9% | 1% | |
| Nervosismo | 9% | 8% | - | - | |
| Libido diminuiu | 7% | 4% | 9% | 1% | |
| Agitação | - | - | 5% | 4% | |
| Ansiedade | - | - | 5% | 4% | |
| Sonhos anormais | 4% | 1% | - | - | |
| Concentração prejudicada | 3% | 2% | - | - | |
| Despersonalização | 3% | 0% | - | - | |
| Myoclonus | 3% | 0% | 3% | 2% | |
| Amnésia | 2% | 1% | - | - | |
| Sistema Respiratório | Rinite | - | - | 3% | 0% |
| Sentidos especiais | Visão anormal | 4% | 2% | - | - |
| Proversão de sabor | 2% | 0% | - | - | |
| Sistema Urogenital | Ejaculação anormal2 | 23% | 1% | 21% | 1% |
| Transtorno Genital Feminino2 | 3% | 0% | 9% | 1% | |
| Impotência2 | 8% | 1% | 5% | 0% | |
| Frequência urinária | 3% | 1% | 2% | 0% | |
| Urinação prejudicada | 3% | 0% | - | - | |
| Infecção do trato urinário | 2% | 1% | 2% | 1% | |
| 1 Eventos relatados por pelo menos 2% do TOC ou DP
pacientes tratados com paroxetina são incluídos, exceto os seguintes eventos que tiveram incidência de placebo ≥ paroxetina [TOC] :
dor abdominal, agitação, ansiedade, dor nas costas, tosse aumentada, depressão
dor de cabeça, hipercinesia, infecção, parestesia, faringite, respiratória
desordem, rinite e sinusite. [PD]: sonhos anormais, visão anormal
dor no peito, tosse aumentada, despersonalização, depressão, dismenorreia
dispepsia, síndrome da gripe, dor de cabeça, infecção, mialgia, nervosismo
palpitações, parestesia, faringite, erupção cutânea, distúrbio respiratório, sinusite
perversão do paladar, trauma, micção prejudicada e vasodilatação. 2 Porcentagem corrigida para o sexo. |
Transtorno de Ansiedade Generalizada
A Tabela 4 enumera eventos adversos que ocorreram em a frequência de 2% ou mais entre pacientes com DAU em paroxetina que participaram ensaios controlados por placebo com duração de 8 semanas, nos quais os pacientes foram administrados em a intervalo de 10 mg / dia a 50 mg / dia.
TABELA 4: Experiência Adversa Emergente ao Tratamento
Incidência em ensaios clínicos controlados por placebo para ansiedade generalizada
Desordem1
| Sistema Corporal | Termo preferido | Paroxetina (n = 735) |
Placebo (n = 529) |
| Corpo como um todo | Astenia | 14% | 6% |
| Dor de cabeça | 17% | 14% | |
| Infecção | 6% | 3% | |
| Cardiovascular | Vasodilatação | 3% | 1% |
| Dermatológico | Suando | 6% | 2% |
| Gastrointestinal | Náusea | 20% | 5% |
| Boca seca | 11% | 5% | |
| Constipação | 10% | 2% | |
| Diarréia | 9% | 7% | |
| Apetite diminuído | 5% | 1% | |
| Vômitos | 3% | 2% | |
| Sistema Nervoso | Insônia | 11% | 8% |
| Sonolência | 15% | 5% | |
| Tontura | 6% | 5% | |
| Tremor | 5% | 1% | |
| Nervosismo | 4% | 3% | |
| Libido diminuiu | 9% | 2% | |
| Sistema Respiratório | Transtorno Respiratório | 7% | 5% |
| Sinusite | 4% | 3% | |
| Bocejo | 4% | - | |
| Sentidos especiais | Visão anormal | 2% | 1% |
| Sistema Urogenital | Ejaculação anormal2 | 25% | 2% |
| Genital feminino2 | 4% | 1% | |
| Impotência do Transtorno2 | 4% | 3% | |
| 1 Eventos relatados por pelo menos 2% do GAD
pacientes tratados com paroxetina estão incluídos, exceto os seguintes eventos
que teve uma incidência no placebo ≥ paroxetina: dor abdominal nas costas
dor, trauma, dispepsia, mialgia e faringite. 2 Porcentagem corrigida para o sexo. |
Dependência da dose de eventos adversos
Uma comparação de eventos adversos taxas em um estudo de dose fixa comparando paroxetina 10, 20, 30 e 40 mg / dia com o placebo no tratamento do MDD revelou uma clara dependência da dose para alguns os eventos adversos mais comuns associados ao uso de paroxetina, conforme mostrado no seguinte tabela:
TABELA 5: Tratamento-emergente
Experiência adversa Incidência em um estudo de comparação de doses no tratamento de
MDD *
| Sistema Corporal / Termo Preferido | Placebo n = 51 |
Paroxetina | |||
| 10 mg n = 102 |
20 mg n = 104 |
30 mg n = 101 |
40 mg n = 102 |
||
| Corpo como um todo | |||||
| Astenia | 0,0% | 2,9% | 10,6% | 13,9% | 12,7% |
| Dermatologia | |||||
| Suando | 2,0% | 1,0% | 6,7% | 8,9% | 11,8% |
| Gastrointestinal | |||||
| Constipação | 5,9% | 4,9% | 7,7% | 9,9% | 12,7% |
| Apetite diminuído | 2,0% | 2,0% | 5,8% | 4,0% | 4,9% |
| Diarréia | 7,8% | 9,8% | 19,2% | 7,9% | 14,7% |
| Boca seca | 2,0% | 10,8% | 18,3% | 15,8% | 20,6% |
| Náusea | 13,7% | 14,7% | 26,9% | 34,7% | 36,3% |
| Sistema Nervoso | |||||
| Ansiedade | 0,0% | 2,0% | 5,8% | 5,9% | 5,9% |
| Tontura | 3,9% | 6,9% | 6,7% | 8,9% | 12,7% |
| Nervosismo | 0,0% | 5,9% | 5,8% | 4,0% | 2,9% |
| Parestesia | 0,0% | 2,9% | 1,0% | 5,0% | 5,9% |
| Sonolência | 7,8% | 12,7% | 18,3% | 20,8% | 21,6% |
| Tremor | 0,0% | 0,0% | 7,7% | 7,9% | 14,7% |
| Sentidos especiais | |||||
| Visão turva | 2,0% | 2,9% | 2,9% | 2,0% | 7,8% |
| Sistema Urogenital | |||||
| Ejaculação anormal | 0,0% | 5,8% | 6,5% | 10,6% | 13,0% |
| Impotência | 0,0% | 1,9% | 4,3% | 6,4% | 1,9% |
| Distúrbios genitais masculinos | 0,0% | 3.8 | 8,7% | 6,4% | 3,7% |
| * Regra para incluir adversos eventos na tabela: incidência de pelo menos 5% para um dos grupos paroxetina e ≥ duas vezes a incidência de placebo para pelo menos um grupo de paroxetina. | |||||
Em um estudo de dose fixa comparando placebo e paroxetina 20, 40 e 60 mg no tratamento do TOC, não houve clara relação entre eventos adversos e a dose de paroxetina à qual pacientes foram designados. Não foram observados novos eventos adversos na paroxetina Grupo de dose de 60 mg em comparação com qualquer um dos outros grupos de tratamento.
Em um estudo de dose fixa comparando placebo e paroxetina 10, 20 e 40 mg no tratamento da DP, não houve clara relação entre eventos adversos e a dose de paroxetina à qual pacientes foram designados, exceto astenia, boca seca, ansiedade, libido diminuição, tremor e ejaculação anormal. Em estudos de doses flexíveis, não há novidades eventos adversos foram observados em pacientes recebendo 60 mg de paroxetina em comparação para qualquer outro grupo de tratamento.
Em um estudo de dose fixa comparando placebo e 20 e 40 mg de paroxetina no tratamento de DAU, durante a maior parte do tempo eventos adversos, não havia uma relação clara entre eventos adversos e o dose de paroxetina à qual os pacientes foram designados, exceto o seguinte eventos adversos: astenia, constipação e ejaculação anormal.
Em estudos de doses flexíveis, não novos eventos adversos foram observados em pacientes recebendo paroxetina 60 mg comparado a qualquer outro grupo de tratamento.
Adaptação a Certas Eventos adversos: Durante um período de 4 a 6 semanas, houve evidências de adaptação a alguns eventos adversos com terapia continuada (por exemplo, náusea e tontura), mas menos para outros efeitos (por exemplo, boca seca, sonolência e astenia).
Sexual masculino e feminino Disfunção com SSRIs: Embora mudanças no desejo sexual, desempenho sexual e a satisfação sexual geralmente ocorre como manifestações de um distúrbio psiquiátrico eles também podem ser uma conseqüência do tratamento farmacológico. Em particular, alguns evidências sugerem que os ISRSs podem causar experiências sexuais desagradáveis.
Estimativas confiáveis do incidência e gravidade de experiências desagradáveis envolvendo desejo sexual desempenho e satisfação são difíceis de obter, no entanto, em parte porque pacientes e médicos podem relutar em discuti-los. Consequentemente, estimativas da incidência de experiência e desempenho sexual indesejáveis citados na rotulagem do produto é provável que subestime sua incidência real.
Em clínica controlada por placebo ensaios envolvendo mais de 3200 pacientes, os intervalos para a incidência relatada de efeitos colaterais sexuais em homens e mulheres com MDD, TOC, DP, ansiedade social desordem, TAG e transtorno de estresse pós-traumático (TEPT) são exibidos na Tabela 6.
TABELA 6: Incidência de
Eventos adversos sexuais em ensaios clínicos controlados
| Paroxetina | Placebo | |
| n (homens) | 1446 | 1042 |
| Libido diminuído | 6% -15% | 0% - 5% |
| Perturbação ejaculatória | 13% -28% | 0% - 2% |
| Impotência | 2% - 9% | 0% - 3% |
| n (mulheres) | 1822 | 1340 |
| Libido diminuído | 0% - 9% | 0% - 2% |
| Perturbação orgásmica | 2% - 9% | 0% - 1% |
Não há adequado e estudos bem controlados que examinam a disfunção sexual com tratamento com paroxetina.
O tratamento com paroxetina tem sido associado a vários casos de priapismo. Nesses casos, com um resultado conhecido pacientes recuperados sem sequelas.
Embora seja difícil saber o risco preciso de disfunção sexual associada ao uso de ISRSs os médicos devem consultar rotineiramente sobre esses possíveis efeitos colaterais.
Peso e sinal vital Alterações: Perda de peso significativa pode ser um resultado indesejável do tratamento com paroxetina em alguns pacientes, mas em diante em média, os pacientes em ensaios controlados tiveram uma perda de peso mínima (cerca de 1 libra) vs alterações menores no placebo e controle ativo. Nenhuma mudança significativa em sinais vitais (pressão arterial sistólica e diastólica, pulso e temperatura) foram observados em pacientes tratados com paroxetina em clínica controlada ensaios.
Alterações no ECG: Em uma análise dos ECGs obtidos em 682 pacientes tratados com paroxetina e 415 pacientes tratados com placebo ensaios clínicos controlados, não foram observadas alterações clinicamente significativas no ECGs de qualquer grupo.
Testes de função hepática: Em controlado por placebo ensaios clínicos, pacientes tratados com paroxetina exibiram valores anormais testes de função hepática em taxa não superior à observada em tratados com placebo pacientes. Em particular, as comparações de paroxetina vs placebo para alcalino fosfatase, SGOT, SGPT e bilirrubina não revelaram diferenças no porcentagem de pacientes com anormalidades acentuadas.
Alucinações: Em ensaios clínicos combinados de cloridrato de paroxetina de liberação imediata, alucinações foram observadas em 22 de 9089 pacientes recebendo medicamento e 4 de 3187 pacientes recebendo placebo.
Outros eventos observados durante a avaliação de pré-comercialização de Paroxetina
Durante sua avaliação de pré-comercialização no MDD, doses múltiplas de paroxetina foram administrados a 6145 pacientes em estudos de fase 2 e 3. O as condições e a duração da exposição à paroxetina variaram bastante e incluíram (em categorias sobrepostas) estudos abertos e duplo-cegos, não controlados e estudos controlados, estudos de pacientes internados e ambulatoriais e doses fixas e estudos de titulação. Durante os ensaios clínicos pré-comercialização em TOC, DP e GAD, 542, 469 e 735 pacientes, respectivamente, receberam doses múltiplas de paroxetina. Eventos indesejáveis associados a essa exposição foram registrados por investigadores clínicos usando terminologia de sua própria escolha. Consequentemente, não é possível fornecer uma estimativa significativa da proporção de indivíduos que experimentam eventos adversos sem primeiro agrupar tipos semelhantes de eventos indesejáveis em um número menor de categorias de eventos padronizadas.
Nas tabulações a seguir, relataram eventos adversos foram classificados usando uma terminologia padrão do dicionário baseada em COSTART. O as frequências apresentadas representam, portanto, a proporção dos 9089 pacientes exposto a várias doses de paroxetina que sofreram um evento do tipo citado em pelo menos uma ocasião ao receber paroxetina. Todos os eventos relatados estão incluídos, exceto aqueles já listados nas Tabelas 2 a 4, aqueles relatados em termos tão gerais que não são informativos e aqueles eventos em que uma droga causa era remoto.
É importante enfatizar isso, embora os eventos relatados ocorreram durante o tratamento com paroxetina, eles não eram necessariamente causado por ele.
Os eventos são categorizados ainda mais pelo sistema corporal e listados em ordem decrescente de frequência de acordo com
Experiência humana
Desde a introdução da paroxetina nos EUA, 342 casos espontâneos de superdosagem deliberada ou acidental durante a paroxetina tratamento foi relatado em todo o mundo (por volta de 1999). Isso inclui overdoses apenas com paroxetina e em combinação com outras substâncias. Destes, 48 os casos foram fatais e, das mortes, 17 pareciam envolver paroxetina sozinho. Oito casos fatais que documentaram a quantidade de paroxetina ingerida foram geralmente confundidos com a ingestão de outras drogas ou álcool ou o presença de condições comórbidas significativas. Dos 145 casos não fatais conhecidos resultado, a maioria se recuperou sem sequelas. A maior ingestão conhecida envolvida 2000 mg de paroxetina (33 vezes a dose diária máxima recomendada) em a paciente que se recuperou.
Eventos adversos comumente relatados associados a superdosagem de paroxetina inclui sonolência, coma, náusea, tremor, taquicardia confusão, vômito e tontura. Outros sinais e sintomas notáveis observados com sobredosagens envolvendo paroxetina (isoladamente ou com outras substâncias) incluem midríase convulsões (incluindo status epiléptico), disritmias ventriculares (incluindo torsade de pointes), hipertensão, reações agressivas, síncope, hipotensão estupor, bradicardia, distonia, rabdomiólise, sintomas de disfunção hepática (incluindo insuficiência hepática, necrose hepática, icterícia, hepatite e hepática esteatose), síndrome da serotonina, reações maníacas, mioclonia, renal aguda falha e retenção urinária.
Gerenciamento de overdosage
Não são conhecidos antídotos específicos para a paroxetina. Tratamento deve consistir nas medidas gerais empregadas na gestão de superdosagem com quaisquer medicamentos eficazes no tratamento de MDD
Garanta uma via aérea, oxigenação e ventilação adequadas. Monitore o ritmo cardíaco e os sinais vitais. Suporte geral e sintomático medidas também são recomendadas. A indução de emese não é recomendada.
Devido ao grande volume de distribuição deste medicamento, diurese forçada, diálise, hemoperfusão e transfusão de troca são improváveis para ser benéfico.
Um cuidado específico envolve pacientes que estão tomando ou tomaram recentemente paroxetina que pode ingerir quantidades excessivas de a antidepressivo tricíclico. Nesse caso, acúmulo de tricíclico original e / ou um metabolito ativo pode aumentar a possibilidade de clinicamente significativo sequelas e prolongar o tempo necessário para uma observação médica rigorosa (ver Drogas Metabolizado pelo citocromo CYP2D6 sob PRECAUÇÕES).
Ao gerenciar a superdosagem, considere a possibilidade de envolvimento múltiplo de drogas. O médico deve considerar entrar em contato com um veneno centro de controle para obter informações adicionais sobre o tratamento de qualquer overdose. Os números de telefone dos centros de controle de intoxicações certificados estão listados nos médicos Referência da mesa (PDR).
A eficácia da paroxetina no tratamento de MDD, TOC presume-se que o transtorno do pânico (DP) e o transtorno de ansiedade generalizada (TAG) sejam ligado à potencialização da atividade serotoninérgica no sistema nervoso central resultante da inibição da recaptação neuronal da serotonina (5-hidroxitriptamina, 5-HT). Estudos em doses clinicamente relevantes em humanos demonstraram que a paroxetina bloqueia a captação de serotonina no ser humano plaquetas. In vitro estudos em animais também sugerem que a paroxetina é um potente e inibidor altamente seletivo da recaptação neuronal de serotonina e tem apenas muito efeitos fracos na recaptação neuronal de noradrenalina e dopamina. In vitro radioligand estudos de ligação indicam que a paroxetina tem pouca afinidade com a muscarínica alfa1-, alfa2-, beta-adrenérgico-, dopamina (D2) -, 5-HT1-, 5-HT2- e receptores de histamina (H1); antagonismo de muscarínico, histaminérgico e receptores alfa1-adrenérgicos tem sido associado a vários anticolinérgicos efeitos sedativos e cardiovasculares para outras drogas psicotrópicas.
Porque as potências relativas da paroxetina são maiores os metabolitos são no máximo 1/50 do composto original, são essencialmente inativo.
O mesilato de paroxetina é completamente absorvido após a oral dosagem do sal de mesilato. Em um estudo em que indivíduos do sexo masculino normais (n = 25) recebeu comprimidos de paroxetina 30 mg diariamente por 24 dias, paroxetina em estado estacionário as concentrações foram alcançadas em aproximadamente 13 dias para a maioria dos indivíduos embora possa demorar substancialmente mais tempo em um paciente ocasional. Na posição firme estado, os valores médios de Cmax, Tmax, Cmin e T½ foram 81,3 ng / ml (CV 41%), 8,1 hr. (CV 56%), 43,2 ng / ml (CV 52%) e 33,2 horas. (CV 52%), respectivamente. O os valores de Cmax e Cmin em estado estacionário eram cerca de 7 e 10 vezes o que seria previsto a partir de estudos de dose única. Exposição a medicamentos em estado estacionário com base na AUC0-24 foi cerca de 10 vezes maior do que o previsto a partir de dados de dose única nesses assuntos. O excesso de acumulação é uma conseqüência do fato disso uma das enzimas que metaboliza a paroxetina é facilmente saturável.
Em estudos de proporcionalidade da dose em estado estacionário envolvendo doentes idosos e idosos, em doses de 20 a 40 mg por dia para idosos e 20 a 50 mg por dia para idosos, foi observada alguma não linearidade ambas as populações, refletindo novamente uma via metabólica saturável. Em comparação aos valores de Cmin após 20 mg por dia, os valores após 40 mg foram apenas de 2 a 3 vezes maior que dobrou.
Os efeitos dos alimentos na biodisponibilidade da paroxetina foram estudados em indivíduos que receberam uma dose única com e sem alimentos. AUC aumentou apenas ligeiramente (6%) quando o medicamento foi administrado com alimentos, mas a Cmax foi 29% maior, enquanto o tempo para atingir o pico da concentração plasmática diminuiu de 6,4 horas após a administração a 4,9 horas.
A paroxetina é extensamente metabolizada após a oral administração. Os principais metabólitos são produtos polares e conjugados de oxidação e metilação, que são prontamente limpas. Conjugados com predominam o ácido glucurônico e o sulfato, e os principais metabólitos foram isolado e identificado. Os dados indicam que os metabólitos não têm mais que 1/50 da potência do composto original na inibição da captação de serotonina. O o metabolismo da paroxetina é realizado em parte pelo citocromo CYP2D6. A saturação desta enzima em doses clínicas parece ser responsável pelo não linearidade da cinética da paroxetina com doses crescentes e aumentando duração do tratamento. O papel dessa enzima no metabolismo da paroxetina também sugere possíveis interações medicamentosas (ver PRECAUÇÕES).
Aproximadamente 64% de uma dose de solução oral de 30 mg a paroxetina foi excretada na urina com 2% como composto original e 62% como metabolitos durante um período pós-dosagem de 10 dias. Cerca de 36% foram excretados no fezes (provavelmente através da bílis), principalmente como metabólitos e menos de 1% como o composto original durante o período pós-dosagem de 10 dias.
Em uma metanálise de paroxetina de 4 estudos realizados em voluntários saudáveis após doses múltiplas de 20 mg / dia a 40 mg / dia, homens não exibia uma Cmax ou AUC significativamente menor do que as mulheres.
Distribuição
A paroxetina distribui por todo o corpo, incluindo o SNC, com apenas 1% restantes no plasma.
Ligação às proteínas
Aproximadamente 95% e 93% da paroxetina estão ligados proteína plasmática a 100 ng / ml e 400 ng / ml, respectivamente. Sob clínica condições, as concentrações de paroxetina seriam normalmente inferiores a 400 ng / ml. A paroxetina não altera a in vitro ligação às proteínas de fenitoína ou varfarina.
Doença renal e hepática
Ocorrem concentrações plasmáticas aumentadas de paroxetina indivíduos com insuficiência renal e hepática. As concentrações plasmáticas médias em pacientes com depuração da creatinina abaixo de 30 ml / min foram aproximadamente 4 vezes maior do que o visto em voluntários normais. Pacientes com depuração da creatinina de 30 a 60 ml / min e pacientes com insuficiência funcional hepática apresentaram cerca de a Aumento de 2 vezes nas concentrações plasmáticas (AUC, Cmax).
A dosagem inicial deve, portanto, ser reduzida pacientes com insuficiência renal ou hepática grave e titulação ascendente, se necessário, deve estar em intervalos aumentados (ver DOSAGEM E ADMINISTRAÇÃO).
Pacientes idosos
Em um estudo de doses múltiplas em idosos diariamente doses de paroxetina de 20, 30 e 40 mg, as concentrações de Cmin foram de cerca de 70% 80% maior que as respectivas concentrações de Cmin em indivíduos não idosos. Portanto, a dose inicial em idosos deve ser reduzida (ver DOSAGEM E ADMINISTRAÇÃO).


