












































Composition:
Application:
Utilisé dans le traitement:
Examiné médicalement par Militian Inessa Mesropovna, Pharmacie Dernière mise à jour le 26.06.2023

Attention! Information sur la page est réservée aux professionnels de la santé! Les informations sont collectées dans des sources ouvertes et peuvent contenir des erreurs significatives! Soyez prudent et revérifiez toutes les informations de cette page!
Top 20 des médicaments avec les mêmes ingrédients:


Formes posologiques et forces
Capsules
- 2 mg: corps opaque bleu clair avec un capuchon opaque bleu clair avec «2 MG» imprimé sur le capuchon
- 4 mg: corps blanc opaque avec un capuchon bleu opaque avec «4 MG »imprimé sur le capuchon
- 6 mg: corps bleu opaque avec une bande blanche et bleue capuchon opaque avec «6 MG» imprimé sur le capuchon
Comprimés
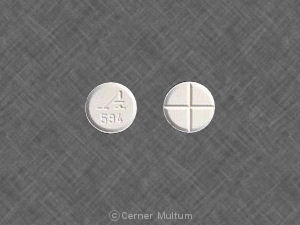
- Comprimés blancs non enrobés à 4 mg avec un score de quadritection d'un côté et gravé «A594» de l'autre côté
Stockage et manutention
Zanaflex Capsules®
Capsules Zanaflex® (chlorhydrate de tizanidine) gélules sont disponibles en trois dosages sous forme de gélules de gélatine dure en deux parties contenant chlorhydrate de tizanidine 2,29 mg, 4,58 mg et 6,87 mg, équivalent à 2 mg, 4 mg et 6 mg de base de tizanidine.
- Les gélules de 2 mg ont un corps opaque bleu clair avec un capuchon opaque bleu clair avec «2 MG» imprimé sur le bouchon: flacons de 150 gélules (NDC 10144-602-15)
- Les gélules de 4 mg ont un corps blanc opaque avec un bleu opaque bouchon avec «4 MG» imprimé sur le bouchon: flacons de 150 gélules (NDC 10144-604-15)
- Les gélules de 6 mg ont un corps bleu opaque avec un blanc bande et capuchon bleu opaque avec «6 MG» imprimé sur les gélules: flacons de 150 gélules (NDC -10144-606-15)
Conserver à 25 ° C (77 ° F); excursions autorisées à 15–30 ° C (59–86 ° F). Distribuer dans des conteneurs avec fermeture à l'épreuve des enfants.
Comprimés Zanaflex®
ZanaflexLes comprimés ® (chlorhydrate de tizanidine) le sont disponible sous forme de comprimés blancs non enrobés de 4 mg contenant du chlorhydrate de tizanidine 4,58 mg, équivalent à 4 mg de base de tizanidine. Les tablettes ont un quadrisecting marquer d'un côté et sont gravés avec «A594» de l'autre côté. Les tablettes sont fourni comme suit: flacons de 150 comprimés (NDC -10144-594-15).
Conserver à 25 ° C (77 ° F); excursions autorisées à 15–30 ° C (59–86 ° F).
Distribuer dans des conteneurs avec fermeture à l'épreuve des enfants.
Commercialisé et distribué par: Acorda Therapeutics Inc.Ardsley , NY 10502. Révisé: novembre 2013.

Zanaflex est un agoniste alpha-2-adrénergique central indiqué pour la gestion de la spasticité. En raison de la courte durée de effet thérapeutique, le traitement par Zanaflex doit être réservé à ceux du quotidien les activités et les moments où le soulagement de la spasticité est le plus important.

Informations posologiques
Les comprimés Zanaflex Capsules® ou Zanaflex® peuvent être prescrits avec ou sans nourriture. Une fois la formulation sélectionnée et la décision à prendre avec ou sans nourriture a été faite, ce régime ne doit pas être modifié.
Les aliments ont des effets complexes sur la pharmacocinétique de la tizanidine qui diffèrent par les différentes formulations. Capsules Zanaflex et Zanaflex les comprimés sont bioéquivalents les uns aux autres dans des conditions de jeûne (plus de 3 heures après un repas), mais pas dans des conditions d'alimentation (dans les 30 minutes suivant a repas). Ces différences pharmacocinétiques peuvent entraîner une importance clinique différences lors de l'administration des comprimés et des gélules et quand changement d'administration entre l'état nourri ou à jeun. Ces changements peuvent entraîner une augmentation des événements indésirables ou un début d'activité retardé ou plus rapide selon la nature de l'interrupteur. Pour cette raison, le prescripteur devrait être parfaitement familiarisé avec les changements de cinétique associés à ceux-ci conditions différentes.
La dose initiale recommandée est de 2 mg. Parce que l'effet de Zanaflex culmine environ 1 à 2 heures après l'administration et se dissipe entre 3 et 6 heures après l'administration, le traitement peut être répété entre 6 et 8 heures intervalles, au besoin, jusqu'à un maximum de trois doses en 24 heures.
La posologie peut être progressivement augmentée de 2 mg à 4 mg à chacun dose, avec 1 à 4 jours entre les augmentations posologiques, jusqu'à une réduction satisfaisante du tonus musculaire est atteint. La dose quotidienne totale ne doit pas dépasser 36 mg. Des doses uniques supérieures à 16 mg n'ont pas été étudiées.
Posologie chez les patients atteints d'insuffisance rénale
Zanaflex doit être utilisé avec prudence chez les patients atteints insuffisance rénale (clairance de la créatinine <25 ml / min), selon la clairance réduit de plus de 50%. Chez ces patients, lors de la titration, l'individu les doses doivent être réduites. Si des doses plus élevées sont nécessaires, des doses individuelles plutôt que la fréquence de dosage doit être augmentée.
Posologie chez les patients atteints d'insuffisance hépatique
Zanaflex doit être utilisé avec prudence chez les patients avec tout insuffisance hépatique. Chez ces patients, lors de la titration, les doses individuelles devrait être réduit. Si des doses plus élevées sont nécessaires, des doses individuelles plutôt que la fréquence de dosage doit être augmentée. La surveillance des niveaux d'aminotransférase l'est recommandé pour la ligne de base et 1 mois après l'obtention de la dose maximale, ou si une lésion hépatique est suspectée.
Arrêt de la drogue
Si le traitement doit être interrompu, en particulier dans patients qui reçoivent des doses élevées (20 mg à 36 mg par jour) depuis longtemps périodes (9 semaines ou plus) ou pouvant suivre un traitement concomitant les stupéfiants, la dose doit être diminuée lentement (2 mg à 4 mg par jour) minimiser le risque d'hypertension de sevrage et de rebond, de tachycardie, et hypertonie.

Zanaflex est contre-indiqué dans le patient qui est puissant inhibiteurs du CYP1A2, tels que la fluvoxamine ou la ciprofloxacine.

AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Hypotension
La tizanidine est un agoniste α2-adrénergique qui le peut produire une hypotension. La syncope a été rapportée dans le cadre post-commercialisation. Le risque d'hypotension significative peut éventuellement être minimisé par titration de la dose et en concentrant l'attention sur les signes et symptômes d'hypotension antérieurs à l'avancement de la dose. De plus, les patients passent d'un supine à fixe la position verticale peut présenter un risque accru d'hypotension et d'orthostatique effets.
Surveiller l'hypotension lorsque Zanaflex est utilisé chez les patients recevoir un traitement antihypertenseur simultané. Il n'est pas recommandé cela Zanaflex doit être utilisé avec d'autres agonistes α2-adrénergiques. Cliniquement une hypotension importante (diminution de la pression systolique et diastolique) a a été signalé avec l'administration concomitante de fluvoxamine ou ciprofloxacine et doses uniques de 4 mg de Zanaflex. Par conséquent, utilisation concomitante de Zanaflex avec de la fluvoxamine ou avec de la ciprofloxacine, de puissants inhibiteurs du CYP1A2, est contre-indiqué.
Risque de lésions hépatiques
Zanaflex peut provoquer des lésions hépatiques hépatocellulaires. Zanaflex doit être utilisé avec prudence chez les patients présentant une insuffisance hépatique.. La surveillance des niveaux d'aminotransférase est recommandée pour la ligne de base et 1 mois après l'obtention de la dose maximale ou en cas de suspicion de lésion hépatique.
Sédation
Zanaflex peut provoquer une sédation, qui peut interférer avec activité quotidienne. Dans les études à doses multiples, la prévalence des patients avec sédation a culminé après la première semaine de titration puis est resté stable pendant la durée de la phase de maintenance de l'étude. Le CNS effets dépresseurs de Zanaflex avec de l'alcool et d'autres dépresseurs du SNC (par ex., benzodiazépines, opioïdes, antidépresseurs tricycliques) peuvent être additifs. Moniteur les patients qui prennent Zanaflex avec un autre dépresseur du SNC pour les symptômes d'excès sédation.
Hallucinose / Symptômes psychotiques
L'utilisation de Zanaflex a été associée à des hallucinations. Formées, des hallucinations ou des délires visuels ont été rapportés dans 5 des 170 patients (3%) dans deux études cliniques contrôlées en Amérique du Nord. La plupart des les patients étaient conscients que les événements étaient irréels. Un patient s'est développé psychose en association avec les hallucinations. Un patient parmi ces 5 a continué d'avoir des problèmes pendant au moins 2 semaines après l'arrêt de tizanidine. Envisagez d'arrêter Zanaflex chez les patients qui développent des hallucinations.
Interaction avec les inhibiteurs du CYP1A2
En raison des interactions médicamenteuses potentielles, Zanaflex l'est contre-indiqué chez les patients prenant de puissants inhibiteurs du CYP1A2, tels que fluvoxamine ou ciprofloxacine. Effets indésirables tels que l'hypotension, une bradycardie ou une somnolence excessive peut survenir lorsque Zanaflex est pris avec d'autres inhibiteurs du CYP1A2, tels que le zileuton, les fluoroquinolones autres que ciprofloxacine (qui est contre-indiquée), antiarythmique (amiodarone, mexilétine, propafénone), cimétidine, famotidine, contraceptifs oraux, acyclovir et ticlopidine). L'utilisation concomitante doit être évitée, sauf si la nécessité d'un traitement par Zanaflex est cliniquement évidente. Dans un tel cas, utilisez avec mise en garde.
Réactions d'hypersensibilité
Zanaflex peut provoquer une anaphylaxie. Signes et symptômes y compris le compromis respiratoire, l'urticaire et l'œdème de Quincke de la gorge et la langue a été rapportée. Les patients doivent être informés des signes et symptômes de réactions allergiques sévères et instruction d'arrêter Zanaflex et consulter immédiatement un médecin en cas de signes et symptômes.
Risque accru d'effets indésirables chez les patients atteints Insuffisance rénale
Zanaflex doit être utilisé avec prudence chez les patients atteints insuffisance rénale (clairance de la créatinine <25 ml / min), selon la clairance réduit de plus de 50%. Chez ces patients, lors de la titration, l'individu les doses doivent être réduites. Si des doses plus élevées sont nécessaires, des doses individuelles plutôt que la fréquence de dosage doit être augmentée. Ces patients doivent être surveillés étroitement pour le début ou l'augmentation de la gravité des événements indésirables courants (sécherché bouche, somnolence, asthénie et étourdissements) comme indicateurs d'un surdosage potentiel.
Effets indésirables de retrait
Les effets indésirables liés au retrait comprennent le rebond hypertension, tachycardie et hypertonie. Pour minimiser le risque de ceux-ci réactions, en particulier chez les patients qui ont reçu des doses élevées (20 à 28 mg par jour) pendant de longues périodes (9 semaines ou plus) ou qui peuvent être allumés traitement concomitant par des stupéfiants, la dose doit être diminuée lentement (2 à 4 mg par jour).
Toxicologie non clinique
Cancérogenèse, mutagenèse , altération de la fertilité
Cancérogenèse
La tizanidine a été administrée souris pendant 78 semaines à des doses orales allant jusqu'à 16 mg / kg / jour, soit 2 fois la dose humaine maximale recommandée (MRHD) en mg / m². La tizanidine l'était administré à des rats pendant 104 semaines à des doses orales allant jusqu'à 9 mg / kg / jour, soit 2,5 fois le MRHD en mg / m². Il n'y a pas eu d'augmentation des tumeurs non plus espèce.
Mutagenèse
La tizanidine était négative in vitro (mutation inverse bactérienne [Ames], mutation génique mammifère et chromosomique test d'aberration dans les cellules de mammifères) et in vivo (micronoyau de moelle osseuse, et cytogénétique) test.
Insuffisance de la fertilité
Administration orale de la tizanidine a entraîné une fertilité réduite chez les rats mâles et femelles des doses de 30 et 10 mg / kg / jour, respectivement. Aucun effet sur la fertilité n'a été observé à des doses de 10 (hommes) et 3 (femmes) mg / kg / jour, qui sont d'environ 8 et 3 fois, respectivement, le MRHD en mg / m²).
Utilisation dans des populations spécifiques
Grossesse
Catégorie de grossesse C
Zanaflex n'a pas été étudié chez la femme enceinte. Zanaflex ne doit être administré aux femmes enceintes que si la prestation l'emporte sur le risque pour le fœtus à naître. Études de reproduction réalisées chez le rat à une dose de 3 mg / kg égale à la dose humaine maximale recommandée en mg / m² et chez le lapin à 30 mg / kg, 16 fois la dose humaine maximale recommandée en mg / m², ne l'ont pas fait montrer des preuves de tératogénicité. Tizanidine à des doses égales et supérieures à 8 fois la dose humaine maximale recommandée en mg / m² a augmenté durée de gestation chez le rat. La perte prénatale et postnatale des petits a augmenté et un retard de développement s'est produit. La perte post-implantation a augmenté lapins à des doses de 1 mg / kg ou plus, égales ou supérieures à 0,5 fois la dose humaine maximale recommandée en mg / m².
Mères allaitantes
On ne sait pas si ce médicament est excrété chez l'homme lait. Étant donné que de nombreux médicaments sont excrétés dans le lait maternel, la prudence est de mise exercé lorsque Zanaflex est administré à une femme qui allaite.
Utilisation pédiatrique
La sécurité et l'efficacité chez les patients pédiatriques ne l'ont pas fait été créé.
Utilisation gériatrique
Zanaflex est connu pour être considérablement excrété par le rein, et le risque d'effets indésirables à ce médicament peut être plus élevé patients présentant une insuffisance rénale. Parce que les patients âgés sont plus probables pour avoir une fonction rénale diminuée, il faut prendre soin de la sélection des doses, et il peut être utile de surveiller la fonction rénale. Les études cliniques de Zanaflex l'ont fait ne pas inclure un nombre suffisant de sujets âgés de 65 ans et plus à déterminer s'ils répondent différemment des sujets plus jeunes. Comparaison de la combinaison des données pharmacocinétiques après administration d'une dose unique de 6 mg de Zanaflex a montré que les sujets plus jeunes ont éliminé le médicament quatre fois plus rapidement que le sujets âgés. Chez les patients âgés atteints d'insuffisance rénale (créatinine clairance <25 ml / min), la clairance de la tizanidine est réduite de plus de 50% par rapport aux sujets âgés en bonne santé; cela devrait conduire à un durée plus longue de l'effet clinique. Pendant le titrage, les doses individuelles devrait être réduit. Si des doses plus élevées sont nécessaires, des doses individuelles plutôt que la fréquence de dosage doit être augmentée. Surveillez les patients âgés car ils le peuvent avoir un risque accru d'effets indésirables associés à Zanaflex.
Fonction rénale altérée
Zanaflex est connu pour être considérablement excrété par le rein, et le risque d'effets indésirables à ce médicament peut être plus élevé patients présentant une insuffisance rénale. Chez les patients atteints d'insuffisance rénale (la clairance de la créatinine <25 ml / min) a été réduite de plus de 50%. Chez ces patients, pendant la titration, les doses individuelles doivent être réduites. Si des doses plus élevées sont nécessaires, des doses individuelles plutôt que la fréquence d'administration devraient être augmenté. Ces patients doivent être étroitement surveillés pour le début ou augmentation de la gravité des événements indésirables courants (bouche sèche, somnolence, asthénie et étourdissements) comme indicateurs d'un surdosage potentiel.
Fonction hépatique altérée
L'influence de l'insuffisance hépatique sur le la pharmacocinétique de la tizanidine n'a pas été évaluée. Parce que la tizanidine l'est largement métabolisé dans le foie, une insuffisance hépatique devrait être observée avoir des effets significatifs sur la pharmacocinétique de la tizanidine..

Inhibiteurs du CYP1A2
L'interaction entre Zanaflex et la fluvoxamine ou la ciprofloxacine sont probablement dues à l'inhibition de CYP1A2 par fluvoxamine ou ciprofloxacine. L'effet de la fluvoxamine sur le la pharmacocinétique d'une dose unique de 4 mg de Zanaflex a été étudiée en 10 sains sujets. La Cmax, l'ASC et la demi-vie de la tizanidine ont augmenté de 12 fois 33 fois et 3 fois, respectivement. L'effet de la ciprofloxacine sur le la pharmacocinétique d'une dose unique de 4 mg de Zanaflex a été étudiée en 10 sains sujets. La Cmax et l'ASC de la tizanidine ont été multipliées par 7 et 10 respectivement.
Bien qu'il n'y en ait pas eu études cliniques évaluant les effets d'autres inhibiteurs du CYP1A2 tizanidine, autres inhibiteurs du CYP1A2, tels que le zileuton, d'autres fluoroquinolones, antiarrythmiques (amiodarone, mexilétine, propafénone et vérapamil), cimétidine , des contraceptifs oraux à la famotidine, l'acyclovir et la ticlopidine, peuvent également conduire à augmentation substantielle des concentrations sanguines de tizanidine.
Études in vitro du cytochrome Les isoenzymes P450 utilisant des microsomes hépatiques humains indiquent qu'aucune tizanidine ni les principaux métabolites ne sont susceptibles d'affecter le métabolisme d'autres médicaments métabolisé par les isoenzymes du cytochrome P450.
Contraceptifs oraux
Aucune étude pharmacocinétique spécifique a été menée pour étudier l'interaction entre les contraceptifs oraux et Zanaflex. Analyse rétrospective des données pharmacocinétiques de population suivantes l'administration d'une dose unique et multiple de 4 mg de Zanaflex l'a cependant montré les femmes prenant simultanément des contraceptifs oraux avaient une clairance de 50% inférieure tizanidine par rapport aux femmes ne prenant pas de contraceptifs oraux.
Acétaminophène
La tizanidine a retardé le Tmax de acétaminophène de 16 minutes. L'acétaminophène n'a pas affecté la pharmacocinétique de tizanidine.
Alcool
L'alcool a augmenté l'ASC de tizanidine d'environ 20%, tout en augmentant sa Cmax de environ 15%. Cela a été associé à une augmentation des effets secondaires de tizanidine. Les effets dépresseurs du SNC de la tizanidine et de l'alcool sont additifs.

Catégorie de grossesse C
Zanaflex n'a pas été étudié chez la femme enceinte. Zanaflex ne doit être administré aux femmes enceintes que si la prestation l'emporte sur le risque pour le fœtus à naître. Études de reproduction réalisées chez le rat à une dose de 3 mg / kg égale à la dose humaine maximale recommandée en mg / m² et chez le lapin à 30 mg / kg, 16 fois la dose humaine maximale recommandée en mg / m², ne l'ont pas fait montrer des preuves de tératogénicité. Tizanidine à des doses égales et supérieures à 8 fois la dose humaine maximale recommandée en mg / m² a augmenté durée de gestation chez le rat. La perte prénatale et postnatale des petits a augmenté et un retard de développement s'est produit. La perte post-implantation a augmenté lapins à des doses de 1 mg / kg ou plus, égales ou supérieures à 0,5 fois la dose humaine maximale recommandée en mg / m².

Les effets indésirables suivants sont décrits ailleurs dans d'autres sections des informations de prescription:
- Hypotension
- Blessure hépatique
- Sédation
- Hallucinose / Symptômes psychotiques
- Réactions d'hypersensibilité
Expérience des essais cliniques
Parce que les études cliniques sont menées sous de nombreuses études conditions variables, taux d'effets indésirables observés dans les études cliniques de un médicament ne peut pas être directement comparé aux taux dans les études cliniques d'un autre médicament et peut ne pas refléter les taux observés dans la pratique clinique.
Trois contrôlés contre placebo en double aveugle, randomisés -des études cliniques ont été menées pour évaluer l'effet de la tizanidine sur contrôle de la spasticité. Deux études ont été menées chez des patients atteints de multiples sclérose et un chez les patients atteints de lésion médullaire. Chaque étude avait une semaine de 13 semaines période de traitement actif qui comprenait une phase de titration de 3 semaines au maximum dose tolérée jusqu'à 36 mg / jour en trois doses divisées, une phase de plateau de 9 semaines où la dose de tizanidine était maintenue constante et une dose d'une semaine diminuée. Dans tous, 264 patients ont reçu de la tizanidine et 261 patients ont reçu un placebo. À travers les trois études sur l'âge des patients variaient de 15 à 69 ans et 51,4% femmes. La dose médiane pendant la phase du plateau variait de 20 à 28 mg / jour.
Les effets indésirables les plus fréquents rapportés chez plusieurs dose, études cliniques contrôlées contre placebo impliquant 264 patients avec la spasticité était la bouche sèche, la somnolence / sédation, l'asthénie (faiblesse, fatigue et / ou fatigue) et des étourdissements. Les trois quarts des patients ont évalué le les événements sont légers à modérés et le quart des patients ont évalué les événements comme être sévère. Ces événements semblaient être liés à la dose.
Le tableau 1 répertorie les signes et symptômes signalés plus de 2% des patients dans trois études à doses multiples contrôlées contre placebo qui a reçu Zanaflex où la fréquence dans le groupe Zanaflex était plus élevée que le groupe placebo. À des fins de comparaison, la fréquence correspondante de l'événement (pour 100 patients) chez les patients traités par placebo est également fourni.
Tableau 1: Dose multiple, études contrôlées par placebo - Fréquent
(> 2%) Effets indésirables signalés pour lesquels l'incidence des comprimés Zanaflex est
Plus grand que Placebo
| Événement | Placebo N = 261 % |
Tablette Zanaflex N = 264 % |
| Bouche sèche | 10 | 49 |
| Somnolence | 10 | 48 |
| Asthénie * | 16 | 41 |
| Vertiges | 4 | 16 |
| UTI | 7 | 10 |
| Infection | 5 | 6 |
| Constipation | 1 | 4 |
| Anomalie du test hépatique | 2 | 6 |
| Vomissements | 0 | 3 |
| Trouble de la parole | 0 | 3 |
| Amblyopie (vision floue) | <1 | 3 |
| Fréquence urinaire | 2 | 3 |
| Syndrome grippal | 2 | 3 |
| Dyskinésie | 0 | 3 |
| Nervosité | <1 | 3 |
| Pharyngite | 1 | 3 |
| Rhinite | 2 | 3 |
| * (faiblesse, fatigue et / ou fatigue) |
Dans l'étude à dose unique contrôlée contre placebo impliquant 142 patients atteints de spasticité due à la sclérose en plaques (étude 1), les patients ont été spécifiquement invités à en faire l'expérience des quatre effets indésirables les plus courants: bouche sèche, somnolence ( somnolence) asthénie (faiblesse, fatigue et / ou fatigue) et étourdissements. De plus, une hypotension et une bradycardie ont été observées. La survenue de ces réactions est résumé dans le tableau 2. D'autres événements ont été, en général, signalés à un taux de 2% ou moins.
Tableau 2: Dose unique, étude contrôlée par placebo - commune
Effets indésirables signalés
| Événement | Placebo N = 48 % |
Zanaflex Tablet, 8 mg , N = 45 % |
Zanaflex Tablet ,
16 mg , N = 49 % |
| Somnolence | 31 | 78 | 92 |
| Bouche sèche | 35 | 76 | 88 |
| Asthénie * | 40 | 67 | 78 |
| Vertiges | 4 | 22 | 45 |
| Hypotension | 0 | 16 | 33 |
| Bradycardie | 0 | 2 | 10 |
| * (faiblesse, fatigue et / ou fatigue) |
Expérience post-commercialisation
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation de Zanaflex. Parce que ces réactions sont rapportées volontairement à partir d'une population de taille incertaine, il n'est pas toujours possible de le faire estimer de manière fiable leur fréquence ou établir une relation causale avec le médicament exposition.
Certains événements, tels que la somnolence, la bouche sèche hypotension, diminution de la pression artérielle, bradycardie, étourdissements, faiblesse ou asthénie, spasmes musculaires, hallucinations, fatigue, test de la fonction hépatique une anomalie et une hépatotoxicité ont été observées après la commercialisation et la clinique essais et sont discutés dans les sections précédentes de ce document.
Les effets indésirables suivants ont été identifiés comme survenant dans l'expérience post-commercialisation de Zanaflex. Basé sur le les informations fournies concernant ces réactions, une relation causale avec Zanaflex ne peut être entièrement exclu. Les événements sont répertoriés dans l'ordre de diminution de la signification clinique; la gravité dans le contexte post-commercialisation ne l'est pas signalé.
- Syndrome de Stevens Johnson
- Réaction anaphylactique
- Dermatite exfoliatrice
- Tachycardie ventriculaire
- Hépatite
- Convulsion
- Dépression
- Arthralgie
- Paresthésie
- Éruption cutanée
- Tremblement

Un examen de la base de données de surveillance de la sécurité a révélé cas de surdosage intentionnel et accidentel de Zanaflex. Certains cas a entraîné la mort et bon nombre des surdoses intentionnelles étaient multiples médicaments, y compris les dépresseurs du SNC. Les manifestations cliniques de la tizanidine un surdosage était conforme à sa pharmacologie connue. Dans la majorité des cas une diminution du sensorium a été observée, y compris la léthargie, la somnolence, la confusion et le coma. Une fonction cardiaque déprimée est également observée, y compris le plus souvent bradycardie et hypotension. La dépression respiratoire est une autre caractéristique courante d'un surdosage de tizanidine.
En cas de surdosage, des étapes de base pour garantir l'adéquation d'une voie aérienne et surveillance des systèmes cardiovasculaires et respiratoires devrait être entrepris. La tizanidine est un médicament liposoluble, qui est uniquement légèrement soluble dans l'eau et le méthanol. Par conséquent, la dialyse ne devrait pas l'être une méthode efficace pour éliminer le médicament du corps. En général, les symptômes résoudre dans les un à trois jours suivant l'arrêt de la tizanidine et administration d'une thérapie appropriée. En raison du mécanisme d'action similaire, les symptômes et la prise en charge du surdosage de tizanidine sont similaires à ceux suivants surdosage de clonidine. Pour les informations les plus récentes concernant la direction de surdosage, contactez un centre anti-poison.

Absorption et distribution
Après administration orale, la tizanidine est essentiellement complètement absorbé. La biodisponibilité orale absolue de la tizanidine est environ 40% (CV = 24%), en raison d'un métabolisme hépatique de premier passage important. La tizanidine est largement distribuée dans tout le corps avec une stabilité moyenne état volume de distribution de 2,4 L / kg (CV = 21%) après intraveineux administration chez des volontaires adultes en bonne santé. La tizanidine est d'environ 30% lié aux protéines plasmatiques.
Différences entre Zanaflex Capsules® et Zanaflex® Comprimés
Les comprimés Zanaflex Capsules® et Zanaflex® le sont bioéquivalent les uns aux autres dans des conditions de jeûne, mais pas sous alimentation conditions. Une dose unique de deux comprimés de 4 mg ou de deux gélules de 4 mg était administré dans des conditions d'alimentation et de jeûne en ouvert, quatre périodes , étude de croisement randomisé chez 96 volontaires humains, dont 81 étaient éligibles l'analyse statistique. Après administration orale du comprimé ou capsule (à jeun), des concentrations plasmatiques maximales de tizanidine se sont produites 1,0 heure après l'administration d'une demi-vie d'environ 2 heures. Quand deux 4 mg les comprimés ont été administrés avec de la nourriture, la concentration plasmatique maximale moyenne était augmenté d'environ 30% et le temps médian de pic plasmatique la concentration a été augmentée de 25 minutes, à 1 heure et 25 minutes. Dans contraste, lorsque deux gélules de 4 mg ont été administrées avec de la nourriture, la moyenne maximale la concentration plasmatique a diminué de 20%, le temps médian avant le pic plasmatique la concentration a été augmentée de 2 à 3 heures. Par conséquent, la Cmax moyenne pour le la capsule lorsqu'elle est administrée avec de la nourriture est d'environ 66% de la Cmax pour le comprimé administré avec de la nourriture.
La nourriture a également augmenté le degré d'absorption pour les deux comprimés et capsules. L'augmentation avec le comprimé (~ 30%) a été significativement supérieur à la capsule (~ 10%). Par conséquent, quand chacun a été administré avec de la nourriture, la quantité absorbée par la capsule était d'environ 80% de la quantité absorbé par le comprimé. Administration du contenu de la capsule saupoudré la compote de pommes n'était pas bioéquivalente à l'administration d'une capsule intacte sous conditions de jeûne. Administration du contenu de la capsule sur la compote de pommes a entraîné une augmentation de 15% à 20% de la Cmax et de l'ASC de la tizanidine et de 15 minutes diminution du temps de latence médiane et du temps jusqu'à la concentration maximale par rapport à administration d'une capsule intacte au jeûne.
Figure 1: Concentration moyenne de tizanidine vs. Temps
Profils pour comprimés et capsules Zanaflex (2 à 4 mg) sous Fasted et Fed
Conditions
Métabolisme et excrétion
La tizanidine est linéaire pharmacocinétique sur les doses étudiées en développement clinique (1 à 20 mg). La tizanidine a une demi-vie d'environ 2,5 heures (CV = 33%). Environ 95% d'une dose administrée est métabolisée. Le cytochrome primaire P450 l'isoenzyme impliquée dans le métabolisme de la tizanidine est le CYP1A2. Métabolites de tizanidine ne sont pas connus pour être actifs; leurs demi-vies varient de 20 à 40 heures.
Suivre unique et multiple dosage oral de 14C-tizanidine, en moyenne 60% et 20% de la radioactivité totale a été récupéré dans l'urine et les excréments, respectivement.



