
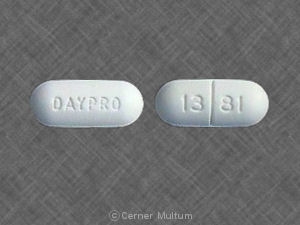
















Composition:
Utilisé dans le traitement:
Examiné médicalement par Kovalenko Svetlana Olegovna, Pharmacie Dernière mise à jour le 26.06.2023

Attention! Information sur la page est réservée aux professionnels de la santé! Les informations sont collectées dans des sources ouvertes et peuvent contenir des erreurs significatives! Soyez prudent et revérifiez toutes les informations de cette page!
Top 20 des médicaments avec les mêmes ingrédients:
Daypro Alta
Formes Posologiques Et Dosages
DAYPRO ALTA (oxaprozine potassium) comprimés: comprimés de 600 mg, bleus, en forme de capsule, pelliculés, avec Searle 1391 imprimé sur une face.
Stockage Et Manutention
Les comprimés de DAYPRO ALTA 600 mg sont bleus, en forme de capsule, pelliculés, avec Searle 1391 imprimé sur une face.
| Numéro NDC | Taille |
| 0025-5500-01 | bouteille de 100 |
| 0025-5500-03 | bouteille de 500 |
| 0025-5500-02 | carton de 100 doses |
Conserver à la température ambiante de 20ºC à 25ºC (68ºF à 77ºF), excursions autorisées entre 15ºC à 30ºC (59ºF à 86ºF) (voir Température ambiante contrôlée USP). Distribuer dans un récipient hermétiquement fermé. Protéger de l'humidité.
Fabrication par: Pfizer Inc., 235 East 42nd Street, New York, NY, 10017. Révisé en mai 2016
DAYPRO ALTA est indiqué:
- Pour le soulagement des signes et symptômes de l'arthrose
- Pour le soulagement des signes et symptômes de la polyarthrite rhumatoïde
Instructions Générales de Dosage
Examinez attentivement les avantages et les risques potentiels de DAJPRO ALTA et d'autres options de traitement avant de décider d'utiliser DAJPRO ALTA. Utilisez la dose efficace la plus faible pour la durée la plus courte, conformément aux objectifs de traitement individuels du patient.
Après avoir observé la réponse au traitement initial par DAYPRO ALTA, la dose et la fréquence doivent être ajustées en fonction des besoins individuels du patient.
Des doses divisées peuvent être essayées dans les patients incapables de tolérer des doses uniques. Pour les patients souffrant d'arthrose de faible poids corporel ou présentant une maladie plus légère, une dose initiale d'un comprimé de 600 mg une fois par jour peut être appropriée. La dose quotidienne totale maximale est de 1200 mg.
Arthrose
Pour l'arthrose, la posologie est de 1200 mg (deux comprimés de 600 mg) administrés par voie orale une fois par jour.
La Polyarthrite Rhumatoïde
Pour la PR, la posologie est de 1200 mg (deux comprimés de 600 mg) administrés par voie orale une fois par jour.
DYPRO ALTA est contre indiqué chez les patients suivants:
- Hypersensibilité connue (p. ex. réactions anaphylactiques et réactions cutanées graves) à l'oxaprozine potassique ou à l'un des composants du produit médicamenteux
- Antécédents d'asthme, d'urticaire ou d'autres réactions de type allergique après avoir pris de l'aspirine ou d'autres AINS. Des réactions anaphylactiques sévères, parfois mortelles, aux AINS ont été rapportées chez ces patients
- Dans le cadre de la chirurgie de pontage aorto-coronarien (CABG)
AVERTISSEMENT
Inclus en tant que partie de la "PRÉCAUTION" Section
PRÉCAUTION
Événements Cardiovasculaires Thrombotiques
Les essais cliniques de plusieurs AINS sélectifs et non sélectifs de la COX-2 d'une durée allant jusqu'à trois ans ont montré un risque accru d'événements thrombotiques cardiovasculaires graves, y compris un infarctus du myocarde (IM) et un accident vasculaire cérébral, qui peuvent être mortels. Sur la base des données disponibles, il n'est pas clair que le risque d'événements thrombotiques CV est similaire pour tous les AINS. L'augmentation relative des événements thrombotiques CV graves par rapport à la valeur initiale conférée par l'utilisation d'AINS semble être similaire chez les personnes atteintes ou non d'une maladie CV ou de facteurs de risque connus de maladie CV. Cependant, les patients présentant une maladie CV ou des facteurs de risque connus présentaient une incidence absolue plus élevée d'événements thrombotiques CV graves en excès, en raison de leur taux de référence accru. Certaines études observationnelles ont révélé que ce risque accru d'événements thrombotiques CV graves a commencé dès les premières semaines de traitement. L'augmentation du risque thrombotique CV a été observée le plus systématiquement à des doses plus élevées
Pour minimiser le risque potentiel d'événement CV indésirable chez les patients traités par les AINS, utiliser la dose efficace la plus faible pendant la durée la plus courte possible. Les médecins et les patients doivent rester attentifs au développement de tels événements, tout au long du traitement, même en l'absence de symptômes CV précédents. Les patients doivent être informés des symptômes des événements CV graves et des mesures à prendre s'ils se produisent.
Il n'existe aucune preuve cohérente que l'utilisation concomitante d'aspirine atténue le risque accru d'événements thrombotiques CV graves associés à l'utilisation d'AINS. L'utilisation concomitante d'aspirine et d'un AINS, comme l'oxaprozine, augmente le risque d'événements gastro-intestinaux graves (IG).
Statut Chirurgie Post-Pontage Aorto-Coronarien (CABG)
Deux grands essais cliniques contrôlés d'un AINS sélectif COX - 2 pour le traitement de la douleur dans les 10-14 premiers jours suivant la chirurgie de CABG ont révélé une incidence accrue d'infarctus du myocarde et d'accident vasculaire cérébral. Les ains sont contre-indiqués dans la prise de CABG.
Les Patients Post-im
Des études observationnelles menées dans le Registre national danois ont démontré que les patients traités par des AINS dans la période post-IM présentaient un risque accru de réinfarction, de décès lié au CV et de mortalité toutes causes confondues à partir de la première semaine de traitement. Dans cette même cohorte, l'incidence des décès au cours de la première année après l'IM était de 20 pour 100 personnes-années chez les patients traités par AINS, comparativement à 12 pour 100 personnes-années chez les patients non exposés aux AINS. Bien que le taux absolu de décès ait diminué quelque peu après la première année suivant l'IM, le risque relatif accru de décès chez les utilisateurs d'AINS a persisté au cours des quatre prochaines années de suivi.
Évitez l'utilisation de DAYPRO ALTA chez les patients présentant un IM récent, sauf si les bénéfices devraient l'emporter sur le risque d'événements thrombotiques CV récurrents. Si DAYPRO ALTA est utilisé chez les patients présentant un IM récent, surveiller les patients pour détecter les signes d'ischémie cardiaque.
Saignement Gastro-Intestinal, Ulcération Et Perforation
Les AINS, y compris DAYPRO ALTA, provoquent des effets indésirables gastro-intestinaux graves (IG), notamment une inflammation, des saignements, une ulcération et une perforation de l'œsophage, de l'estomac, de l'intestin grêle ou du gros intestin, qui peuvent être mortels. Ces effets indésirables graves peuvent survenir à tout moment, avec ou sans symptômes précurseurs, chez les patients traités par des AINS. Seulement un patient sur cinq qui développe un événement indésirable gastro intestinal supérieur grave sous un traitement par AINS est symptomatique. Des ulcères gastro-intestinaux supérieurs, des saignements grossiers ou des perforations causés par les AINS sont survenus chez environ 1% des patients traités pendant 3 à 6 mois et chez environ 2% à 4% des patients traités pendant un an. Cependant, même un traitement AINS à court terme n'est pas sans risque
Facteurs De Risque De Saignement Gastro-Intestinal, D'Ulcération Et De Perforation
Les patients ayant des antécédents d'ulcère gastro-duodénal et / ou de saignement gastro-intestinal qui utilisaient des AINS avaient un risque plus de 10 fois plus élevé de développer un saignement gastro-intestinal par rapport aux patients sans ces facteurs de risque. Parmi les autres facteurs qui augmentent le risque de saignement gastro-intestinal chez les patients traités par AINS, mentionnons la durée plus longue du traitement par AINS, l'utilisation concomitante de corticostéroïdes oraux, d'aspirine, d'anticoagulants ou d'inhibiteurs sélectifs de la recapture de la sérotonine (ISRS), le tabagisme, la consommation d'alcool, l'âge avancé et un mauvais état de santé général. La plupart des rapports post commercialisation d'événements gastro intestinaux mortels sont survenus chez des patients âgés ou affaiblis. De plus, les patients atteints d'une maladie hépatique avancée et / ou d'une coagulopathie présentent un risque accru de saignement gastro-intestinal
Stratégies Visant À Minimiser Les Risques Gastro-Intestinaux Chez Les Patients Traités Par Les AINS:
- Utilisez le dosage efficace le plus bas pour la durée la plus courte possible.
- Évitez l'administration de plus d'un AINS à la fois.
- Évitez l'utilisation chez les patients à risque plus élevé, sauf si les bénéfices sont recensés l'emportent sur le risque accru de saignement. Pour ces patients, ainsi que ceux présentant des saignements gastro-intestinaux actifs, envisager d'autres traitements que les AINS.
- Restez vigilant pour les signes et les symptômes d'ulcération gastro-intestinale et de saignement pendant le traitement par AINS.
- Si un événement indescriptible gastro-intestinal grave est suspecté, initier rapidement l'évaluation et le traitement, et interroger DAYPRO ALTA jusqu'à ce qu'un événement indescriptible gastro-intestinal grave soit exclu.
- Dans le cadre de l'utilisation concomitante d'aspirine à faible dose pour la prophylaxie cardiaque, surveiller de plus près les patients pour détecter des signes de saignement gastro-intestinal.
Hépatotoxicité
Des élévations de l'ALAT ou de l'ASAT (trois fois ou plus la limite supérieure de la normale [LSN]) ont été rapportées chez environ 1% des patients traités par les AINS au cours des essais cliniques. En outre, des cas rares, parfois mortels, de lésions hépatiques graves, y compris l'hépatite fulminante, la nécrose hépatique et l'insuffisance hépatique ont été rapportés.
Des élévations de l'ALAT ou de l'ASAT (moins de trois fois la LSN) peuvent survenir chez jusqu'à 15% des patients traités par des AINS, y compris l'oxaprozine potassique.
Informer les patients des signes avant-coureurs et des symptômes d'hépatotoxicité (p. ex. nausées, fatigue, léthargie, diarrhée, prurit, jaunisse, sensibilité au quadrant supérieur droit et symptômes "pseudo-grippaux"). Si des signes et symptômes cliniques compatibles avec une maladie du foie se développent, ou si des manifestations systémiques apparaissent (ex. éosinophilie, éruption cutanée, etc.), interrompre immédiatement DAYPRO ALTA et effectuer une évaluation clinique du patient.
Hypertension
Les AINS, y compris DAYPRO ALTA, peuvent entraîner une nouvelle apparition d'hypertension ou une aggravation de l'hypertension préexistante, ce qui peut contribuer à l'augmentation de l'incidence des événements CV. Les patients prenant des inhibiteurs de l'enzyme de conversion de l'angiotensine (IEC), des diurétiques thiazidiques ou des diurétiques de l'anse peuvent avoir une réponse altérée à ces traitements lors de la prise d'AINS.
Surveiller la pression artérielle (TA) pendant le début du traitement par les AINS et tout au long du traitement.
Insuffisance Cardiaque Et Œdème
La méta-analyse des essais contrôlés randomisés réalisée en collaboration avec les trialistes Coxib et traditional NSAID a démontré une augmentation d'environ deux fois des hospitalisations pour insuffisance cardiaque chez les patients traités sélectifs COX-2 et les patients traités par AINS non sélectifs par rapport aux patients traités par placebo. Dans une étude du Registre national danois de patients atteints d'insuffisance cardiaque, l'utilisation d'AINS a augmenté le risque d'IM, d'hospitalisation pour insuffisance cardiaque et de décès.
De plus, une rétention hydrique et un œdème ont été observés chez certains patients traités par des AINS. L'utilisation d'oxaprozine peut atténuer les effets CV de plusieurs agents thérapeutiques utilisés pour traiter ces conditions médicales (par exemple, les diurétiques, les inhibiteurs de l'ECA ou les bloqueurs des récepteurs de l'angiotensine [ARA]).
Évitez l'utilisation de DAYPRO ALTA chez les patients souffrant d'insuffisance cardiaque sévère, sauf si les bénéfices sont censés l'emporter sur le risque d'aggravation de l'insuffisance cardiaque. Si DAYPRO ALTA est utilisé chez les patients souffrant d'insuffisance cardiaque sévère, surveiller les patients pour détecter les signes d'aggravation de l'insuffisance cardiaque
Toxicité Rénale Et Hyperkaliémie
Toxicité Rénale
L'administration à long terme d'AINS a entraîné une nécrose papillaire rénale et d'autres lésions rénales. Une toxicité rénale a également été observée chez des patients chez qui les prostaglandines rénales ont un rôle compensateur dans le maintien de la perfusion rénale. Chez ces patients, l'administration d'un AINS peut entraîner une réduction dose-dépendante de la formation de prostaglandines et, secondairement, du débit sanguin rénal, ce qui peut précipiter une décompensation rénale manifeste. Les patients les plus à risque de cette réaction sont ceux qui présentent une insuffisance rénale, une déshydratation, une hypovolémie, une insuffisance cardiaque, un dysfonctionnement hépatique, ceux qui prennent des diurétiques et des inhibiteurs de l'ECA ou des ARBs, et les personnes âgées. L'arrêt du traitement par les AINS est généralement suivi d'un rétablissement à l'état de prétraitement
Aucune information n'est disponible dans les études cliniques contrôlées concernant l'utilisation de DAYPRO ALTA chez les patients atteints d'insuffisance rénale avancée. Les effets rénaux de DAYPRO ALTA peuvent accélérer la progression de la dysfonction rénale chez les patients présentant une insuffisance rénale préexistante.
Correction de l'état volumique chez les patients déshydratés ou hypovolémiques avant l'initiation de DAJPRO ALTA. Surveiller la fonction rénale chez les patients présentant une insuffisance rénale ou hépatique, une insuffisance cardiaque, une déshydratation ou une hypovolémie lors de l'utilisation de DAJPRO ALTA. Évitez l'utilisation de DAYPRO ALTA chez les patients atteints d'insuffisance rénale avancée, sauf si les bénéfices sont censés l'emporter sur le risque d'aggravation de la fonction rénale. Si DAYPRO ALTA est utilisé chez les patients présentant une insuffisance rénale avancée, surveiller les patients pour déceler des signes d ' aggravation de la fonction rénale.
L'hyperkaliémie
Des augmentations de la concentration sérique de potassium, y compris une hyperkaliémie, ont été rapportées avec l'utilisation d'AINS même chez certains patients sans insuffisance rénale. Chez les patients ayant une fonction rénale normale, ces effets ont été attribués à un état hyporéninémique-hypoaldostéronisme.
Réactions Anaphylactiques
L'oxaprozine potassique a été associée à des réactions anaphylactiques chez des patients présentant ou non une hypersensibilité connue à l'oxaprozine et chez des patients asthmatiques sensibles à l'aspirine.
Chercher de l'aide d'urgence si une réaction anaphylactique.
Exacerbation De L'Asthme Liée À La Sensibilité À L'Aspirine
Une sous-population de patients asthmatiques peut avoir un asthme sensible à l'aspirine qui peut inclure une rhinosinusite chronique compliquée par des polypes nasaux, un bronchospasme grave et potentiellement mortel et/ou une intolérance à l'aspirine et à d'autres AINS. Comme une réactivité croisée entre l'aspirine et d'autres AINS a été rapportée chez de tels patients sensibles à l'aspirine, DAYPRO ALTA est contre-indiqué chez les patients présentant cette forme de sensibilité à l'aspirine. Lorsque DAYPRO ALTA est utilisé chez les patients souffrant d'asthme préexistant (sans sensibilité connue à l'aspirine), surveiller les patients pour détecter toute modification des signes et symptômes de l'asthme.
Réactions Cutanées Graves
Les AINS, y compris l'oxaprozine potassique, peuvent provoquer des effets indésirables cutanés graves tels que dermatite exfoliative, syndrome de Stevens-Johnson (SJS) et nécrolyse épidermique toxique (TEN), qui peuvent être mortels. Ces événements graves peuvent se produire sans avertissement. Informer les patients des signes et symptômes de réactions cutanées graves, et d'arrêter l'utilisation de DAYPRO ALTA dès la première apparition d'une éruption cutanée ou de tout autre signe d'hypersensibilité. DAYPRO ALTA est contre-indiqué chez les patients ayant déjà eu des réactions cutanées graves aux AINS.
Fermeture Prématurée Du Canal Artériel Fœtal
L'oxaprozine peut provoquer une fermeture prématurée du canal artériel fœtal. Évitez l'utilisation d'AINS, y compris DAJPRO ALTA, chez les femmes enceintes à partir de 30 semaines de gestation (troisième trimestre).
Toxicité hématologique
Une anémie s'est produite chez les patients traités par les AINS. Cela peut être dû à une perte de sang occulte ou grossière, à une rétention d'eau ou à un effet incomplètement décrit sur l'érythropoïèse. Si un patient traité par DAYPRO ALTA présente des signes ou des symptômes d'anémie, surveiller l'hémoglobine ou l'hématocrite.
Les AINS, y compris DAYPRO ALTA, peuvent augmenter le risque d'événements hémorragiques. Des conditions comorbides telles que des troubles de la coagulation ou l'utilisation concomitante de warfarine, d'autres anticoagulants, d'agents antiplaquettaires (par exemple, l'aspirine), d'inhibiteurs de la recapture de la sérotonine (ISRS) et d'inhibiteurs de la recapture de la sérotonine et de la noradrénaline (IRSN) peuvent augmenter ce risque. Surveiller ces patients pour les signes de saignement.
Masquage De L'Inflammation Et De La Fièvre
L'activité pharmacologique de DAYPRO ALTA dans la réduction de l'inflammation, et éventuellement de la fièvre, peut diminuer l'utilité des signes diagnostiques dans la détection des infections.
Surveillance en Laboratoire
Étant donné que des saignements gastro-intestinaux graves, une hépatotoxicité et des lésions rénales peuvent survenir sans symptômes ni signes avant-coureurs, envisagez de surveiller périodiquement les patients sous traitement à long terme par AINS avec un CBC et un profil chimique.
Photosensibilité
L'oxaprozine a été associée à une éruption cutanée et/ou à une photosensibilité légère lors de tests dermatologiques. Une incidence accrue d'éruptions cutanées sur la peau exposée au soleil a été observée chez certains patients dans les essais cliniques.
Informations sur le Conseil des Patients
Conseillez au patient de lire l'étiquetage du patient approuvé par la FDA (Guide des médicaments) qui accompagne chaque ordonnance délivrée. Informez les patients, les familles ou leurs soignants des informations suivantes avant d'initier le traitement par DAJPRO ALTA et périodiquement pendant le traitement en cours.
Événements Cardiovasculaires Thrombotiques
Aviser les patients d'être attentifs aux symptômes des événements thrombotiques cardiovasculaires, y compris la douleur thoracique, l'essoufflement, la faiblesse ou l'altération de la parole, et de signaler immédiatement l'un de ces symptômes à leur fournisseur de soins de santé.
Saignement Gastro-Intestinal, Ulcération Et Perforation
Conseillez aux patients de signaler les symptômes d'ulcérations et de saignements, y compris les douleurs épigastriques, la dyspepsie, la méléna et l'hématémèse à leur fournisseur de soins de santé. Dans le cadre de l'utilisation concomitante d'aspirine à faible dose pour la prophylaxie cardiaque, informer les patients du risque accru et des signes et symptômes de saignement gastro-intestinal.
Hépatotoxicité
Informer les patients des signes avant-coureurs et des symptômes d'hépatotoxicité (p. ex. nausées, fatigue, léthargie, prurit, diarrhée, jaunisse, sensibilité au quadrant supérieur droit et symptômes “pseudo-grippaux”). Si cela se produit, demandez aux patients d'arrêter DAYPRO ALTA et de demander un traitement médical immédiat.
Insuffisance Cardiaque Et Œdème
Conseillez aux patients d'être attentifs aux symptômes d'insuffisance cardiaque congestive, y compris l'essoufflement, la prise de poids inexpliquée ou l'œdème, et de contacter leur fournisseur de soins de santé si de tels symptômes se manifestent.
Réactions Anaphylactiques
Informer les patients des signes d'une réaction anaphylactique (p. ex. difficulté à respirer, gonflement du visage ou de la gorge). Demandez aux patients de demander une aide d'urgence immédiate si cela se produit.
Réactions Cutanées Graves
Conseillez aux patients d'arrêter DAYPRO ALTA immédiatement s'ils développent un type d'éruption cutanée et de contacter leur fournisseur de soins de santé dès que possible.
De La Fertilité Féminine
Aviser les femelles du potentiel reproducteur qui désirent une grossesse que les AINS, y compris DAYPRO ALTA, peuvent être associés à un retard réversible de l'ovulation.
Toxicité Pour Le Foetus
Informer les femmes enceintes d'éviter l'utilisation de DAYPRO ALTA et d'autres AINS à partir de 30 semaines de gestation en raison du risque de fermeture prématurée du canal artériel fœtal.
Éviter L'Utilisation Concomitante D'Ains
Informer les patients que l'utilisation concomitante de DAJPRO ALTA avec d'autres AINS ou salicylates (par exemple, diflunisal, salsalate) n'est pas recommandée en raison du risque accru de toxicité gastro-intestinale et de l'augmentation faible ou nulle de l'efficacité. Avertissez les patients que les AINS peuvent être présents dans les médicaments "en vente libre" pour le traitement du rhume, de la fièvre ou de l'insomnie.
Utilisation D'AINS Et D'Aspirine À Faible Dose
Informez les patients de ne pas utiliser de l'aspirine à faible dose en même temps que DAYPRO ALTA jusqu'à ce qu'ils en parlent à leur fournisseur de soins de santé.
Toxicologie Non clinique
Carcinogenèse, Mutagenèse, Altération De La Fertilité
Cancérogenèse
Dans les études de cancérogénicité chez le rat et la souris, l'administration d'oxaprozine pendant 2 ans a été associée à l'exacerbation des néoplasmes hépatiques (adénomes et carcinomes hépatiques) chez les souris CD mâles, mais pas chez les souris CD femelles ou les rats traités avec jusqu'à 216 mg/kg par l'alimentation (1,2 fois la dose quotidienne maximale recommandée La signification de cette découverte spécifique à l'espèce pour l'homme est inconnue.
Mutagenèse
L'oxaprozine n'a pas été génotoxique dans le test d'Ames, la mutation vers l'avant dans les cellules de la levure et de l'ovaire de hamster chinois (CHO), les tests de réparation de l'ADN dans les cellules CHO, les tests de micronoyaux dans la moelle osseuse de souris, les tests d'aberration chromosomique dans les lymphocytes humains ou les tests de
Altération De La Fertilité
L'administration d'oxaprozine n'a pas été associée à une altération de la fertilité chez les rats mâles et femelles à des doses orales allant jusqu'à 200 mg/kg/jour (1,1 fois la dose quotidienne maximale recommandée chez l'homme [MRHD] de 1800 mg sur la base d'une comparaison de la surface corporelle). Cependant, une dégénérescence testiculaire a été observée chez les chiens beagle traités avec 37,5 mg/kg/jour (0,7 fois la MRHD en fonction de la surface corporelle) d'oxaprozine pendant 42 jours ou 6 mois, une découverte non confirmée chez d'autres espèces. La pertinence clinique de cette découverte n'est pas connue.
Utilisation Dans Des Populations Spécifiques
Grossesse
Résumé des Risques
L'utilisation d'AINS, y compris DAYPRO ALTA, au cours du troisième trimestre de la grossesse augmente le risque de fermeture prématurée du canal artériel fœtal. Évitez l'utilisation d'AINS, y compris DAJPRO ALTA, chez les femmes enceintes à partir de 30 semaines de gestation (troisième trimestre).
Il n'existe pas d'études adéquates et bien contrôlées de DAJPRO ALTA chez la femme enceinte.
Les données des études d'observation concernant les risques embryofétaux potentiels d'utilisation des AINS chez les femmes au cours du premier ou du deuxième trimestre de la grossesse ne sont pas concluantes. Dans le général U.S. dans la population, toutes les grossesses cliniquement reconnues, indépendamment de l'exposition aux médicaments, ont un taux de fond de 2 à 4% pour les malformations majeures et de 15 à 20% pour la perte de grossesse. Dans les études de reproduction animale, administration orale d'oxaprozine à des lapines gravides à des doses 0.cependant, l'administration orale d'oxaprozine à des souris et des rats gravides pendant l'organogenèse à des doses équivalentes à la dose humaine maximale recommandée n'a révélé aucune preuve de tératogénicité ou d'embryotoxicité. Dans les études de reproduction chez le rat dans lesquelles l'oxaprozine a été administrée en fin de gestation l'échec de l'accouchement et une réduction de l'indice de naissance vivante a été observée à des doses équivalentes à la dose maximale recommandée chez l'homme. Sur la base de données animales, il a été démontré que les prostaglandines jouent un rôle important dans la perméabilité vasculaire de l'endomètre, l'implantation de blastocystes et la décidualisation. Dans les études animales, l'administration d'inhibiteurs de la synthèse des prostaglandines tels que l'oxaprozine potassique a entraîné une augmentation de la perte avant et après l'implantation
Considérations Cliniques
Du travail ou de la Livraison
Il n'existe aucune étude sur les effets de DAYPRO ALTA pendant le travail ou l'accouchement. Dans les études animales, les AINS, y compris l'oxaprozine potassique, inhibent la synthèse des prostaglandines, provoquent un retard de la parturition et augmentent l'incidence de la mortinaissance.
Données
Les données sur les animaux
Des études de tératologie avec de l'oxaprozine potassique ont été effectuées chez des souris, des rats et des lapins chez des animaux gravides administrés par voie orale à des doses allant jusqu'à 200 mg/kg/jour, 200 mg/kg/jour et 30 mg/kg/jour, respectivement, pendant la période d'organogenèse. Chez le lapin, des malformations ont été observées à des doses supérieures ou égales à 7.5 mg/kg/jour d'oxaprozine (0.1 fois la dose quotidienne maximale recommandée chez l'homme [MRHD] de 1800 mg en fonction de la surface corporelle). Cependant, chez la souris et le rat, aucune anomalie du développement liée au médicament ou toxicité embryo-fœtale n'a été observée à des doses allant jusqu'à 50 et 200 mg/kg/jour d'oxaprozine, respectivement (0.1 fois et 1.1-fois la MRHD basée sur la surface corporelle, respectivement)
Dans les études sur la fertilité et la reproduction chez le rat, 200 mg/kg/jour d'oxaprozine ont été administrés par voie orale à des rats femelles pendant 14 jours avant l'accouplement jusqu'au jour de lactation (JJ) 2 ou du jour de gestation (JJ) 15 jusqu'au JJ 2 et les femelles ont été accouplées avec des mâles traités par 200 mg/kg/jour d'oxaprozine pendant 60 jours avant l'accouplement. L'administration d'oxaprozine a entraîné un échec de l'accouchement et une réduction de l'indice de naissance vivante à 200 mg/kg/jour (1,1 fois la MRHD basée sur la comparaison de la surface corporelle).
Lactation
Résumé des Risques
Aucune étude de lactation n'a été réalisée avec Dajpro Alta. On ne sait pas si Daypro Alta est excrété dans le lait maternel. Dypro Alta ne doit être administré aux femmes qui allaitent que si cela est clairement indiqué. Les avantages de l'allaitement maternel pour le développement et la santé doivent être pris en compte, de même que le besoin clinique de la mère en DAJPRO ALTA et tout effet indésirable potentiel sur le nourrisson allaité du DAJPRO ALTA ou de la maladie maternelle sous-jacente.
Femelles Et Mâles Ayant Un Potentiel Reproducteur
Infertilité
Femme
Sur la base du mécanisme d'action, l'utilisation d'AINS médiés par les prostaglandines, y compris DAYPRO ALTA, peut retarder ou prévenir la rupture des follicules ovariens, qui a été associée à une infertilité réversible chez certaines femmes. Des études animales publiées ont montré que l'administration d'inhibiteurs de la synthèse des prostaglandines peut perturber la rupture folliculaire induite par les prostaglandines nécessaire à l'ovulation. De petites études chez les femmes traitées avec des AINS ont également montré un retard réversible de l'ovulation. Envisager le retrait des AINS, y compris DAYPRO ALTA, chez les femmes qui ont des difficultés à concevoir ou qui subissent une enquête sur l'infertilité.
Homme
Une dégénérescence testiculaire a été observée chez les chiens beagle traités par 37,5 mg/kg/jour (0,7 fois la dose quotidienne maximale recommandée chez l'homme en fonction de la surface corporelle) d'oxaprozine pendant 42 jours ou 6 mois.
Utilisation Pédiatrique
DYPRO ALTA n'a pas été étudié chez les patients âgés de <16 ans. L'innocuité et l'efficacité de DAYPRO ALTA chez les patients pédiatriques n'ont pas été établies.
Utilisation Gériatrique
Les patients âgés, par rapport aux patients plus jeunes, sont plus à risque d'effets indésirables graves associés aux AINS, cardiovasculaires, gastro-intestinaux et/ou rénaux. Si le bénéfice attendu pour le patient âgé l'emporte sur ces risques potentiels, commencer à prendre le médicament à l'extrémité inférieure de la plage posologique, et surveiller les patients pour les effets indésirables.
L'âge n'a pas eu d'effet sur la pharmacocinétique de DAJPRO ALTA après 600, 1200 et 1800 doses de rug ni sur l'incidence des effets indésirables rapportés. Dans un essai clinique contrôlé de 6 mois portant sur 803 patients (dont 322 ont reçu DYPRO ALTA), dont environ 40% étaient des personnes âgées, il n'y avait pratiquement aucune différence détectée en termes de nombre total de sujets rapportant des événements indésirables par rapport à l'âge. Comme pour tout AINS, les personnes âgées sont susceptibles de tolérer moins bien les effets indésirables que les patients plus jeunes. Des précautions doivent être prises dans le traitement des personnes âgées (65 ans et plus), et des précautions supplémentaires doivent être prises lors du choix d'une dose.
L'oxaprozine est essentiellement excrétée par le rein, et le risque de réactions toxiques à DAJPRO ALTA peut être plus élevé chez les patients présentant une insuffisance rénale. Étant donné que les patients âgés sont plus susceptibles d'avoir une diminution de la fonction rénale, des précautions doivent être prises dans la sélection de la dose, et il peut être utile de surveiller la fonction rénale.
EFFETS SECONDAIRES
Les effets indésirables suivants sont discutés plus en détail dans d'autres sections de l'étiquetage:
- Événements Cardiovasculaires Thrombotiques
- Saignement gastro-intestinal, Ulcération et Perforation
- Hépatotoxicité
- Hypertension
- Insuffisance cardiaque et Œdème
- Toxicité rénale et Hyperkaliémie
- Réactions Anaphylactiques
- Réactions Coupées Graves
- Toxicité hématologique
Expérience des Essais Cliniques
Puisque les essais cliniques sont menés dans des conditions très diverses, taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux dans les essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés en pratique.
Chez les patients prenant DAJPRO ALTA (comprimés d'oxaprozine potassique), oxaprozine ou d'autres AINS, les effets indésirables les plus fréquemment rapportés sont les suivants chez environ 1 à 10% des patients :
Expériences gastro-intestinales, y compris: douleurs abdominales, anorexie, constipation, diarrhée, dyspepsie, flatulences, saignements gastro-intestinaux/perforations grossiers, ulcères gastro-intestinaux (gastriques/duodénaux), brûlures d'estomac, nausées, vomissements.
Expériences non gastro-intestinales, y compris: fonction rénale anormale, anémie, confusion, dépression, perturbation du sommeil, vertiges, dysurie ou fréquence, œdème, élévation des enzymes hépatiques, maux de tête, augmentation du temps de saignement, prurit, éruptions cutanées, sédation, somnolence, acouphènes.
Effets Indésirables Supplémentaires Rapportés Chez Moins De 1% Des Patients:
Corps dans son ensemble: réactions anaphylactiques, changements d'appétit, décès, fièvre, infection, septicémie, maladie sérique.
Système cardiovasculaire: arythmie, changements de pression artérielle, insuffisance cardiaque congestive, hypertension, hypotension, infarctus du myocarde, palpitations, syncope, tachycardie, vascularite.
Système digestif: altération du goût, bouche sèche, éructation, œsophagite, gastrite, glossite, hématémèse, hémorragie hémorroïdaire ou rectale, hépatite, jaunisse, insuffisance hépatique, pancréatite, stomatite.
Système hémique et lymphatique: agranulocytose, anémie aplasique, ecchymose, éosinophilie, anémie hémolytique, leucopénie, lymphadénopathie, méléna, pancytopénie, purpura, thrombocytopénie.
Métabolique et nutritionnel: hyperglycémie, changements de poids.
Système nerveux: anxiété, asthénie, coma, convulsions, anomalies des rêves, somnolence, hallucinations, insomnie, malaise, méningite, nervosité, paresthésie, tremblements, vertiges, faiblesse.
Système respiratoire: asthme, dyspnée, pneumonie, infections pulmonaires, dépression respiratoire, sinusite, symptômes d'infection des voies respiratoires supérieures.
De la peau et des phanères: alopécie. œdème de quincke, augmentation de la transpiration, photosensibilité, pseudoporphyrie, dermatite exfoliative, érythème polymorphe, syndrome de Stevens-Johnson, nécrolyse épidermique toxique (syndrome de Lyell), urticaire.
Sens spéciaux: vision floue, conjonctivite, déficience auditive.
Appareil génito-urinaire: néphrite interstitielle aiguë, insuffisance rénale aiguë, cystite, diminution du flux menstruel, hématurie, augmentation du flux menstruel, syndrome néphrotique, oligurie/polyurie, protéinurie, insuffisance rénale.
INTERACTIONS MÉDICAMENTEUSES
Voir le tableau 1 pour les interactions médicamenteuses cliniquement significatives avec l'oxaprozine potassique.
Tableau 1: Interactions médicamenteuses Cliniquement significatives avec l'Oxaprozine Potassique
| Médicaments qui interfèrent avec l'hémostase | |
| L'Impact Clinique: |
|
| Intervention: | Surveiller les patients avec l'utilisation concomitante de DAYPRO ALTA avec des anticoagulants (par exemple, la warfarine), des agents antiplaquettaires (par exemple, l'aspirine), des inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) et des inhibiteurs de la recapture de la sérotonine et de la noradrénaline (IRSN) pour détecter des signes de saignement. |
| Aspirin | |
| L'Impact Clinique: | Des études cliniques contrôlées ont montré que l'utilisation concomitante d'AINS et de doses analgésiques d'aspirine ne produit pas d'effet thérapeutique plus important que l'utilisation d'Ains seuls. Dans une étude clinique, l'utilisation concomitante d'un AINS et d'aspirine a été associée à une augmentation significative de l'incidence des effets indésirables gastro-intestinaux par rapport à l'utilisation de l'AINS seul. |
| Intervention: | L'utilisation concomitante de DAJPRO ALTA et de doses analgésiques d'aspirine n'est généralement pas recommandée en raison du risque accru de saignement. DAYPRO ALTA ne remplace pas l'aspirine à faible dose pour la protection cardiovasculaire. |
| Inhibiteurs de l'ECA, Inhibiteurs des Récepteurs de l'Angiotensine et Bête-bloquants | |
| L'Impact Clinique: |
|
| Intervention: |
|
| Diurétique | |
| L'Impact Clinique: | Des études cliniques, ainsi que des observations post-commercialisation, ont montré que les AINS réduisaient l'effet natriurétique des diurétiques de l'anse (par exemple, furosémide) et des diurétiques thiazidiques chez certains patients. Cet effet a été attribué à l'inhibition par les AINS de la synthèse des prostaglandines rénales. |
| Intervention: | Lors de l'utilisation concomitante de DAJPRO ALTA avec des diurétiques, observer les patients pour des signes d'aggravation de la fonction rénale, en plus d'assurer l'efficacité diurétique, y compris les effets antihypertenseurs. |
| Digoxine | |
| L'Impact Clinique: | L'utilisation concomitante d'oxaprozine potassique et de digoxine a été rapportée versez augmenter de la concentration sérique et prolonger la demi-vie de la digoxine. |
| Intervention: | Lors de l'utilisation concomitante de DAYPRO ALTA et de digoxine, surveiller les taux sérieux de digoxine. |
| Lithium | |
| L'Impact Clinique: | Les AINS ont entraîné une élévation des taux plasmatiques de lithium et une réduction de la clairance rénale du lithium. La concentration minimale moyenne de lithium a augmenté de 15% et la clairance rénale a diminué d'environ 20%. Cet effet a été attribué à l'inhibition par les AINS de la synthèse des prostaglandines rénales. |
| Intervention: | Lors de l'utilisation concomitante de DAJPRO ALTA et de lithium, surveiller les patients pour détecter les signes de toxicité du lithium. |
| Le méthotrexate | |
| L'Impact Clinique: | L'utilisation concomitante d'AINS et de méthotrexate peut augmenter le risque de toxicité du méthotrexate (par exemple, neutropénie, thrombocytopénie, dysfonctionnement rénal) car l'administration d'Ains peut entraîner une augmentation des taux plasmatiques de méthotrexate, en particulier chez les patients recevant de fortes doses de méthotrexate. |
| Intervention: | Lors de l'utilisation concomitante de DAJPRO ALTA et de méthotrexate, surveiller la toxicité du méthotrexate chez les patients. |
| La Cyclosporine | |
| L'Impact Clinique: | L'utilisation concomitante de DAYPRO ALTA et de cyclosporine peut augmenter la néphrotoxicité de la cyclosporine. |
| Intervention: | Lors de l'utilisation concomitante de DAJPRO ALTA et de cyclosporine, surveiller les patients pour détecter des signes d'aggravation de la fonction rénale. |
| AINS et Salicylés | |
| L'Impact Clinique: | L'utilisation concomitante d'oxaprozine potassique avec d'autres ACIDES ou salicylates (par exemple, diflunisal, salsalate) augmente le risque de toxicité gastro-intestinale, avec peu ou pas d'augmentation de l'efficacité. |
| Intervention: | L'utilisation concomitante d'oxaprozine potassique avec d'autres ACIDES ou salicylates n'est pas recommandée. |
| Pemetrexed | |
| L'Impact Clinique: | L'utilisation concomitante de DAJPRO ALTA et de pemetrexed peut augmenter le risque de myélosuppression associée au pemetrexed, de toxicité rénale et gastro-intestinale (voir les informations de prescription de pemetrexed). |
| Intervention: | Lors de l'utilisation concomitante de DAJPRO ALTA et de pemetrexed, chez les patients présentant une insuffisance rénale dont la clarté de la créatinine varie de 45 à 79 mL/min, surveiller la myélosuppression, la toxicité rénale et gastro-intestinale. Les AINS ayant une demi-vie d'élimination courte (par exemple, diclofénac, indométhacine) doivent être évités pendant une période de deux jours avant, le jour de et deux jours après l'administration de pemetrexed. En l'absence de données concernant l'interaction potentielle entre le pemetrexed et les AINS avec des demi-vies plus longues (par exemple, méloxicam, nabumétone), les patients prenant ces AINS devraient interrompre la prise pendant au moins cinq jours avant, le jour de, et deux jours après l'administration de pemetrexed. |
| Corticoïde | |
| L'Impact Clinique: | L'utilisation concomitante de corticostéroïdes avec DAYPRO ALTA peut augmenter le risque d'ulcération gastro-intestinale ou de saignement. |
| Intervention: | Surveiller les patients avec l'utilisation concomitante de DAYPRO ALTA avec des corticostéroïdes pour les signes de saignement. |
| Glyburide | |
| L'Impact Clinique: | Bien que l'oxaprozine modifie la pharmacocinétique du glyburide, la coadministration de l'oxaprozine chez des patients diabétiques non insulino-dépendants de type II n'a pas affecté la zone sous la courbe de concentration de glucose ni l'amplificateur ou la durée du contrôle. |
| Intervention | Lors de l'utilisation concomitante de DAJPRO ALTA et de glyburide, surveiller la glycémie des patients au début de la cothérapie. |
Interactions des Tests de Laboratoire
Des tests de dépistage des benzodiazépines par immunoessai urinaire faussement positifs ont été rapportés chez des patients prenant de l'oxaprozine. Cela est dû au manque de spécificité des tests de dépistage. Des résultats faussement positifs peuvent être attendus pendant plusieurs jours après l'arrêt du traitement par oxaprozine. Des tests de confirmation, tels que la chromatographie en phase gazeuse/spectrométrie de masse, permettront de distinguer l'oxaprozine des benzodiazépines.
Résumé des Risques
L'utilisation d'AINS, y compris DAYPRO ALTA, au cours du troisième trimestre de la grossesse augmente le risque de fermeture prématurée du canal artériel fœtal. Évitez l'utilisation d'AINS, y compris DAJPRO ALTA, chez les femmes enceintes à partir de 30 semaines de gestation (troisième trimestre).
Il n'existe pas d'études adéquates et bien contrôlées de DAJPRO ALTA chez la femme enceinte.
Les données des études d'observation concernant les risques embryofétaux potentiels d'utilisation des AINS chez les femmes au cours du premier ou du deuxième trimestre de la grossesse ne sont pas concluantes. Dans le général U.S. dans la population, toutes les grossesses cliniquement reconnues, indépendamment de l'exposition aux médicaments, ont un taux de fond de 2 à 4% pour les malformations majeures et de 15 à 20% pour la perte de grossesse. Dans les études de reproduction animale, administration orale d'oxaprozine à des lapines gravides à des doses 0.cependant, l'administration orale d'oxaprozine à des souris et des rats gravides pendant l'organogenèse à des doses équivalentes à la dose humaine maximale recommandée n'a révélé aucune preuve de tératogénicité ou d'embryotoxicité. Dans les études de reproduction chez le rat dans lesquelles l'oxaprozine a été administrée en fin de gestation l'échec de l'accouchement et une réduction de l'indice de naissance vivante a été observée à des doses équivalentes à la dose maximale recommandée chez l'homme. Sur la base de données animales, il a été démontré que les prostaglandines jouent un rôle important dans la perméabilité vasculaire de l'endomètre, l'implantation de blastocystes et la décidualisation. Dans les études animales, l'administration d'inhibiteurs de la synthèse des prostaglandines tels que l'oxaprozine potassique a entraîné une augmentation de la perte avant et après l'implantation
Considérations Cliniques
Du travail ou de la Livraison
Il n'existe aucune étude sur les effets de DAYPRO ALTA pendant le travail ou l'accouchement. Dans les études animales, les AINS, y compris l'oxaprozine potassique, inhibent la synthèse des prostaglandines, provoquent un retard de la parturition et augmentent l'incidence de la mortinaissance.
Données
Les données sur les animaux
Des études de tératologie avec de l'oxaprozine potassique ont été effectuées chez des souris, des rats et des lapins chez des animaux gravides administrés par voie orale à des doses allant jusqu'à 200 mg/kg/jour, 200 mg/kg/jour et 30 mg/kg/jour, respectivement, pendant la période d'organogenèse. Chez le lapin, des malformations ont été observées à des doses supérieures ou égales à 7.5 mg/kg/jour d'oxaprozine (0.1 fois la dose quotidienne maximale recommandée chez l'homme [MRHD] de 1800 mg en fonction de la surface corporelle). Cependant, chez la souris et le rat, aucune anomalie du développement liée au médicament ou toxicité embryo-fœtale n'a été observée à des doses allant jusqu'à 50 et 200 mg/kg/jour d'oxaprozine, respectivement (0.1 fois et 1.1-fois la MRHD basée sur la surface corporelle, respectivement)
Dans les études sur la fertilité et la reproduction chez le rat, 200 mg/kg/jour d'oxaprozine ont été administrés par voie orale à des rats femelles pendant 14 jours avant l'accouplement jusqu'au jour de lactation (JJ) 2 ou du jour de gestation (JJ) 15 jusqu'au JJ 2 et les femelles ont été accouplées avec des mâles traités par 200 mg/kg/jour d'oxaprozine pendant 60 jours avant l'accouplement. L'administration d'oxaprozine a entraîné un échec de l'accouchement et une réduction de l'indice de naissance vivante à 200 mg/kg/jour (1,1 fois la MRHD basée sur la comparaison de la surface corporelle).
Les effets indésirables suivants sont discutés plus en détail dans d'autres sections de l'étiquetage:
- Événements Cardiovasculaires Thrombotiques
- Saignement gastro-intestinal, Ulcération et Perforation
- Hépatotoxicité
- Hypertension
- Insuffisance cardiaque et Œdème
- Toxicité rénale et Hyperkaliémie
- Réactions Anaphylactiques
- Réactions Coupées Graves
- Toxicité hématologique
Expérience des Essais Cliniques
Puisque les essais cliniques sont menés dans des conditions très diverses, taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux dans les essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés en pratique.
Chez les patients prenant DAJPRO ALTA (comprimés d'oxaprozine potassique), oxaprozine ou d'autres AINS, les effets indésirables les plus fréquemment rapportés sont les suivants chez environ 1 à 10% des patients :
Expériences gastro-intestinales, y compris: douleurs abdominales, anorexie, constipation, diarrhée, dyspepsie, flatulences, saignements gastro-intestinaux/perforations grossiers, ulcères gastro-intestinaux (gastriques/duodénaux), brûlures d'estomac, nausées, vomissements.
Expériences non gastro-intestinales, y compris: fonction rénale anormale, anémie, confusion, dépression, perturbation du sommeil, vertiges, dysurie ou fréquence, œdème, élévation des enzymes hépatiques, maux de tête, augmentation du temps de saignement, prurit, éruptions cutanées, sédation, somnolence, acouphènes.
Effets Indésirables Supplémentaires Rapportés Chez Moins De 1% Des Patients:
Corps dans son ensemble: réactions anaphylactiques, changements d'appétit, décès, fièvre, infection, septicémie, maladie sérique.
Système cardiovasculaire: arythmie, changements de pression artérielle, insuffisance cardiaque congestive, hypertension, hypotension, infarctus du myocarde, palpitations, syncope, tachycardie, vascularite.
Système digestif: altération du goût, bouche sèche, éructation, œsophagite, gastrite, glossite, hématémèse, hémorragie hémorroïdaire ou rectale, hépatite, jaunisse, insuffisance hépatique, pancréatite, stomatite.
Système hémique et lymphatique: agranulocytose, anémie aplasique, ecchymose, éosinophilie, anémie hémolytique, leucopénie, lymphadénopathie, méléna, pancytopénie, purpura, thrombocytopénie.
Métabolique et nutritionnel: hyperglycémie, changements de poids.
Système nerveux: anxiété, asthénie, coma, convulsions, anomalies des rêves, somnolence, hallucinations, insomnie, malaise, méningite, nervosité, paresthésie, tremblements, vertiges, faiblesse.
Système respiratoire: asthme, dyspnée, pneumonie, infections pulmonaires, dépression respiratoire, sinusite, symptômes d'infection des voies respiratoires supérieures.
De la peau et des phanères: alopécie. œdème de quincke, augmentation de la transpiration, photosensibilité, pseudoporphyrie, dermatite exfoliative, érythème polymorphe, syndrome de Stevens-Johnson, nécrolyse épidermique toxique (syndrome de Lyell), urticaire.
Sens spéciaux: vision floue, conjonctivite, déficience auditive.
Appareil génito-urinaire: néphrite interstitielle aiguë, insuffisance rénale aiguë, cystite, diminution du flux menstruel, hématurie, augmentation du flux menstruel, syndrome néphrotique, oligurie/polyurie, protéinurie, insuffisance rénale.
Les symptômes d'une surdose aiguë d'AINS se sont généralement limités à une léthargie, une somnolence, des nausées, des vomissements et des douleurs épigastriques, qui ont été généralement réversibles avec des soins de soutien. Des saignements gastro-intestinaux se sont produits. L'hypertension, l'insuffisance rénale aiguë, la dépression respiratoire et le coma se sont produits, mais étaient rares.
Prendre en charge les patients qui reçoivent des soins symptomatiques et de soutien à la suite d'un surdosage d'AINS. Il n'y a pas d'antidote spécifique. Considérez les vomissements et/ou le charbon actif (60 à 100 grammes chez l'adulte, 1 à 2 grammes par kg de poids corporel chez les patients pédiatriques) et / ou la cathartique osmotique chez les patients symptomatiques vus dans les quatre heures suivant l'ingestion ou chez les patients présentant un surdosage important (5 à 10 fois la dose recommandée). La diurèse forcée, l'alcalinisation de l'urine, l'hémodialyse ou l'hémoperfusion peuvent ne pas être utiles en raison d'une liaison élevée aux protéines.
Pour plus d'informations sur le traitement par surdosage, contactez un centre antipoison (1-800-2221222).
Caractéristiques Pharmacocinétiques Générales
Dans des études de proportionnalité de dose utilisant des doses de 600, 1200 et 1800 mg, la pharmacocinétique de l'oxaprozine chez des sujets sains a démontré une cinétique non linéaire du médicament total et non lié dans des directions opposées, i.e., augmentation liée à l'exposition à la dose de la clairance du médicament total et diminution de la clairance du médicament non lié. Les modifications de la liaison aux protéines dépendantes de la concentration ont également entraîné des modifications du volume de distribution de l'oxaprozine, qui a augmenté pour le médicament total mais a diminué pour le médicament non lié. Les paramètres pharmacocinétiques de l'oxaprozine chez les sujets sains recevant une dose unique ou plusieurs doses une fois par jour de 1200 mg sont présentés dans le tableau 2
Tableau 2. Paramètres pharmacocinétiques de l'oxaprozine avec Dosage de DAYPRO ALTA (1200 mg) [Moyenne (%CV)]
| Adultes en bonne santé (18-42 ans, N=12 à 24) | ||||
| Total Des Médicaments | Médicament Libre | |||
| Seul | Plusieurs | Seul | Plusieurs | |
| TMax (RHÉSUS) | 1.67 (65) | 2.13 (64) | 1.71 (63) | 1.59 (38) |
| Clairance orale (L/h/70 kg) | 0.125 (15) | 0.289 (17) | 123 (20) | 86.7 (33) |
| Volume de distribution apparent à l | 10.14 (11) | 16.24 (38) | 7741 (18) | 2067 (38) |
| Demi-vie d'élimination (heure) | 57.0 (15) | 38.0 (29) | 44.8 (23) | 16.4 (11) |
| TMax = temps versez atteindre la concentration plasmatique maximale d'oxaprozine. |
Absorption
Après administration orale, DAYPRO ALTA se dissocie en oxaprozine libre qui est absorbée à 95%. Le pic de concentration plasmatique survient environ 1 heure et 45 minutes après l'administration d'une dose unique (voir Tableau 2). Lorsque DYPRO ALTA est administré avec de la nourriture, la concentration maximale d'oxaprozine est retardée d'environ 45 minutes, mais l'étendue de l'absorption est inchangée. Les antiacides n'affectent pas significativement l'étendue et le taux d'absorption de l'oxaprozine.
Distribution
Le volume apparent de distribution (Vd / F) de l'oxaprozine totale est d'environ 10-16 L / 70 kg. L'oxaprozine potassique est liée à 99% aux protéines plasmatiques, principalement à l'albumine. Aux concentrations de médicament thérapeutique, la liaison aux protéines plasmatiques de l'oxaprozine est saturable, ce qui entraîne une proportion plus élevée de médicament libre à mesure que la concentration totale de médicament augmente. Avec des augmentations des doses uniques ou après des doses répétitives une fois par jour, le volume apparent de distribution et de clairance du médicament total a augmenté, tandis que celui du médicament non lié a diminué en raison des effets de la liaison non linéaire aux protéines. L'oxaprozine devrait être excrétée dans le lait maternel en fonction de ses propriétés physico-chimiques, cependant, la quantité d'oxaprozine excrétée dans le lait maternel n'a pas été évaluée
Métabolisme
Plusieurs métabolites d'oxaprozine excrétés dans l'urine ou les fèces humaines sont considérés comme n'ayant pas d'activité pharmacologique significative. L'oxaprozine est principalement métabolisée par le foie, à la fois par oxydation microsomale (65%) et par conjugaison à l'acide glucuronique (35%). Les glucuronides d'ester et d'éther sont les principaux métabolites conjugués de l'oxaprozine. Une petite quantité (<5%) de métabolites phénoliques actifs est produite, mais la contribution à l'activité globale est limitée.
Excrétion
Soixante-cinq pour cent (65%) de la dose sont excrétés dans l'urine et 35% dans les fèces sous forme de métabolites. L'élimination rénale des métabolites de l'oxaprozine est une voie d'élimination majeure. L'excrétion biliaire d'oxaprozine inchangée est une voie mineure. Après des doses multiples de DAYPRO ALTA (1200mg QD), les demi-vies moyennes d 'élimination à l' état d 'équilibre de l' oxaprozine totale et de l ' oxaprozine non liée aux protéines étaient respectivement de 38,0 et 16,4 heures (voir Tableau 2).


