
Composición:
Solicitud:
Revisión médica por Oliinyk Elizabeth Ivanovna Última actualización de farmacia el 26.06.2023

¡Atención! ¡La información en la página es solo para profesionales médicos! ¡La información se recopila en Fuentes abiertas y puede contener errores significativos! ¡Tenga cuidado y vuelva a verificar toda la información de esta página!
Los 20 mejores medicamentos con los mismos ingredientes:
Comtan
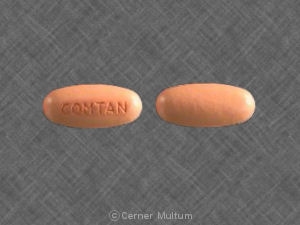
Comtan (entacapone) se suministra en comprimidos recubiertos con película de 200 mg para administración oral. Las tabletas de forma ovalada son de color marrón anaranjado, sin marcar y en relieve "Comtan" en un lado. Las tabletas se proporcionan en contenedores de HDPE de la siguiente manera:
Botellas de 100 NDC 0078-0327-05
Almacenar a 25°C (77°F), excursiones permitidas a 15°C a 30°C (59°F a 86°F).
Fabricado por: Orion Corporation, Orion Pharma (Espoo, Finlandia). Revisado: Feb 2016
Comtan está indicado como complemento de levodopa y carbidopa para tratar el “desgaste” al final de la dosis en pacientes con enfermedad de Parkinson (ver FARMACOLOGÍA CLÍNICA, Estudios clínicos).
La eficacia de Comtan no se ha evaluado sistemáticamente en pacientes con enfermedad de Parkinson que no experimentan “desgaste” al final de la dosis.
La dosis recomendada de Comtan (entacapona) es un comprimido de 200 mg administrado concomitantemente con cada dosis de levodopa y carbidopa hasta un máximo de 8 veces al día (200 mg x 8 = 1.600 mg por día). La experiencia clínica con dosis diarias superiores a 1.600 mg es limitada.
Comtan siempre debe administrarse en asociación con levodopa y carbidopa. La entacapona no tiene efecto antiparkinsoniano propio.
En los ensayos clínicos, la mayoría de los pacientes requirieron una disminución en la dosis diaria de levodopa si su dosis diaria de levodopa había sido mayor o igual a 800 mg o si los pacientes tenían discinesia moderada o grave antes de comenzar el tratamiento.
Para optimizar la respuesta de un paciente individual, puede ser necesario reducir la dosis diaria de levodopa o extender el intervalo entre dosis. En estudios clínicos, la reducción media de la dosis diaria de levodopa fue de aproximadamente 25% en aquellos pacientes que requirieron una reducción de la dosis de levodopa. (Más del 58% de los pacientes con dosis de levodopa superiores a 800 mg diarios requirieron tal reducción.)
Comtan se puede combinar con las formulaciones de liberación inmediata y sostenida de levodopa y carbidopa.
Comtan puede tomarse con o sin alimentos (ver FARMACOLOGÍA CLÍNICA).
Pacientes con deterioro de la función hepática
Los pacientes con insuficiencia hepática deben tratarse con precaución. El AUC y la Cmax de entacapona se duplicaron aproximadamente en pacientes con enfermedad hepática documentada, en comparación con los controles. Sin embargo, estos estudios se llevaron a cabo con una dosis única de entacapona sin la administración conjunta de levodopa e inhibidor de la dopa decarboxilasa y, por lo tanto, no se han evaluado los efectos de la enfermedad hepática sobre la cinética de la administración crónica de entacapona (ver FARMACOLOGÍA CLÍNICA, Farmacocinética de Entacapone).
Retirar a los pacientes de Comtan
La retirada rápida o la reducción abrupta de la dosis de Comtan podrían provocar la aparición de signos y síntomas de la enfermedad de Parkinson (ver FARMACOLOGÍA CLÍNICA, Estudios clínicos), y puede provocar hiperpirexia y confusión, un complejo de síntomas que se asemeja a NMS (ver PRECAUCIONES, Otros eventos reportados con la terapia dopaminérgica). Este síndrome debe considerarse en el diagnóstico diferencial para cualquier paciente que desarrolle fiebre alta o rigidez severa. Si se decide interrumpir el tratamiento con Comtan, se debe vigilar estrechamente a los pacientes y se deben ajustar otros tratamientos dopaminérgicos según sea necesario. Aunque no se ha evaluado sistemáticamente la disminución de Comtan, parece prudente retirar a los pacientes lentamente si se toma la decisión de suspender el tratamiento.
Comtan está contraindicado en pacientes que han demostrado hipersensibilidad al medicamento o sus ingredientes.
ADVERTENCIA
La monoaminooxidasa (MAO) y COMT son las dos principales enzimas sistemas involucrados en el metabolismo de las catecolaminas. Es teóricamente posible, por lo tanto, que la combinación de Comtan (entacapone) y un inhibidor de la MAO no selectivo (por ejemplo, fenelzina y tranilcipromina) resultaría en la inhibición de la mayoría de las vías responsables de lo normal metabolismo de las catecolaminas. Por esta razón, los pacientes normalmente no deben ser tratado concomitantemente con Comtan y un inhibidor de MAO no selectivo.
Entacapone se puede tomar concomitantemente con un selectivo Inhibidor de MAO-B (por ejemplo, selegilina).
Drogas metabolizadas por la catecol-O-metiltransferasa (COMT)
Cuando se administró una dosis única de 400 mg de entacapona con isoprenalina intravenosa (isoproterenol) y epinefrina sin administración conjunta inhibidor de levodopa y dopa descarboxilasa, los cambios máximos medios totales en frecuencia cardíaca durante la perfusión fueron aproximadamente 50% y 80% más altos que con placebo, para isoprenalina y epinefrina, respectivamente.
Por lo tanto, fármacos conocidos por ser metabolizados por COMT, tales como isoproterenol, epinefrina, norepinefrina, dopamina, dobutamina, La alfa-metildopa, la apomorfina, la isoetherina y el bitolterol deben ser administrado con precaución en pacientes que reciben entacapona independientemente de la de administración (incluida la inhalación), ya que su interacción puede resultar en el aumento de las frecuencias cardíacas, posibles arritmias y cambios excesivos en la presión arterial.
Se observó taquicardia ventricular en un niño de 32 años varón saludable voluntario en un estudio de interacción después de la infusión de epinefrina y administración oral de entacapona. Se requirió tratamiento con propranolol. Un La relación causal con la administración de entacapona parece probable, pero no puede con certeza.
Caer dormido durante las actividades de la vida diaria y somnolencia
Pacientes con enfermedad de Parkinson tratados con Comtan, que aumenta los niveles plasmáticos de levodopa, o con levodopa han notificado repentinamente quedarse dormido sin previo aviso de somnolencia mientras participa en actividades de la vida diaria (incluida la operación de vehículos de motor). Algunos de estos episodios resultaron en accidentes. Aunque muchos de estos pacientes reportaron somnolencia mientras estaban en Comtan, algunos no percibieron señales de advertencia, como somnolencia excesiva, y creían que estaban alertas inmediatamente antes de evento. Algunos de estos eventos se han reportado tan tarde como un año después iniciación del tratamiento.
El riesgo de somnolencia aumentó (Comtan 2% y placebo 0%) en estudios controlados. Se ha informado de que quedarse dormido mientras se dedica a actividades de la vida diaria siempre ocurre en un entorno de preexistente somnolencia, aunque los pacientes pueden no dar tal historia. Por esta razón, Los prescriptores deben reevaluar a los pacientes en busca de somnolencia o somnolencia, especialmente ya que algunos de los eventos ocurren bien después del inicio del tratamiento. Prescriptores también debe ser consciente de que los pacientes pueden no reconocer somnolencia o somnolencia hasta que se cuestione directamente sobre somnolencia o somnolencia durante actividad. Se debe aconsejar a los pacientes que tengan precaución mientras conduzcan, máquinas en funcionamiento, o trabajando en alturas durante el tratamiento con Comtan. Pacientes que ya han experimentado somnolencia y/o un episodio de inicio del sueño no debe participar en estas actividades durante el tratamiento con Comtan
Antes de iniciar el tratamiento con Comtan, aconsejar a los pacientes del potencial de desarrollar somnolencia y preguntar específicamente sobre factores que puede aumentar este riesgo, como el uso concomitante de medicamentos sedantes y el presencia de trastornos del sueño. Si un paciente desarrolla somnolencia diurna o episodios de quedarse dormido durante actividades que requieren participación activa (por ejemplo, conversaciones, comer, etc.), Comtan normalmente debe ser descontinuado (ver DOSIFICACIÓN Y ADMINISTRACIÓN para obtener orientación sobre la interrupción de Comtan). Si se toma la decisión de continuar Comtan, se debe aconsejar a los pacientes que no conducir y evitar otras actividades potencialmente peligrosas. Hay información insuficiente para establecer si la reducción de la dosis eliminará episodios de quedarse dormido mientras se dedica a actividades de la vida diaria.
PRECAUCIONES
Hipotensión, hipotensión ortostática y síncope
La terapia dopaminérgica en pacientes con enfermedad de Parkinson tiene se ha asociado con hipotensión ortostática. Entacapona mejora la levodopa biodisponibilidad y, por lo tanto, podría esperarse que aumente la ocurrencia de hipotensión ortostática. En estudios controlados, aproximadamente el 1,2% y el 0,8% de Los pacientes con 200 mg de entacapona y placebo, respectivamente, notificaron al menos un episodio de síncope. Los informes de síncope fueron generalmente más frecuentes en los pacientes en ambos grupos de tratamiento que tenían un episodio de hipotensión documentada.
Alucinaciones y comportamiento psicótico similar
Terapia dopaminérgica en pacientes con enfermedad de Parkinson se ha asociado con alucinaciones. En estudios clínicos, alucinaciones llevó a la interrupción del fármaco y la retirada prematura en 0,8% y 0% de los pacientes se trató con 200 mg de Comtan y placebo, respectivamente. Las alucinaciones llevaron a hospitalización en 1,0% y 0,3% de los pacientes en los 200 mg Comtan y placebo grupos, respectivamente. La agitación se produjo en el 1% de los pacientes tratados con COMTAN y 0% tratados con placebo.
Los informes posteriores a la comercialización indican que los pacientes pueden experimentar nuevos o empeorar el estado mental y cambios de comportamiento, que pueden ser comportamiento psicótico durante el tratamiento con Comtan o después de comenzar o aumentar la dosis de Comtan. Otros medicamentos recetados para mejorar los síntomas de la enfermedad de Parkinson pueden tener efectos similares en el pensamiento y comportamiento. El pensamiento y el comportamiento anormales pueden causar ideación paranoica, delirios, alucinaciones, confusión, desorientación, comportamiento agresivo, agitación, y delirio. También se observaron comportamientos psicóticos durante el desarrollo clínico de Comtan.
Los pacientes con un trastorno psicótico importante deben no ser tratado con Comtan debido al riesgo de exacerbarse. la psicosis. Además, ciertos medicamentos utilizados para tratar la psicosis pueden exacerbar los síntomas de la enfermedad de Parkinson y puede disminuir el la efectividad de Comtan.
Control de impulsos y comportamientos compulsivos
Los informes posteriores a la comercialización sugieren que los pacientes tratados con Los medicamentos anti-Parkinson pueden experimentar impulsos intensos de jugar, aumento impulsos sexuales, impulsos intensos de gastar dinero incontrolablemente, y otros instar. Los pacientes pueden ser incapaces de controlar estos impulsos mientras toman uno o más de los medicamentos que se utilizan para el tratamiento de la enfermedad de Parkinson y que aumentan el tono dopaminérgico central, incluyendo Comtan tomado con levodopa y carbidopa. En algunos casos, aunque no todos, estos impulsos fueron reportados a se han detenido cuando la dosis de medicamentos anti-Parkinson se redujo o interrumpir. Debido a que los pacientes pueden no reconocer estos comportamientos como anormales es importante que los prescriptores pregunten específicamente a los pacientes o a sus cuidadores sobre el desarrollo de impulsos de juego nuevos o aumentados, impulsos sexuales, gastos incontrolados u otros impulsos mientras reciben tratamiento con entacapona. Los médicos deben considerar la reducción de la dosis o suspender Comtan si un paciente desarrolla tales impulsos mientras toma Comtan
Diarrea y colitis
En estudios clínicos, la diarrea se desarrolló en 60 de 603 (10%) y 16 de 400 (4%) de los pacientes tratados con 200 mg de Comtan y placebo, respectivamente. En los pacientes tratados con Comtan, la diarrea fue generalmente leve a moderada en severidad (8.6%), pero se consideró grave en 1.3%. Diarrea dio lugar a la retirada en 10 de 603 (1.7%) pacientes, 7 (1.2%) con leve y diarrea moderada y 3 (0.5%) con diarrea severa. Diarrea generalmente resuelto después de la interrupción de Comtan. Dos pacientes con diarrea fueron hospitalizado. Típicamente, la diarrea se presenta dentro de 4 semanas a 12 semanas después entacapone se inicia, pero puede aparecer tan pronto como la primera semana y tan tarde muchos meses después del inicio del tratamiento. La diarrea puede estar asociada con pérdida de peso, deshidratación e hipocalemia
La experiencia poscomercialización ha demostrado que la diarrea puede ser un signo de colitis microscópica inducida por fármacos, principalmente colitis linfocítica. En En estos casos, la diarrea ha sido de moderada a severa, acuosa, y no sangriento, a veces asociado con deshidratación, dolor abdominal, pérdida de peso, e hipocalemia. En la mayoría de los casos, diarrea y otras relacionadas con la colitis Los síntomas se resolvieron o mejoraron significativamente cuando se interrumpió el tratamiento con Comtan. En algunos pacientes con colitis confirmada por biopsia, la diarrea se había resuelto o mejoró significativamente después de la interrupción del tratamiento con Comtan, pero retratamiento con Comtan.
Si se sospecha que la diarrea prolongada está relacionada con Comtan, el medicamento debe suspenderse y la terapia médica adecuada considerar. Si la causa de la diarrea prolongada no está clara o continúa después de suspender la entacapona, luego más investigaciones de diagnóstico que incluyen colonoscopia y biopsias deben ser considerados.
Discinesia
Comtan puede potenciar los efectos secundarios dopaminérgicos de levodopa y puede causar o exacerbar la discinesia preexistente. Aunque disminuir la dosis de levodopa puede mejorar este efecto secundario, muchos pacientes en estudios controlados continuó experimentando discinesia frecuente a pesar de un en su dosis de levodopa. La incidencia de discinesia fue del 25% para tratamiento con Comtan y 15% para placebo. La incidencia de retirada del estudio para la discinesia fue del 1,5% para 200 mg de Comtan y del 0,8% para el placebo.
Otros eventos reportados con la terapia dopaminérgica
Los eventos que se enumeran a continuación son eventos asociados con el de fármacos que aumentan la actividad dopaminérgica.
La rabdomiólisis
Se han notificado casos de rabdomiólisis grave tras la aprobación del Comtán. Aunque las reacciones típicamente ocurrieron mientras que los pacientes fueron tratados con Comtan, la naturaleza complicada de estos casos hace difícil determinar qué papel, en su caso, desempeñó Comtán en su patogénesis. La actividad motora prolongada severa, incluida la discinesia, puede explicar para rabdomiólisis. Los signos y síntomas incluyen fiebre, alteración de conciencia, mialgia, aumento de los valores de creatina fosfoquinasa (CPK) y mioglobina (ver PRECAUCIONES, Otros eventos reportados con dopaminérgicos Terapia).
Hiperpirexia y confusión
Casos de un complejo de síntomas que se asemeja a neuroléptico síndrome maligno (NMS) caracterizado por temperatura elevada, rigidez, conciencia alterada, y CPK elevado se han reportado en asociación con la reducción rápida de la dosis o la retirada de otros dopaminergic droga. En la mayoría de estos casos, los síntomas comenzaron después de la interrupción abrupta de tratamiento con entacapona o reducción de su dosis, o después del inicio de tratamiento con entacapona. La naturaleza complicada de estos casos lo hace difícil determinar qué papel, en su caso, Comtán pudo haber desempeñado en su patogénesis. No se han notificado casos después de la retirada abrupta o reducción de la dosis del tratamiento con entacapona durante los estudios clínicos
Los médicos deben tener precaución cuando cesa tratamiento con entacapona. Cuando se considere necesario, la retirada debe proceder lentamente. Si se toma la decisión de suspender el tratamiento con Comtan, recomendaciones incluyen el seguimiento del paciente de cerca y el ajuste de otros tratamientos dopaminérgicos según sea necesario. Este síndrome debe considerarse en el diagnóstico diferencial para cualquier paciente que desarrolla una fiebre alta o severa rigidez. No se ha evaluado sistemáticamente el Comtan tapering.
Complicaciones Fibróticas
Casos de fibrosis retroperitoneal, infiltrados pulmonares, Se han notificado derrame pleural y engrosamiento pleural en algunos pacientes tratado con agentes dopaminérgicos derivados del cornezuelo. Estas complicaciones pueden resolver cuando se suspende el medicamento, pero la resolución completa no siempre ocurre. Aunque se cree que estos eventos adversos están relacionados con la ergolina estructura de estos compuestos, ya sean otros fármacos derivados del nonergot (e.g., entacapona) que aumentan la actividad dopaminérgica puede causar que se desconoce. Se Cabe señalar que la incidencia esperada de complicaciones fibróticas es tan baja que incluso si la entacapona causara estas complicaciones a tasas similares a las atribuible a otras terapias dopaminérgicas, es poco probable que tenga se han detectado en una cohorte del tamaño expuesto a entacapona. Cuatro casos de fibrosis pulmonar se notificaron durante el desarrollo clínico de entacapona, tres de estos pacientes también fueron tratados con pergolida y uno con bromocriptina. La duración del tratamiento con entacapona varió de 7 meses a 17 meses
Melanoma
Los estudios epidemiológicos han demostrado que los pacientes con La enfermedad de Parkinson tiene un riesgo más alto (2 a aproximadamente 6 veces mayor) de desarrollar melanoma que la población general. Si el aumento del riesgo observado se debió a la enfermedad de Parkinson u otros factores, como medicamentos utilizados para tratar la enfermedad de Parkinson, no está claro.
Por las razones mencionadas anteriormente, los pacientes y proveedores son Se aconseja controlar los melanomas con frecuencia y regularmente cuando se usa Comtan para cualquier indicación. Idealmente, los exámenes periódicos de la piel deberían ser realizadas por individuos debidamente calificados (por ejemplo, dermatólogos).
Toxicidad renal
En un estudio de toxicidad de 1 año, entacapona (exposición al plasma 20 veces que en los seres humanos que reciben la dosis diaria máxima recomendada de 1.600 mg) causó una mayor incidencia de nefrotoxicidad en ratas macho que era caracterizado por túbulos regenerativos, engrosamiento de las membranas del sótano, infiltración de células mononucleares y moldes de proteínas tubulares. Estos efectos no se asociaron con cambios en los parámetros de la química clínica, y hay no hay un método establecido para el seguimiento de la posible aparición de estos lesiones en humanos. Aunque esta toxicidad podría representar una especie específica efecto, todavía no hay evidencia de que esto sea así.
Deterioro hepático
Los pacientes con insuficiencia hepática deben ser tratados con precaución. El AUC y la Cmax de entacapona se duplicaron aproximadamente en pacientes con enfermedad hepática documentada en comparación con los controles (ver FARMACOLOGÍA CLÍNICA, Farmacocinética de Entacapone y DOSIFICACIÓN Y ADMINISTRACIÓN).
Pruebas de laboratorio
Comtan es un quelante de hierro. El impacto de la entacapona en las reservas de hierro del cuerpo se desconoce, sin embargo, una tendencia hacia la disminución del suero Se observó concentraciones de hierro en estudios clínicos. En una clínica controlada estudiar los niveles de ferritina sérica (como marcador de deficiencia de hierro y anemia) no se modificaron con entacapona en comparación con placebo después de un año de tratamiento y no hubo diferencia en las tasas de anemia o disminución niveles de hemoglobina.
Poblaciones especiales
Los pacientes con insuficiencia hepática deben ser tratados con precaución (ver INDICACIÓN, DOSIFICACIÓN Y ADMINISTRACIÓN).
Carcinogénesis
Los estudios de carcinogenicidad de entacapona duraron dos años realizado en ratones y ratas. Las ratas se trataron una vez al día por sonda oral con dosis de entacapona de 20, 90 o 400 mg/kg. Un aumento de la incidencia de Se encontró adenomas tubulares y carcinomas en ratas macho tratadas con dosis de entacapona. Las exposiciones plasmáticas (AUC) asociadas a esta dosis fueron aproximadamente 20 veces mayor que la exposición plasmática estimada de los seres humanos recibir la dosis diaria máxima recomendada (MRDD) de entacapona (1.600 mg). Los ratones fueron tratados una vez al día por sonda oral con dosis de 20, 100 o 600 mg/kg de entacapona (0.05, 0.3, y 2 veces el MRDD para humanos sobre una base de mg/m²). Debido a una alta incidencia de mortalidad prematura en ratones que reciben el dosis más alta de entacapona, el estudio con ratones no es una evaluación adecuada de carcinogenicidad. Aunque no se observaron tumores relacionados con el tratamiento en animales recibiendo las dosis más bajas, el potencial carcinogénico de entacapona no ha ha sido evaluado completamente. El potencial carcinogénico de entacapona administrado en No se ha evaluado la combinación con levodopa y carbidopa
Mutagénesis
Entacapone fue mutagénico y clastogénico en el Inicio ratón en presencia y ausencia de activación metabólica, y se clastogénico en linfocitos humanos cultivados en presencia de metabólico activación. Entacapone, solamente o en combinación con levodopa y carbidopa, no era clastogénico en el en vivo prueba de micronúcleo del ratón o mutagénico en el ensayo de mutación inversa bacteriana (prueba Ames).
Deterioro de la fertilidad
Entacapone no perjudicó la fertilidad o funcionamiento reproductivo en ratas tratadas con hasta 700 mg/kg/día (AUC plasmáticos 28 veces las de los seres humanos que reciben el MRDD de 1.600 mg). Retraso en el apareamiento, pero fertilidad, fue evidente en ratas hembras tratadas con 700 mg/kg/día de entacapone.
Embarazo
Embarazo Categoría C
En estudios de desarrollo embriofetal, entacapona fue administrado a animales gestantes a lo largo de la organogénesis a dosis de hasta 1.000 mg/kg/día en ratas y 300 mg/kg/día en conejos. Aumento de incidencias de Las variaciones fetales fueron evidentes en camadas de ratas tratadas con dosis, en ausencia de signos manifiestos de toxicidad materna. El plasma materno La exposición al fármaco (AUC) asociada a esta dosis fue aproximadamente 34 veces la exposición plasmática estimada en humanos que reciben el máximo diario recomendado dosis (MRDD) de 1.600 mg. Aumento de las frecuencias de abortos, tardíos y totales se observó una disminución del peso fetal en las camadas de conejos tratados con dosis tóxicas para la madre de 100 mg/kg/día (AUCs plasmáticos 0.4 veces aquellos en los seres humanos que reciben el MRDD) o más. No hubo evidencia de teratogenicidad en estos estudios
Sin embargo, cuando se administró entacapona a ratas hembras antes del apareamiento y durante la gestación temprana, una mayor incidencia de ojo fetal Se observaron anomalías (macroftalmia, microftalmia, anoftalmia) en el Litros de diques tratados con dosis de 160 mg/kg/día (AUC de plasma 7 veces más en seres humanos que reciben la MRDD) o mayor, en ausencia de toxicidad materna. Administración de hasta 700 mg/kg/día (AUC plasmáticos 28 veces los de los seres humanos recepción del MRDD) a ratas hembras durante la última parte de la gestación y a lo largo de la lactancia no produjo evidencia de deterioro del desarrollo en el descendencia.
Entacapone siempre se administra concomitantemente con levodopa y carbidopa, que se sabe que causa malformaciones viscerales y esqueléticas en conejo. El potencial teratogénico de entacapona en combinación con levodopa y carbidopa no se evaluó en animales.
No hay experiencia de estudios clínicos con respecto a el uso de Comtan en mujeres embarazadas. Por lo tanto, Comtan debe usarse durante embarazo sólo si el beneficio potencial justifica el riesgo potencial para el feto.
Mujeres de enfermería
En estudios en animales, la entacapona se excretó en materna leche de rata.
No se sabe si la entacapona se excreta en humanos leche. Debido a que muchos medicamentos se excretan en la leche humana, se debe tener precaución se ejercita cuando se administra entacapona a una mujer lactante.
Uso pediátrico
La seguridad y la eficacia en pacientes pediátricos no han se ha establecido.
Ver INTERACCIONES CON MEDICAMENTOS.
Embarazo Categoría C
En estudios de desarrollo embriofetal, entacapona fue administrado a animales gestantes a lo largo de la organogénesis a dosis de hasta 1.000 mg/kg/día en ratas y 300 mg/kg/día en conejos. Aumento de incidencias de Las variaciones fetales fueron evidentes en camadas de ratas tratadas con dosis, en ausencia de signos manifiestos de toxicidad materna. El plasma materno La exposición al fármaco (AUC) asociada a esta dosis fue aproximadamente 34 veces la exposición plasmática estimada en humanos que reciben el máximo diario recomendado dosis (MRDD) de 1.600 mg. Aumento de las frecuencias de abortos, tardíos y totales se observó una disminución del peso fetal en las camadas de conejos tratados con dosis tóxicas para la madre de 100 mg/kg/día (AUCs plasmáticos 0.4 veces aquellos en los seres humanos que reciben el MRDD) o más. No hubo evidencia de teratogenicidad en estos estudios
Sin embargo, cuando se administró entacapona a ratas hembras antes del apareamiento y durante la gestación temprana, una mayor incidencia de ojo fetal Se observaron anomalías (macroftalmia, microftalmia, anoftalmia) en el Litros de diques tratados con dosis de 160 mg/kg/día (AUC de plasma 7 veces más en seres humanos que reciben la MRDD) o mayor, en ausencia de toxicidad materna. Administración de hasta 700 mg/kg/día (AUC plasmáticos 28 veces los de los seres humanos recepción del MRDD) a ratas hembras durante la última parte de la gestación y a lo largo de la lactancia no produjo evidencia de deterioro del desarrollo en el descendencia.
Entacapone siempre se administra concomitantemente con levodopa y carbidopa, que se sabe que causa malformaciones viscerales y esqueléticas en conejo. El potencial teratogénico de entacapona en combinación con levodopa y carbidopa no se evaluó en animales.
No hay experiencia de estudios clínicos con respecto a el uso de Comtan en mujeres embarazadas. Por lo tanto, Comtan debe usarse durante embarazo sólo si el beneficio potencial justifica el riesgo potencial para el feto.
Debido a que los estudios clínicos se llevan a cabo en condiciones muy variadas, la incidencia de reacciones adversas (número de pacientes únicos que experimentan una reacción adversa asociada con el tratamiento por número total de pacientes tratados) observada en los estudios clínicos de un medicamento no puede compararse directamente con la incidencia de reacciones adversas en los estudios clínicos de otro medicamento y
Un total de 1.450 pacientes con enfermedad de Parkinson fueron tratados con Comtan en estudios clínicos previos a la comercialización. Se incluyeron pacientes con síntomas fluctuantes, así como aquellos con respuestas estables al tratamiento con levodopa. Sin embargo, todos los pacientes recibieron tratamiento concomitante con preparaciones de levodopa y fueron similares en otros aspectos clínicos.
Las reacciones adversas más frecuentemente observadas (incidencia al menos 3% mayor que placebo) en estudios doble ciego controlados con placebo (N = 1,003) asociados con el uso de Comtan fueron: discinesia, decoloración de la orina, diarrea, náuseas, hipercinesia, dolor abdominal, vómitos y sequedad de boca. Aproximadamente el 14% de los 603 pacientes que recibieron entacapona en los estudios doble ciego controlados con placebo interrumpieron el tratamiento debido a reacciones adversas, en comparación con el 9% de los 400 pacientes que recibieron placebo. Las causas más frecuentes de interrupción en orden decreciente fueron: trastornos psiquiátricos (2% vs. 1%), diarrea (2% vs. 0%), discinesia e hipercinesia (2% vs 0%), disquinesia e hipercinesia. 1%), náuseas (2% vs. 1%), dolor abdominal (1% vs. 0%)
Incidencia de eventos adversos en estudios clínicos controlados
La Tabla 4 enumera los acontecimientos adversos emergentes al tratamiento que ocurrieron en al menos el 1% de los pacientes tratados con entacapona que participaron en los estudios doble ciego, controlados con placebo y que fueron numéricamente más frecuentes en el grupo Comtan, en comparación con placebo. En estos estudios, se añadió Comtan o placebo a levodopa y carbidopa (o levodopa y benserazida).
Tabla 4: Resumen de los pacientes con eventos adversos después del inicio de la administración de medicamentos de ensayo Al menos 1% en el grupo Comtan y mayor que Placebo
| CLASE DE ÓRGANOS DEL SISTEMA Término preferido | Comtan | Placebo |
| (n = 603) | (n = 400)) | |
| % de pacientes | % de pacientes | |
| TRASTORNOS DE PIEL Y APÉNDICE | ||
| Sudoración aumentada | 2 | 1 |
| TRASTORNOS DEL SISTEMA MUSCULOSQUELÉTICO | ||
| Dolor de espalda | 2 | 1 |
| TRASTORNOS DEL SISTEMA NERVIOSO CENTRAL Y PERIFÉRICO | ||
| Discinesia | 25 | 15 |
| Hipercinesia | 10 | 5 |
| Hipocinesia | 9 | 8 |
| Mareos | 8 | 6 |
| SENSORES ESPECIALES, OTROS TRASTORNOS | ||
| Perversión del gusto | 1 | 0 |
| TRASTORNOS PSIQUIÁTRICOS | ||
| Ansiedad | 2 | 1 |
| Somnolencia | 2 | 0 |
| Agitación | 1 | 0 |
| TRASTORNOS DEL SISTEMA GASTROINTESTINAL | ||
| Náuseas | 14 | 8 |
| Diarrea | 10 | 4 |
| Dolor Abdominal | 8 | 4 |
| Estreñimiento | 6 | 4 |
| Vomitar | 4 | 1 |
| Boca seca | 3 | 0 |
| Dispepsia | 2 | 1 |
| Flatulencia | 2 | 0 |
| Gastritis | 1 | 0 |
| Trastornos gastrointestinales | 1 | 0 |
| TRASTORNOS DEL SISTEMA RESPIRATORIO | ||
| Disnea | 3 | 1 |
| TRASTORNOS DE PLÁTULAS, sangrado y atascamiento | ||
| Púrpura | 2 | 1 |
| TRASTORNOS DEL SISTEMA URINARIO | ||
| Decoloración de la orina | 10 | 0 |
| CUERPO COMO UN TODO - TRASTORNOS GENERALES | ||
| Dolor de espalda | 4 | 2 |
| Nosotros | 6 | 4 |
| Astenia | 2 | 1 |
| TRASTORNOS DE MECANISMO DE RESISTENCIA | ||
| Infección bacteriana | 1 | 0 |
Efectos del género y la edad sobre las reacciones adversas
No se observaron diferencias en la tasa de eventos adversos atribuibles a entacapona por edad o sexo.
Informes posteriores a la comercialización
Los siguientes informes espontáneos de acontecimientos adversos asociados temporalmente a Comtan se han identificado desde la introducción en el mercado y no se enumeran en la Tabla 4. Debido a que estas reacciones se notifican voluntariamente en una población de tamaño desconocido, no siempre es posible estimar de manera fiable su frecuencia o establecer una relación causal con la exposición a Comtan.
Se ha informado de hepatitis con características principalmente colestáticas.
Los datos posteriores a la comercialización incluyen varios casos de sobredosis. La dosis más alta notificada de entacapona fue de al menos 40.000 mg. Los síntomas y signos agudos comúnmente vistos en estos casos incluyeron somnolencia y disminución de la actividad, estados relacionados con el nivel de conciencia deprimido (por ejemplo, coma, confusión y desorientación) y decoloraciones de la piel, lengua y orina, así como inquietud, agitación y agresión.
La inhibición de COMT por el tratamiento con entacapona depende de la dosis. Una sobredosis masiva de Comtan (entacapona) teóricamente puede producir una inhibición del 100% de la enzima COMT en humanos, evitando así el metabolismo de los catecoles endógenos y exógenos.
La dosis diaria más alta administrada a humanos fue de 2.400 mg, administrada en un estudio como 400 mg seis veces al día con levodopa y carbidopa durante 14 días en 15 pacientes con enfermedad de Parkinson, y en otro estudio como 800 mg tres veces al día durante 7 días en 8 voluntarios sanos. A esta dosis diaria, las concentraciones plasmáticas máximas de entacapona promediaron 2.0 mcg por ml (a 45 minutos, en comparación con 1.0 mcg por ml y 1.2 mcg por ml con 200 mg de entacapona a los 45 minutos). El dolor abdominal y las heces blandas fueron los eventos adversos observados con mayor frecuencia durante este estudio. Dosis diarias de hasta 2.000 mg Comtan se ha administrado como 200 mg 10 veces al día con levodopa y carbidopa o levodopa y benserazida durante al menos 1 año en 10 pacientes, durante al menos 2 años en 8 pacientes y durante al menos 3 años en 7 pacientes. En general, sin embargo, la experiencia clínica con dosis diarias superiores a 1.600 mg es limitada
El rango de concentraciones plasmáticas letales de entacapona según los datos en animales fue de 80 mcg por ml a 130 mcg por ml en ratones. Se observaron dificultades respiratorias, ataxia, hipoactividad y convulsiones en ratones después de altas dosis orales (gavage).
Manejo de sobredosis
El tratamiento de la sobredosis de Comtan es sintomático, no existe un antídoto conocido para Comtan. Se recomienda la hospitalización y se indica atención de apoyo general. No hay experiencia con hemodiálisis o hemoperfusión, pero es poco probable que estos procedimientos sean beneficiosos, porque Comtan está altamente unido a las proteínas plasmáticas. Un lavado gástrico inmediato y dosis repetidas de carbón a lo largo del tiempo pueden acelerar la eliminación de Comtan al disminuir su absorción y reabsorción desde el tracto gastrointestinal (GI. Se debe controlar cuidadosamente la adecuación de los sistemas respiratorio y circulatorio y emplear medidas de apoyo adecuadas. Debe tenerse en cuenta la posibilidad de interacciones medicamentosas, especialmente con medicamentos estructurados con catecol
Febrero de 2016
However, we will provide data for each active ingredient
Disponible en países
 Argentina
Argentina Australia
Australia Austria
Austria Bangladesh
Bangladesh Belgium
Belgium Brazil
Brazil Bulgaria
Bulgaria Canada
Canada China
China Croatia (Hrvatska)
Croatia (Hrvatska) Cyprus
Cyprus Czech Republic
Czech Republic Denmark
Denmark Ecuador
Ecuador Egypt
Egypt Estonia
Estonia Finland
Finland France
France Germany
Germany Greece
Greece Hong Kong
Hong Kong Hungary
Hungary Iceland
Iceland Indonesia
Indonesia Ireland
Ireland Israel
Israel Italy
Italy Japan
Japan Latvia
Latvia Liechtenstein
Liechtenstein Lithuania
Lithuania Luxembourg
Luxembourg Malaysia
Malaysia Malta
Malta Netherlands
Netherlands New Zealand
New Zealand Norway
Norway Peru
Peru Philippines
Philippines Poland
Poland Portugal
Portugal Romania
Romania Serbia
Serbia Slovakia
Slovakia Slovenia
Slovenia South Africa
South Africa Spain
Spain Sweden
Sweden Switzerland
Switzerland Taiwan
Taiwan Thailand
Thailand Tunisia
Tunisia Turkey
Turkey United Kingdom
United Kingdom USA
USA Venezuela
Venezuela
