












































コンポーネント:
治療オプション:
Militian Inessa Mesropovna 、薬局による医学的評価、 最終更新日:26.06.2023

アテンション! そのこのページの情報は医療専門家のみを対象としています! その情報が収集したオープン源を含めることが可能である重大な誤差! 注意して、このページ上のすべての情報を再確認してください!


投薬形態と強さ。
カプセル。
- 2 mg:水色の不透明なキャップが付いた水色の不透明なボディ。 キャップに「2 MG」が印刷されています。
- 4 mg:「4。 キャップに印刷されたMG」。
- 6 mg:白い ⁇ と青の青い不透明なボディ。 キャップに「6 MG」が印刷された不透明なキャップ。
タブレット。
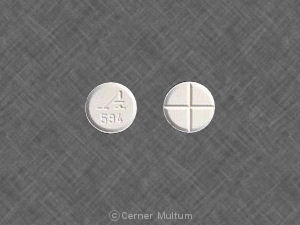
- 4 mgの白色、コーティングされていない錠剤で、四分円のスコアがあります。 一方は「A594」でデボス加工。
保管と取り扱い。
ZanaflexCapsules®。
ザナフレックスカプセル。®(塩酸チザニジン)カプセル。 2ピースのハードゼラチンカプセルを含む3つの強度で利用できます。 塩酸チザニジン2.29 mg、4.58 mg、6.87 mg、2 mg、4 mgに相当。 6 mgのチザニジンベース。.
- 2 mgのカプセルは、水色の不透明なボディとaを持っています。 キャップに「2 MG」が印刷された水色の不透明なキャップ:150カプセルのボトル。 (。NDC。 10144-602-15)。
- 4 mgのカプセルは、青の不透明な白い不透明なボディを持っています。 キャップに「4 MG」が印刷されたキャップ:150カプセルのボトル(。NDC。 10144-604-15)。
- 6 mgのカプセルは、白の青い不透明なボディを持っています。 カプセルに「6 MG」が印刷されたストライプと青の不透明なキャップ:150本のボトル。 カプセル(。NDC。 -10144-606-15)。
25°C(77°F)で保管してください。 15〜30°Cまでの遠足が許可されています。 (59–86°F)。. 容器に調剤します。 子供に安全な閉鎖付き。.
Zanaflex®タブレット。
ザナフレックス。®(塩酸チザニジン)錠剤です。 塩酸チザニジンを含む4 mgの白色コーティングされていない錠剤として入手可能。 4.58 mg、4 mgチザニジンベースに相当。. タブレットは四分の一を持っています。 一方のスコアと、もう一方の側に「A594」がデボスされます。. タブレットはです。 次のように提供されます:150錠のボトル(。NDC。 -10144-594-15)。.
25°C(77°F)で保管してください。 15〜30°Cまでの遠足が許可されています。 (59–86°F)。.
子供に安全なクロージャー付きの容器に分注します。.
販売および配布:Acorda Therapeutics Inc. ⁇ アーズリー、 NY 10502。. 改訂:2013年11月。.

Zanaflexは、中央のアルファ2アドレナリン作動性アゴニストです。 ⁇ 性の管理のために示されました。. の持続時間が短いため。 治療効果、Zanaflexによる治療は、それらのために毎日予約されるべきです。 ⁇ 性の緩和が最も重要である活動と時間。.

投薬情報。
ZanaflexCapsules®またはZanaflex®錠剤が処方されることがあります。 食べ物の有無にかかわらず。. 定式化が選択され、決定が下されると。 食品の有無にかかわらず服用するために、このレジメンは変更されるべきではありません。.
食品はチザニジンの薬物動態に複雑な影響を及ぼします。 処方によって異なります。. ZanaflexカプセルとZanaflex。 錠剤は、空腹時(3以上)で互いに生物学的に同等です。 食事の数時間後)、ただし摂食条件下ではありません(aの30分以内)。 食事)。. これらの薬物動態の違いは、臨床的に有意な結果をもたらす可能性があります。 タブレットとカプセルの投与を切り替えるときとときの違い。 供給状態または空腹状態の間の切り替え管理。. これらの変更により、可能性があります。 有害事象の増加、または活動の遅延またはより迅速な発症をもたらします。 スイッチの性質によって異なります。. このため、処方者はそうすべきです。 これらに関連する速度論の変化に完全に精通している。 異なる条件。.
推奨開始用量は2 mgです。. 効果があるからです。 Zanaflexの投与量は投与後約1〜2時間でピークに達し、消散します。 投与後3〜6時間の間に、6〜8時間で治療を繰り返すことができます。 必要に応じて、24時間で最大3回の投与間隔。.
投与量は、それぞれ2 mgから4 mgずつ徐々に増やすことができます。 投与量の増加の間に1〜4日、満足のいく減少まで。 筋肉の緊張が達成されます。. 1日の総投与量は36 mgを超えてはなりません。. 16 mgを超える単回投与は研究されていません。.
腎障害のある患者への投与。
Zanaflexは、患者には注意して使用する必要があります。 クリアランスとしての腎不全(クレアチニンクリアランス<25 mL / min)。 50%以上削減。. これらの患者では、滴定中に個人。 用量を減らす必要があります。. より高い用量が必要な場合は、むしろ個々の用量。 投与頻度よりも増やす必要があります。.
肝障害のある患者への投与。
Zanaflexは、患者の患者には注意して使用する必要があります。 肝障害。. これらの患者では、滴定中に個々の用量。 減らす必要があります。. より高い用量が必要な場合は、個々の用量ではなく。 投与頻度を増やす必要があります。. アミノトランスフェラーゼレベルのモニタリングです。 ベースラインに推奨され、最大投与量が達成されてから1か月後、または 肝障害が疑われる。.
薬物中止。
特に治療を中止する必要がある場合。 高用量(毎日20 mg〜36 mg)を長期間投与されている患者。 期間(9週間以上)または併用治療を受けている可能性のある人。 麻薬、用量はゆっくりと(1日あたり2 mg〜4 mg)減らす必要があります。 離脱およびリバウンド高血圧、頻脈のリスクを最小限に抑えます。 緊張 ⁇ 進。.

Zanaflexは、忍耐強い効力には禁 ⁇ です。 フルボキサミンやシプロフロキサシンなどのCYP1A2の阻害剤。.

警告。
の一部として含まれています。 注意。 セクション。.
注意。
低血圧。
チザニジンは、α2アドレナリン作動性アゴニストです。 低血圧を生成します。. 失神は市販後の設定で報告されています。. 重大な低血圧の可能性は、滴定によって最小限に抑えられる可能性があります。 投与量、および以前の低血圧の兆候と症状に注意を集中させること。 用量増加へ。. さらに、患者は仰 ⁇ 位から固定に移行します。 直立した姿勢は、低血圧および起立性のリスクが高くなる可能性があります。 効果。.
Zanaflexが患者に使用されるときの低血圧を監視します。 同時降圧療法を受けている。. それはお勧めしません。 Zanaflexは他のα2アドレナリン作動性アゴニストと一緒に使用されます。. 臨床的に。 有意な低血圧(収縮期血圧と拡張期血圧の両方で低下)があります。 フルボキサミンまたは シプロフロキサシンと4 mgのZanaflexの単回投与。. したがって、併用。 フルボキサミンまたはシプロフロキサシンを含むザナフレックスの、CYP1A2の強力な阻害剤、 禁 ⁇ です。.
肝障害のリスク。
Zanaflexは肝細胞肝障害を引き起こす可能性があります。. ザナフレックス。 肝障害のある患者には注意して使用する必要があります。.. アミノトランスフェラーゼレベルのモニタリングは、ベースラインと1か月に推奨されます。 最大投与量が達成された後、または肝障害が疑われる場合。.
鎮静。
Zanaflexは鎮静を引き起こす可能性があり、干渉する可能性があります。 日常の活動。. 複数回投与の研究では、患者の有病率。 滴定の最初の週の後に鎮静剤がピークに達し、その後残った。 研究の維持段階の期間中安定しています。. CNS。 Zanaflexのアルコールおよびその他のCNS抑制剤による抑制効果(例:.、。 ベンゾジアゼピン、オピオイド、三環系抗うつ薬)は相加的である可能性があります。. モニター。 過剰症状のために別のCNS抑制剤と一緒にZanaflexを服用している患者。 鎮静。.
幻覚/精神病のような症状。
ザナフレックスの使用は幻覚と関連しています。. 形成された視覚的な幻覚または妄想は、170のうち5つで報告されています。 北米で管理された2つの臨床試験の患者(3%)。. ほとんど。 患者はイベントが非現実的であることを知っていました。. 1人の患者が発達した。 幻覚に関連する精神病。. これら5人のうち1人の患者。 中止後少なくとも2週間は問題が発生し続けました。 チザニジン。. 幻覚を発症した患者のZanaflexの中止を検討してください。.
CYP1A2阻害剤との相互作用。
潜在的な薬物相互作用のために、Zanaflexはそうです。 などの強力なCYP1A2阻害剤を服用している患者には禁 ⁇ 。 フルボキサミンまたはシプロフロキサシン。. 低血圧などの副作用。 Zanaflexを併用すると、徐脈、または過度の眠気が発生する可能性があります。 ジリュートン、フルオロキノロンなどの他のCYP1A2阻害剤。 シプロフロキサシン(禁 ⁇ )、抗アリスミクス(アミオダロン、 メキシレチン、プロパフェノン)、シメチジン、ファモチジン、経口避妊薬、 アシクロビル、およびチクロピジン)。. 併用しない限り、併用は避けるべきです。 ザナフレックス療法の必要性は臨床的に明白です。. そのような場合は、と一緒に使用してください。 注意。.
過敏反応。
ザナフレックスはアナフィラキシーを引き起こす可能性があります。. 兆候と症状。 呼吸障害、じんま疹、喉の血管性浮腫など。 舌が報告されています。. 患者には兆候と通知を受ける必要があります。 重度のアレルギー反応の症状とZanaflexの中止を指示。 これらの兆候や症状が発生した場合は、直ちに医療を受けてください。.
患者の有害反応のリスク増加。 腎障害。
Zanaflexは、患者には注意して使用する必要があります。 クリアランスとしての腎不全(クレアチニンクリアランス<25 mL / min)。 50%以上削減。. これらの患者では、滴定中に個人。 用量を減らす必要があります。. より高い用量が必要な場合は、むしろ個々の用量。 投与頻度よりも増やす必要があります。. これらの患者は監視されるべきです。 一般的な有害事象の発症または重症度の増加については密接に(乾燥。 口、傾眠、無力症およびめまい)潜在的な過剰摂取の指標として。.
撤回副作用。
離脱の副作用にはリバウンドが含まれます。 高血圧、頻脈、および高張症。. これらのリスクを最小限に抑えるため。 反応、特に高用量(20〜 1日28 mg)長期間(9週間以上)または誰が服用しているか。 麻薬との併用治療では、用量をゆっくりと減らす必要があります(2から 1日あたり4 mg)。.
非臨床毒性学。
発がん、変異誘発、。 不妊の障害。
発がん。
チザニジンが投与された。 16 mg / kg /日までの経口投与で78週間マウスを投与します。 mg /m²ベースの最大推奨ヒト用量(MRHD)。. チザニジンはそうでした。 9 mg / kg /日までの経口投与で104週間ラットに投与されます。 mg /m²ベースでMRHDの2.5倍。. 腫瘍の増加もありませんでした。 種。.
変異誘発。
チザニジンはin vitroで陰性でした。 (細菌の逆突然変異[Ames]、哺乳類の遺伝子変異、および染色体。 哺乳動物細胞での収差試験)およびin vivo(骨髄小核、および 細胞遺伝学)アッセイ。.
不妊の障害。
の経口投与。 チザニジンは、その後の雄および雌ラットの生殖能力の低下をもたらしました。 それぞれ30および10 mg / kg /日の用量。. 出生率への影響は観察されなかった。 10(男性)および3(女性)mg / kg /日の用量で、約8および3です。 回、それぞれ、mg /m²ベースのMRHD)。.
特定の集団で使用します。
妊娠。
妊娠カテゴリーC
Zanaflexは妊娠中の女性では研究されていません。. ザナフレックス。 給付がリスクを上回る場合にのみ、妊婦に与えられるべきです。 胎児。. 3 mg / kgの用量でラットで行われた生殖試験。 mg /m²ベースで、ウサギでの最大推奨ヒト用量に等しい。 30 mg / kg、mg /m²ベースの最大推奨ヒト用量の16倍は、そうではありませんでした。 催奇形性の証拠を示す。. 以上の用量でのチザニジン。 mg /m²ベースで推奨される最大ヒト用量の8倍に増加しました。 ラットの妊娠期間。. 出生前と出生後の子犬の損失が増加しました。 発達遅延が発生しました。. 着床後の損失が増加しました。 1 mg / kg以上、0.5倍以上の用量のウサギ。 mg /m²ベースの最大推奨ヒト用量。.
授乳中の母親。
この薬がヒトに排 ⁇ されるかどうかは不明です。 牛乳。. 多くの薬物は母乳中に排 ⁇ されるため、注意が必要です。 Zanaflexが授乳中の女性に投与されるときに行使されます。.
小児用。
小児患者の安全と有効性はそうではありません。 設立されました。.
老人用。
ザナフレックスは、実質的に排 ⁇ されることが知られています。 腎臓、そしてこの薬に対する副作用のリスクはより大きなかもしれません。 腎機能障害のある患者。. 高齢患者の可能性が高いからです。 腎機能が低下するためには、用量選択に注意を払う必要があります。 腎機能を監視することは有用かもしれません。. ザナフレックスの臨床試験はそうしました。 決定するのに十分な数の65歳以上の被験者を含まない。 若い被験者とは異なる反応をするかどうか。. クロススタディの比較。 6 mg Zanaflexの単回投与後の薬物動態データの。 若い被験者が薬を4倍速くクリアしたことを示しました。 高齢者。. 腎不全(クレアチニン)の高齢患者。 クリアランス<25 mL / min)、チザニジンクリアランスは50%以上削減されます。 健康な高齢者と比較;これはaにつながると予想されます。 臨床効果の持続時間が長い。. 滴定中、個々の用量。 減らす必要があります。. より高い用量が必要な場合は、個々の用量ではなく。 投与頻度を増やす必要があります。. 高齢患者を監視する可能性があります。 Zanaflexに関連する副作用のリスクが高くなります。.
腎機能障害。
ザナフレックスは、実質的に排 ⁇ されることが知られています。 腎臓、そしてこの薬に対する副作用のリスクはより大きなかもしれません。 腎機能障害のある患者。. 腎不全患者。 (クレアチニンクリアランス<25 mL / min)クリアランスは50%以上減少しました。. これらの患者では、滴定中に個々の用量を減らす必要があります。. もし。 より高い用量が必要であり、投与頻度ではなく個々の用量が必要です。 増加する。. これらの患者は、発症または 一般的な有害事象(口渇、傾眠など)の重症度の増加。 無力症とめまい)潜在的な過剰摂取の指標として。.
肝機能障害。
肝障害の影響。 チザニジンの薬物動態は評価されていません。. チザニジンだからです。 肝臓で広範囲に代謝されると、肝障害が予想されます。 チザニジンの薬物動態に有意な影響を与える。..

CYP1A2阻害剤。
ザナフレックス間の相互作用。 フルボキサミンまたはシプロフロキサシンのいずれかが阻害による可能性が最も高い。 フルボキサミンまたはシプロフロキサシンによるCYP1A2。. フルボキサミンの効果。 Zanaflexの4 mg単回投与の薬物動態は、10人の健康で研究されました。 被験者。. チザニジンのCmax、AUC、および半減期は12倍に増加しました。 それぞれ33倍、3倍。. シプロフロキサシンの効果。 Zanaflexの4 mg単回投与の薬物動態は、10人の健康で研究されました。 被験者。. チザニジンのCmaxとAUCは7倍と10倍に増加しました。 それぞれ。.
ありませんでしたが。 他のCYP1A2阻害剤の影響を評価する臨床試験。 チザニジン、ジリュートン、他のフルオロキノロンなどの他のCYP1A2阻害剤。 抗アリスミクス(アミオダロン、メキシレチン、プロパフェノン、ベラパミル)、シメチジン、。 ファモチジン経口避妊薬、アシクロビル、チクロピジンも発生する可能性があります。 チザニジン血中濃度の大幅な増加。.
シトクロームのin vitro試験。 ヒト肝ミクロソームを使用したP450アイソザイムは、どちらもチザニジンではないことを示しています。 また、主要な代謝物は他の薬物の代謝に影響を与える可能性はありません。 チトクロームP450アイソザイムによって代謝されます。.
経口避妊薬。
特定の薬物動態研究はありません。 経口避妊薬と ザナフレックス。. 以下の母集団薬物動態データの遡及的分析。 しかし、4 mgのZanaflexの単回および複数回投与はそれを示した。 経口避妊薬を同時に服用している女性のクリアランスは50%低くなりました。 経口避妊薬を飲んでいない女性と比較したチザニジン。.
アセトアミノフェン。
チザニジンはのTmaxを遅らせました。 アセトアミノフェン16分。. アセトアミノフェンは薬物動態に影響を与えませんでした。 チザニジンの。.
アルコール。
アルコールはAUCを増やしました。 チザニジンは約20%増加しますが、Cmaxも増加します。 約15%。. これは、の副作用の増加と関連していた。 チザニジン。. チザニジンとアルコールのCNS抑制効果は相加的です。.

妊娠カテゴリーC
Zanaflexは妊娠中の女性では研究されていません。. ザナフレックス。 給付がリスクを上回る場合にのみ、妊婦に与えられるべきです。 胎児。. 3 mg / kgの用量でラットで行われた生殖試験。 mg /m²ベースで、ウサギでの最大推奨ヒト用量に等しい。 30 mg / kg、mg /m²ベースの最大推奨ヒト用量の16倍は、そうではありませんでした。 催奇形性の証拠を示す。. 以上の用量でのチザニジン。 mg /m²ベースで推奨される最大ヒト用量の8倍に増加しました。 ラットの妊娠期間。. 出生前と出生後の子犬の損失が増加しました。 発達遅延が発生しました。. 着床後の損失が増加しました。 1 mg / kg以上、0.5倍以上の用量のウサギ。 mg /m²ベースの最大推奨ヒト用量。.

以下の副作用については、他の場所で説明されています。 処方情報の他のセクション:。
- 低血圧。
- 肝障害。
- 鎮静。
- 幻覚/精神病のような症状。
- 過敏反応。
臨床試験の経験。
臨床試験は広く行われているためです。 さまざまな条件、臨床試験で観察された副作用率。 薬物は、別の臨床試験の率と直接比較することはできません。 薬物であり、臨床診療で観察された率を反映していない可能性があります。.
3つの二重盲検無作為化プラセボ対照。 -チザニジンの効果を評価するために臨床試験が行われました。 ⁇ 性コントロール。. 複数の患者を対象に2つの研究が行われた。 硬化症と脊髄損傷の患者に1つ。. 各研究には13週間ありました。 最大3週間の滴定段階を含むアクティブな治療期間。 3つの分割された用量、9週間のプラトーフェーズで36 mg /日まで許容用量。 ここで、チザニジンの用量は一定に保たれ、1週間の用量は ⁇ 減しました。. に。 全部で264人の患者がチザニジンを受け、261人の患者がプラセボを受けました。. 全体。 3つの研究患者の年齢は15〜69歳の範囲で、51.4%でした。 女性。. 高原相中の中央値は20〜28 mg /日の範囲でした。.
最も頻繁な副作用は複数で報告されます。 用量、プラセボ対照臨床試験、264人の患者を対象とした。 ⁇ 性は口渇、傾眠/鎮静、無力症(脱力感、疲労感)でした。 および/または疲労感)とめまい。. 患者の4分の3が評価しました。 軽度から中等度のイベントと患者の4分の1がイベントを評価しました。 厳しい。. これらのイベントは用量に関連しているように見えました。.
表1は、報告された兆候と症状を示しています。 3回の複数回投与のプラセボ対照試験で患者の2%以上。 ザナフレックスグループの頻度が高いザナフレックスを受け取った人。 プラセボ群よりも。. 比較のために、対応する頻度。 プラセボ治療患者間のイベント(患者100人あたり)も提供されます。.
表1:複数回投与、プラセボ対照試験-頻度。
(> 2%)Zanaflex Tabletsの発生率が報告されている有害反応。
プラセボより大きい。
| イベント。 | プラセボ。 N = 261。 %。 |
ザナフレックスタブレット。 N = 264。 %。 |
| 口渇。 | 10 | 49 |
| 傾眠。 | 10 | 48 |
| 無力症*。 | 16 | 41 |
| めまい。 | 4 | 16 |
| UTI。 | 7 | 10 |
| 感染。 | 5 | 6 |
| 便秘。 | 1 | 4 |
| 肝臓検査異常。 | 2 | 6 |
| ⁇ 吐。 | 0 | 3 |
| 音声障害。 | 0 | 3 |
| アンブリオピア(ぼやけたビジョン)。 | <1。 | 3 |
| 尿頻度。 | 2 | 3 |
| インフルエンザ症候群。 | 2 | 3 |
| ジスキネジア。 | 0 | 3 |
| 緊張。 | <1。 | 3 |
| ⁇ 頭炎。 | 1 | 3 |
| 鼻炎。 | 2 | 3 |
| *(脱力感、疲労感、および/または疲労感)。 |
単回投与では、プラセボ対照試験が含まれます。 多発性硬化症による ⁇ 性の患者142人(研究1)、患者は特に経験したかどうか尋ねられました。 最も一般的な4つの副作用のうち、口渇、傾眠(眠気)、。 無力症(脱力感、疲労感、疲労感)とめまい。. また、。 低血圧と徐脈が観察された。. これらの反応の発生です。 表2に要約。. その他のイベントは、一般的に2%の割合で報告されました。 以下。.
表2:単回投与、プラセボ対照試験—共通。
報告された有害反応。
| イベント。 | プラセボ。 N = 48。 %。 |
ザナフレックスタブレット、8mg、 N = 45。 %。 |
ザナフレックスタブレット、
16 mg、。 N = 49。 %。 |
| 傾眠。 | 31 | 78 | 92 |
| 口渇。 | 35 | 76 | 88 |
| 無力症*。 | 40 | 67 | 78 |
| めまい。 | 4 | 22 | 45 |
| 低血圧。 | 0 | 16 | 33 |
| 徐脈。 | 0 | 2 | 10 |
| *(脱力感、疲労感、および/または疲労感)。 |
市販後の経験。
以下の副作用が確認されています。 Zanaflexの承認後の使用中。. これらの反応が報告されているからです。 不確実なサイズの人口から自発的に、それは常に可能であるとは限りません。 それらの頻度を確実に推定するか、薬物との因果関係を確立します。 露出。.
傾眠、口渇などの特定のイベント。 低血圧、血圧低下、徐脈、めまい、脱力感、または。 無力症、筋肉のけいれん、幻覚、疲労、肝機能検査。 異常と肝毒性は、市販後および臨床で観察されています。 試験については、このドキュメントの前のセクションで説明します。.
以下の副作用が確認されています。 Zanaflexの市販後の経験で発生します。. に基づいて。 これらの反応、因果関係に関して提供された情報。 Zanaflexを完全に除外することはできません。. イベントは順にリストされています。 臨床的意義の低下;市販後の状況における重症度はそうではありません。 報告された。.
- スティーブンスジョンソン症候群。
- アナフィラキシー反応。
- 剥離性皮膚炎。
- 心室頻脈。
- 肝炎。
- けいれん。
- うつ病。
- 関節痛。
- 感覚異常。
- 発疹。
- 振戦。

安全監視データベースのレビューが明らかになりました。 意図的および偶発的なZanaflexの過剰摂取の症例。. いくつかのケース。 その結果、死亡し、意図的な過剰摂取の多くは複数でした。 CNS抑制剤を含む薬物。. チザニジンの臨床症状。 過剰摂取はその既知の薬理学と一致していた。. ほとんどの場合。 ⁇ 眠、傾眠、混乱を含むセンチュリウムの減少が観察されました。 そして ⁇ 睡。. うつ病の心機能も、ほとんどの場合を含めて観察されます。 徐脈と低血圧。. 呼吸抑制は別の一般的な機能です。 チザニジンの過剰摂取の。.
過剰摂取が発生した場合、妥当性を確保するための基本的な手順。 気道の監視と心血管および呼吸器系のモニタリング。 着手する必要があります。. チザニジンは脂溶性薬物であり、これだけです。 水とメタノールにわずかに溶ける。. したがって、透析はありそうにありません。 体から薬物を取り除く効率的な方法。. 一般に、症状。 チザニジンの中止後1〜3日以内に解決します。 適切な療法の投与。. 同様の作用機序により、 チザニジンの過剰摂取の症状と管理は、以下のものと同様です。 クロニジンの過剰摂取。. 管理に関する最新の情報について。 過剰摂取の場合は、毒物管理センターに連絡してください。.

吸収と分布。
経口投与後、チザニジンは本質的にです。 完全に吸収されました。. チザニジンの絶対的な経口バイオアベイラビリティはです。 約40%(CV = 24%)、広範囲にわたる初回通過肝代謝による。. チザニジンは体全体に広く分布しており、平均は安定しています。 静脈内投与後の分布の状態体積は2.4 L / kg(CV = 21%)。 健康な成人ボランティアの管理。. チザニジンは約30%です。 血漿タンパク質に結合しています。.
ZanaflexCapsules®とZanaflex®の違い。 タブレット。
ZanaflexCapsules®およびZanaflex®タブレットはそうです。 空腹時では生物学的に同等ですが、給餌されていません。 条件。. 2つの4 mg錠剤または2つの4 mgカプセルのいずれかの単回投与でした。 摂食および空腹時の条件下で、オープンラベル、4期間、投与されます。 96人のボランティアによる無作為化クロスオーバー研究。そのうち81人が適格でした。 統計分析。. 錠剤またはいずれかの経口投与後。 カプセル(空腹時)、チザニジンのピーク血漿濃度が発生しました。 投与後1.0時間、半減期は約2時間。. 2つの4 mg。 錠剤は食物とともに投与され、平均最大血漿濃度は 約30%増加し、ピーク血漿までの時間の中央値。 濃度は25分増加し、1時間25分になりました。. に。 対照的に、2つの4 mgカプセルが食物と一緒に投与された場合、平均は最大です。 血漿濃度は20%減少しました。これは、血漿のピークまでの時間の中央値です。 濃度は2〜3時間増加しました。. その結果、の平均Cmax。 食品と一緒に投与した場合のカプセルは、Cmaxの約66%です。 食品と一緒に投与した場合の錠剤。.
食物はまた、両方の吸収の程度を高めました。 タブレットとカプセル。. タブレットによる増加(約30%)は有意でした。 カプセルよりも大きい(〜10%)。. その結果、それぞれが投与されたとき。 食品の場合、カプセルから吸収される量は量の約80%でした。 タブレットから吸収されます。. 散りばめられたカプセル内容物の投与。 アップルソースは、無傷のカプセルの投与と生物学的に同等ではありませんでした。 空腹時状態。. アップルソースへのカプセル内容物の投与。 チザニジンのCmaxとAUCが15%〜20%増加し、15分になりました。 と比較して、ラグタイムとピーク濃度までの時間の中央値の減少。 空腹時の無傷カプセルの投与。.
図1:平均チザニジン濃度対. 時間。
Zanaflexタブレットおよびカプセル(2 ⁇ — 4 mg)のプロファイル(FastedおよびFed)。
条件。
代謝と排 ⁇ 。
チザニジンは直線的です。 臨床開発で研究された用量(1〜20 mg)にわたる薬物動態。. チザニジンの半減期は約2.5時間です(CV = 33%)。. 約。 投与量の95%が代謝されます。. 一次チトクロームP450。 チザニジン代謝に関与するイソ酵素はCYP1A2です。. チザニジン代謝物。 アクティブであることは知られていない。彼らの半減期は20〜40時間の範囲です。.
単一および複数に続く。 の経口投与。 14C-チザニジン、総放射能の平均60%および20%。 それぞれ尿と ⁇ 便で回収されました。.



