












































Komposition:
Anwendung:
Wird bei der Behandlung verwendet:
Medizinisch geprüft von Militian Inessa Mesropovna, Apotheke Zuletzt aktualisiert am 26.06.2023

Achtung! Die Informationen auf der Seite sind nur für medizinisches Fachpersonal! Die Informationen werden in öffentlichen Quellen gesammelt und können aussagekräftige Fehler enthalten! Seien Sie vorsichtig und überprüfen Sie alle Informationen auf dieser Seite!
Top 20 Medikamente mit den gleichen Inhaltsstoffen:


Dosierungsformen und Stärken
Kapseln
- 2 mg: Hellblauer undurchsichtiger Körper mit hellblauer undurchsichtiger Kappe mit "2 MG" auf der Kappe gedruckt
- 4 mg: Weißer undurchsichtiger Körper mit blauer undurchsichtiger Kappe mit „4 MG “auf der Kappe gedruckt
- 6 mg: Blauer undurchsichtiger Körper mit weißem Streifen und Blau undurchsichtige Kappe mit „6 MG“ auf der Kappe
Tabletten
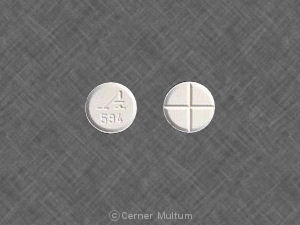
- 4 mg weiße, unbeschichtete Tabletten mit einer Quadrisekting-Punktzahl auf der einen Seite und mit „A594“ auf der anderen Seite geprägt
Lagerung und Handhabung
Zanaflex Capsules®
Zanaflex-Kapseln® (Tizanidinhydrochlorid) Kapseln sind in drei Stärken als zweiteilige Hartgelatinekapseln erhältlich Tizanidinhydrochlorid 2,29 mg, 4,58 mg und 6,87 mg, entsprechend 2 mg, 4 mg und 6 mg Tizanidinbase.
- Die 2 mg Kapseln haben einen hellblauen undurchsichtigen Körper mit einem hellblaue undurchsichtige Kappe mit „2 MG“ auf der Kappe: Flaschen mit 150 Kapseln (NDC 10144-602-15)
- Die 4 mg Kapseln haben einen weißen undurchsichtigen Körper mit einem blauen undurchsichtigen Körper Kappe mit „4 MG“ auf der Kappe: Flaschen mit 150 Kapseln (NDC 10144-604-15)
- Die 6 mg Kapseln haben einen blauen undurchsichtigen Körper mit einem weißen Streifen und blaue undurchsichtige Kappe mit „6 MG“ auf den Kapseln: Flaschen mit 150 Stück Kapseln (NDC -10144-606-15)
Bei 25 ° C lagern; Ausflüge bis 15–30 ° C erlaubt (59–86 ° F). Versand in Containern mit kindersicherem Verschluss.
Zanaflex® Tabletten
Zanaflex® (Tizanidinhydrochlorid) Tabletten sind erhältlich als 4 mg weiße, unbeschichtete Tabletten mit Tizanidinhydrochlorid 4,58 mg, entsprechend 4 mg Tizanidinbase. Die Tabletten haben eine Quadrisektion punkten auf der einen Seite und werden auf der anderen Seite mit „A594“ geprägt. Tabletten sind wie folgt bereitgestellt: Flaschen mit 150 Tabletten (NDC -10144-594-15).
Bei 25 ° C lagern; Ausflüge bis 15–30 ° C erlaubt (59–86 ° F).
Abgabe in Behältern mit kindersicherem Verschluss.
Vermarktete und vertriebene von: Acorda Therapeutics Inc.Ardsley, NY 10502. Überarbeitet: November 2013.

Zanaflex ist ein zentraler alpha-2-adrenerger Agonist angegeben für das Management der Spastik. Wegen der kurzen Dauer von therapeutische Wirkung, Behandlung mit Zanaflex sollte für diejenigen täglich reserviert werden Aktivitäten und Zeiten, in denen die Linderung von Spastik am wichtigsten ist.

Dosierungsinformationen
Zanaflex Capsules®- oder Zanaflex®-Tabletten können verschrieben werden mit oder ohne Essen. Sobald die Formulierung ausgewählt wurde und die Entscheidung Um mit oder ohne Nahrung zu nehmen, sollte dieses Regime nicht geändert werden.
Lebensmittel haben komplexe Auswirkungen auf die Pharmakokinetik von Tizanidin die sich von den verschiedenen Formulierungen unterscheiden. Zanaflex-Kapseln und Zanaflex Tabletten sind unter Fastenbedingungen bioäquivalent zueinander (mehr als 3 Stunden nach einer Mahlzeit), jedoch nicht unter gefütterten Bedingungen (innerhalb von 30 Minuten von a Essen). Diese pharmakokinetischen Unterschiede können zu klinisch signifikanten Ergebnissen führen Unterschiede beim Wechsel der Verabreichung von Tabletten und Kapseln und wann Umschaltverwaltung zwischen dem gefütterten oder nüchternen Zustand. Diese Änderungen können zu erhöhten unerwünschten Ereignissen oder zu einem verzögerten oder schnelleren Beginn der Aktivität führen abhängig von der Art des Schalters. Aus diesem Grund sollte der verschreibende Arzt mit den damit verbundenen Veränderungen in der Kinetik bestens vertraut sein unterschiedliche Bedingungen.
Die empfohlene Anfangsdosis beträgt 2 mg. Weil der Effekt von Zanaflex-Spitzen ungefähr 1 bis 2 Stunden nach der Dosis und löst sich auf Zwischen 3 und 6 Stunden nach der Dosis kann die Behandlung 6 bis 8 Stunden lang wiederholt werden Intervalle nach Bedarf auf maximal drei Dosen in 24 Stunden.
Die Dosierung kann schrittweise um jeweils 2 mg bis 4 mg erhöht werden Dosis mit 1 bis 4 Tagen zwischen der Dosierung erhöht, bis eine zufriedenstellende Reduktion erreicht ist des Muskeltonus wird erreicht. Die tägliche Gesamtdosis sollte 36 mg nicht überschreiten. Einzeldosen über 16 mg wurden nicht untersucht.
Dosierung bei Patienten mit Nierenfunktionsstörung
Zanaflex sollte bei Patienten mit mit Vorsicht angewendet werden Niereninsuffizienz (Kreatinin-Clearance <25 ml / min), wie die Clearance ist um mehr als 50% reduziert. Bei diesen Patienten während der Titration das Individuum Dosen sollten reduziert werden. Wenn höhere Dosen erforderlich sind, eher individuelle Dosen als die Dosierungshäufigkeit sollte erhöht werden.
Dosierung bei Patienten mit Leberfunktionsstörung
Zanaflex sollte bei Patienten mit Vorsicht angewendet werden Leberfunktionsstörung. Bei diesen Patienten während der Titration die Einzeldosen sollte reduziert werden. Wenn höhere Dosen erforderlich sind, eher individuelle Dosen als Die Dosierungshäufigkeit sollte erhöht werden. Die Überwachung der Aminotransferase-Spiegel erfolgt empfohlen für die Grundlinie und 1 Monat nach Erreichen der Maximaldosis oder wenn Leberschädigung wird vermutet.
Drogenabbruch
Wenn die Therapie abgebrochen werden muss, insbesondere in Patienten, die lange Zeit hohe Dosen (20 mg bis 36 mg täglich) erhalten haben Zeiträume (9 Wochen oder länger) oder mit denen gleichzeitig behandelt werden kann Betäubungsmittel sollte die Dosis langsam (2 mg bis 4 mg pro Tag) auf reduziert werden Minimieren Sie das Risiko von Entzug und Rückprallhypertonie, Tachykardie und Hypertonie.

Zanaflex ist bei Patienteninsuffizienz kontraindiziert Inhibitoren von CYP1A2 wie Fluvoxamin oder Ciprofloxacin.

WARNHINWEISE
Im Rahmen der enthalten VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Hypotonie
Tizanidin ist ein α2-adrenerger Agonist, der das kann Hypotonie erzeugen. In der Post-Marketing-Umgebung wurde über Synkope berichtet. Die Wahrscheinlichkeit einer signifikanten Hypotonie kann möglicherweise durch Titration von minimiert werden die Dosis und durch vorherige Aufmerksamkeit auf Anzeichen und Symptome einer Hypotonie um Fortschritt zu dosieren. Zusätzlich bewegen sich Patienten von einer Rückenlage zu einer festen Die aufrechte Position kann ein erhöhtes Risiko für Hypotonie und Orthostatik aufweisen Auswirkungen.
Überwachen Sie Hypotonie, wenn Zanaflex bei Patienten angewendet wird gleichzeitige blutdrucksenkende Therapie erhalten. Das wird nicht empfohlen Zanaflex wird zusammen mit anderen α2-adrenergen Agonisten angewendet. Klinisch signifikante Hypotonie (Abnahme sowohl des systolischen als auch des diastolischen Drucks) hat wurde bei gleichzeitiger Anwendung von Fluvoxamin oder berichtet Ciprofloxacin und Einzeldosen von 4 mg Zanaflex. Daher gleichzeitige Anwendung von Zanaflex mit Fluvoxamin oder mit Ciprofloxacin, wirksamen Inhibitoren von CYP1A2, ist kontraindiziert.
Risiko einer Leberschädigung
Zanaflex kann eine hepatozelluläre Leberschädigung verursachen. Zanaflex sollte bei Patienten mit Leberfunktionsstörung mit Vorsicht angewendet werden.. Die Überwachung der Aminotransferase-Spiegel wird für die Grundlinie und 1 Monat empfohlen nach Erreichen der Maximaldosis oder bei Verdacht auf Leberschädigung.
Sedierung
Zanaflex kann eine Sedierung verursachen, die stören kann alltägliche Aktivität. In den Mehrfachdosisstudien die Prävalenz von Patienten mit Sedierung erreichte nach der ersten Woche der Titration ihren Höhepunkt und blieb dann stabil für die Dauer der Erhaltungsphase der Studie. Das ZNS depressive Wirkungen von Zanaflex mit Alkohol und anderen ZNS-Depressiva (z., Benzodiazepine, Opioide, trizyklische Antidepressiva) können additiv sein. Überwachen Patienten, die Zanaflex zusammen mit einem anderen ZNS-Depressivum wegen übermäßiger Symptome einnehmen Beruhigung.
Halluzinose / psychotisch-ähnliche Symptome
Die Verwendung von Zanaflex wurde mit Halluzinationen in Verbindung gebracht. In 5 von 170 wurden geformte, visuelle Halluzinationen oder Wahnvorstellungen gemeldet Patienten (3%) in zwei von Nordamerika kontrollierten klinischen Studien. Die meisten von den Die Patienten waren sich bewusst, dass die Ereignisse unwirklich waren. Ein Patient entwickelte sich Psychose in Verbindung mit den Halluzinationen. Ein Patient unter diesen 5 hatte nach Absetzen mindestens 2 Wochen lang weiterhin Probleme Tizanidin. Erwägen Sie, Zanaflex bei Patienten mit Halluzinationen abzusetzen.
Wechselwirkung mit CYP1A2-Inhibitoren
Aufgrund möglicher Arzneimittelwechselwirkungen ist Zanaflex kontraindiziert bei Patienten, die wirksame CYP1A2-Inhibitoren einnehmen, wie z Fluvoxamin oder Ciprofloxacin. Nebenwirkungen wie Hypotonie Bradykardie oder übermäßige Schläfrigkeit können auftreten, wenn Zanaflex eingenommen wird andere CYP1A2-Inhibitoren wie Zileuton, andere Fluorchinolone als Ciprofloxacin (das kontraindiziert ist), Antiarrythmika (Amiodaron, Mexiletin, Propafenon), Cimetidin, Famotidin, orale Kontrazeptiva, Aciclovir und Ticlopidin). Die gleichzeitige Anwendung sollte vermieden werden, es sei denn, die Die Notwendigkeit einer Zanaflex-Therapie ist klinisch offensichtlich. In einem solchen Fall verwenden mit Vorsicht.
Überempfindlichkeitsreaktionen
Zanaflex kann eine Anaphylaxie verursachen. Anzeichen und Symptome einschließlich Atemkompromiss, Urtikaria und Angioödem des Rachens und Zunge wurden berichtet. Die Patienten sollten über die Anzeichen und informiert werden Symptome schwerer allergischer Reaktionen und Anweisung, Zanaflex abzusetzen und suchen Sie sofort medizinische Versorgung, falls diese Anzeichen und Symptome auftreten.
Erhöhtes Risiko für Nebenwirkungen bei Patienten mit Nierenfunktionsstörung
Zanaflex sollte bei Patienten mit mit Vorsicht angewendet werden Niereninsuffizienz (Kreatinin-Clearance <25 ml / min), wie die Clearance ist um mehr als 50% reduziert. Bei diesen Patienten während der Titration das Individuum Dosen sollten reduziert werden. Wenn höhere Dosen erforderlich sind, eher individuelle Dosen als die Dosierungshäufigkeit sollte erhöht werden. Diese Patienten sollten überwacht werden eng für den Beginn oder die Zunahme des Schweregrads der häufigen unerwünschten Ereignisse (trocken) Mund, Schläfrigkeit, Asthenie und Schwindel) als Indikatoren für eine mögliche Überdosierung.
Unerwünschte Reaktionen zurückziehen
Zu den Nebenwirkungen beim Entzug gehört der Rückprall Bluthochdruck, Tachykardie und Hypertonie. Um das Risiko dafür zu minimieren Reaktionen, insbesondere bei Patienten, die hohe Dosen erhalten haben (20 bis 28 mg täglich) für lange Zeiträume (9 Wochen oder länger) oder wer eingeschaltet sein kann Bei gleichzeitiger Behandlung mit Betäubungsmitteln sollte die Dosis langsam verringert werden (2 bis 4 mg pro Tag).
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Karzinogenese
Tizanidin wurde verabreicht Mäuse für 78 Wochen in oralen Dosen bis zu 16 mg / kg / Tag, was dem 2-fachen des ist empfohlene Höchstdosis für den Menschen (MRHD) auf mg / m²-Basis. Tizanidin war 104 Wochen lang an Ratten in oralen Dosen von bis zu 9 mg / kg / Tag verabreicht 2,5-fache MRHD auf mg / m²-Basis. Es gab auch keinen Anstieg der Tumoren Art.
Mutagenese
Tizanidin war in vitro negativ (bakterielle umgekehrte Mutation [Ames], Säugetiergenmutation und Chromosom Aberrationstest in Säugetierzellen) und in vivo (Knochenmarkmikronukleus und Zytogenetik) Assay.
Beeinträchtigung der Fruchtbarkeit
Orale Verabreichung von Tizanidin führte zu einer verringerten Fruchtbarkeit bei männlichen und weiblichen Ratten Dosen von 30 bzw. 10 mg / kg / Tag. Es wurde kein Einfluss auf die Fruchtbarkeit beobachtet in Dosen von 10 (männlich) und 3 (weiblich) mg / kg / Tag, die ungefähr 8 und 3 betragen mal die MRHD auf mg / m²-Basis).
Verwendung in bestimmten Populationen
Schwangerschaft
Schwangerschaftskategorie C
Zanaflex wurde bei schwangeren Frauen nicht untersucht. Zanaflex sollte schwangeren Frauen nur gegeben werden, wenn der Nutzen das Risiko für die überwiegt ungeborener Fötus. Reproduktionsstudien an Ratten in einer Dosis von 3 mg / kg gleich der empfohlenen Höchstdosis beim Menschen auf mg / m²-Basis und bei Kaninchen bei 30 mg / kg, 16-fache der empfohlenen Höchstdosis beim Menschen auf mg / m²-Basis, nicht Anzeichen von Teratogenität zeigen. Tizanidin in Dosen von und zu auf das 8-fache der empfohlenen Höchstdosis beim Menschen auf mg / m²-Basis erhöht Schwangerschaftsdauer bei Ratten. Der Verlust vor- und nachgeburtlicher Welpen war erhöht und Entwicklungsverzögerung trat auf. Der Verlust nach der Implantation war erhöht Kaninchen in Dosen von 1 mg / kg oder mehr, gleich oder größer als das 0,5-fache empfohlene Höchstdosis für den Menschen auf mg / m²-Basis.
Stillende Mütter
Es ist nicht bekannt, ob dieses Medikament beim Menschen ausgeschieden wird Milch. Da viele Medikamente in die Muttermilch übergehen, ist Vorsicht geboten ausgeübt, wenn Zanaflex einer stillenden Frau verabreicht wird.
Pädiatrische Anwendung
Sicherheit und Wirksamkeit bei pädiatrischen Patienten haben dies nicht getan wurde gegründet.
Geriatrische Anwendung
Es ist bekannt, dass Zanaflex von der im Wesentlichen ausgeschieden wird Niere, und das Risiko von Nebenwirkungen dieses Arzneimittels kann in größer sein Patienten mit eingeschränkter Nierenfunktion. Weil ältere Patienten wahrscheinlicher sind Um die Nierenfunktion zu verringern, sollte bei der Dosisauswahl Vorsicht geboten sein Es kann nützlich sein, die Nierenfunktion zu überwachen. Klinische Studien zu Zanaflex taten dies nicht genügend Probanden ab 65 Jahren zur Bestimmung einschließen ob sie anders reagieren als jüngere Probanden. Crossstudy-Vergleich von pharmakokinetischen Daten nach einmaliger Verabreichung von 6 mg Zanaflex zeigte, dass jüngere Probanden das Medikament viermal schneller räumten als das ältere Probanden. Bei älteren Patienten mit Niereninsuffizienz (Kreatinin) Clearance <25 ml / min), Tizanidin-Clearance ist um mehr als 50% reduziert im Vergleich zu gesunden älteren Probanden; Dies würde voraussichtlich zu a führen längere Dauer der klinischen Wirkung. Während der Titration die Einzeldosen sollte reduziert werden. Wenn höhere Dosen erforderlich sind, eher individuelle Dosen als Die Dosierungshäufigkeit sollte erhöht werden. Überwachen Sie ältere Patienten, weil sie können ein erhöhtes Risiko für Nebenwirkungen im Zusammenhang mit Zanaflex haben.
Beeinträchtigte Nierenfunktion
Es ist bekannt, dass Zanaflex von der im Wesentlichen ausgeschieden wird Niere, und das Risiko von Nebenwirkungen dieses Arzneimittels kann in größer sein Patienten mit eingeschränkter Nierenfunktion. Bei Patienten mit Niereninsuffizienz Die Clearance (Kreatinin-Clearance <25 ml / min) wurde um mehr als 50% verringert. Bei diesen Patienten sollten während der Titration die Einzeldosen reduziert werden. Wenn höhere Dosen sind erforderlich, individuelle Dosen anstelle der Dosierungshäufigkeit sollten erhöht werden. Diese Patienten sollten engmaschig auf den Beginn oder überwacht werden Zunahme der Schwere der häufigen unerwünschten Ereignisse (trockener Mund, Schläfrigkeit, Asthenie und Schwindel) als Indikatoren für eine mögliche Überdosierung.
Beeinträchtigte Leberfunktion
Der Einfluss der Leberfunktionsstörung auf die Die Pharmakokinetik von Tizanidin wurde nicht bewertet. Weil Tizanidin ist In der Leber weitgehend metabolisiert, ist eine Leberfunktionsstörung zu erwarten haben signifikante Auswirkungen auf die Pharmakokinetik von Tizanidin..

CYP1A2-Inhibitoren
Die Interaktion zwischen Zanaflex und entweder Fluvoxamin oder Ciprofloxacin ist höchstwahrscheinlich auf die Hemmung von zurückzuführen CYP1A2 durch Fluvoxamin oder Ciprofloxacin. Die Wirkung von Fluvoxamin auf die Die Pharmakokinetik einer einzelnen 4-mg-Dosis Zanaflex wurde bei 10 gesunden Personen untersucht Themen. Die Cmax, AUC und Halbwertszeit von Tizanidin nahmen um das 12-fache zu 33-fach bzw. 3-fach. Die Wirkung von Ciprofloxacin auf die Die Pharmakokinetik einer einzelnen 4-mg-Dosis Zanaflex wurde bei 10 gesunden Personen untersucht Themen. Die Cmax und AUC von Tizanidin nahmen um das 7-fache und das 10-fache zu beziehungsweise.
Obwohl es keine gab klinische Studien zur Bewertung der Auswirkungen anderer CYP1A2-Inhibitoren auf Tizanidin, andere CYP1A2-Inhibitoren wie Zileuton, andere Fluorchinolone Antiarrythmika (Amiodaron, Mexiletin, Propafenon und Verapamil), Cimetidin, famotidin orale Kontrazeptiva, Aciclovir und Ticlopidin, können ebenfalls dazu führen signifikanter Anstieg der Tizanidin-Blutkonzentrationen.
In-vitro-Studien zu Cytochrom P450-Isoenzyme mit menschlichen Lebermikrosomen weisen darauf hin, dass keines von Tizanidin vorliegt Weder die Hauptmetaboliten beeinflussen wahrscheinlich den Stoffwechsel anderer Medikamente metabolisiert durch Cytochrom P450-Isoenzyme.
Orale Verhütungsmittel
Keine spezifische pharmakokinetische Studie wurde durchgeführt, um die Wechselwirkung zwischen oralen Kontrazeptiva und zu untersuchen Zanaflex. Rückwirkende Analyse der populationspharmakokinetischen Daten nach Die einmalige und mehrfache Verabreichung von 4 mg Zanaflex zeigte dies jedoch Frauen, die gleichzeitig orale Kontrazeptiva einnahmen, hatten eine um 50% geringere Clearance von Tizanidin im Vergleich zu Frauen, die keine oralen Kontrazeptiva einnehmen.
Acetaminophen
Tizanidin verzögerte die Tmax von Paracetamol um 16 Minuten. Acetaminophen hatte keinen Einfluss auf die Pharmakokinetik von Tizanidin.
Alkohol
Alkohol erhöhte die AUC von Tizanidin um ungefähr 20%, während gleichzeitig seine Cmax um erhöht wird ungefähr 15%. Dies war mit einer Zunahme der Nebenwirkungen von verbunden Tizanidin. Die ZNS-depressiven Wirkungen von Tizanidin und Alkohol sind additiv.

Schwangerschaftskategorie C
Zanaflex wurde bei schwangeren Frauen nicht untersucht. Zanaflex sollte schwangeren Frauen nur gegeben werden, wenn der Nutzen das Risiko für die überwiegt ungeborener Fötus. Reproduktionsstudien an Ratten in einer Dosis von 3 mg / kg gleich der empfohlenen Höchstdosis beim Menschen auf mg / m²-Basis und bei Kaninchen bei 30 mg / kg, 16-fache der empfohlenen Höchstdosis beim Menschen auf mg / m²-Basis, nicht Anzeichen von Teratogenität zeigen. Tizanidin in Dosen von und zu auf das 8-fache der empfohlenen Höchstdosis beim Menschen auf mg / m²-Basis erhöht Schwangerschaftsdauer bei Ratten. Der Verlust vor- und nachgeburtlicher Welpen war erhöht und Entwicklungsverzögerung trat auf. Der Verlust nach der Implantation war erhöht Kaninchen in Dosen von 1 mg / kg oder mehr, gleich oder größer als das 0,5-fache empfohlene Höchstdosis für den Menschen auf mg / m²-Basis.

Die folgenden Nebenwirkungen werden an anderer Stelle beschrieben in anderen Abschnitten der Verschreibungsinformationen:
- Hypotonie
- Leberverletzung
- Sedierung
- Halluzinose / psychotisch-ähnliche Symptome
- Überempfindlichkeitsreaktionen
Erfahrung in klinischen Studien
Weil klinische Studien unter weit verbreitet sind unterschiedliche Bedingungen, in den klinischen Studien von beobachtete Nebenwirkungsraten Ein Medikament kann nicht direkt mit den Raten in den klinischen Studien eines anderen verglichen werden Arzneimittel und spiegelt möglicherweise nicht die in der klinischen Praxis beobachteten Raten wider.
Drei doppelblinde, randomisierte, placebokontrollierte -klinische Studien wurden durchgeführt, um die Wirkung von Tizanidin auf zu bewerten Spastikkontrolle. Zwei Studien wurden bei Patienten mit mehreren durchgeführt Sklerose und eine bei Patienten mit Rückenmarksverletzung. Jede Studie hatte eine 13-wöchige aktive Behandlungsdauer, die eine maximal 3-wöchige Titrationsphase umfasste tolerierte Dosis bis zu 36 mg / Tag in drei aufgeteilten Dosen, einer 9-wöchigen Plateau-Phase wo die Dosis von Tizanidin konstant gehalten wurde und sich eine Dosis von 1 Woche verjüngte. Im Alle 264 Patienten erhielten Tizanidin und 261 Patienten Placebo. Gegenüber Das Alter der drei Studienpatienten lag zwischen 15 und 69 Jahren und 51,4 Prozent Frauen. Die mittlere Dosis während der Plateau-Phase lag zwischen 20 und 28 mg / Tag.
Die häufigsten Nebenwirkungen wurden mehrfach gemeldet Dosis, placebokontrollierte klinische Studien mit 264 Patienten mit Spastik waren Mundtrockenheit, Schläfrigkeit / Sedierung, Asthenie (Schwäche, Müdigkeit und / oder Müdigkeit) und Schwindel. Drei Viertel der Patienten bewerteten die Ereignisse als leicht bis mittelschwer und ein Viertel der Patienten bewertete die Ereignisse als schwer sein. Diese Ereignisse schienen dosisabhängig zu sein.
In Tabelle 1 sind Anzeichen und Symptome aufgeführt, über die berichtet wurde mehr als 2% der Patienten in drei placebokontrollierten Mehrfachdosisstudien der Zanaflex erhielt, wo die Frequenz in der Zanaflex-Gruppe größer war als die Placebogruppe. Zu Vergleichszwecken die entsprechende Häufigkeit von Das Ereignis (pro 100 Patienten) bei mit Placebo behandelten Patienten wird ebenfalls angegeben.
Tabelle 1: Mehrfachdosis, placebokontrollierte Studien - Häufig
(> 2%) Unerwünschte Reaktionen, für die die Inzidenz von Zanaflex-Tabletten gemeldet wurde
Größer als Placebo
| Ereignis | Placebo N = 261 % |
Zanaflex Tablette N = 264 % |
| Trockener Mund | 10 | 49 |
| Schläfrigkeit | 10 | 48 |
| Asthenie * | 16 | 41 |
| Schwindel | 4 | 16 |
| UTI | 7 | 10 |
| Infektion | 5 | 6 |
| Verstopfung | 1 | 4 |
| Lebertestanomalie | 2 | 6 |
| Erbrechen | 0 | 3 |
| Sprachstörung | 0 | 3 |
| Amblyopie (verschwommene Sicht) | <1 | 3 |
| Harnfrequenz | 2 | 3 |
| Grippesyndrom | 2 | 3 |
| Dyskinesie | 0 | 3 |
| Nervosität | <1 | 3 |
| Pharyngitis | 1 | 3 |
| Rhinitis | 2 | 3 |
| * (Schwäche, Müdigkeit und / oder Müdigkeit) |
In der Einzeldosis eine placebokontrollierte Studie mit Bei 142 Patienten mit Spastik aufgrund von Multipler Sklerose (Studie 1) wurden die Patienten speziell gefragt, ob sie welche erlebt hatten der vier häufigsten Nebenwirkungen: Mundtrockenheit, Schläfrigkeit (Drinessigkeit), Asthenie (Schwäche, Müdigkeit und / oder Müdigkeit) und Schwindel. Zusätzlich, Hypotonie und Bradykardie wurden beobachtet. Das Auftreten dieser Reaktionen ist zusammengefasst in Tabelle 2. Andere Ereignisse wurden im Allgemeinen mit einer Rate von 2% gemeldet oder weniger.
Tabelle 2: Einzeldosis, placebokontrollierte Studie - Häufig
Unerwünschte Reaktionen gemeldet
| Ereignis | Placebo N = 48 % |
Zanaflex-Tablette, 8 mg N = 45 % |
Zanaflex Tablette,
16 mg N = 49 % |
| Schläfrigkeit | 31 | 78 | 92 |
| Trockener Mund | 35 | 76 | 88 |
| Asthenie * | 40 | 67 | 78 |
| Schwindel | 4 | 22 | 45 |
| Hypotonie | 0 | 16 | 33 |
| Bradykardie | 0 | 2 | 10 |
| * (Schwäche, Müdigkeit und / oder Müdigkeit) |
Post-Marketing-Erfahrung
Die folgenden Nebenwirkungen wurden identifiziert während der Anwendung von Zanaflex nach der Zulassung. Weil diese Reaktionen gemeldet werden freiwillig aus einer Bevölkerung von ungewisser Größe ist dies nicht immer möglich ihre Häufigkeit zuverlässig abschätzen oder einen kausalen Zusammenhang mit dem Medikament herstellen Exposition.
Bestimmte Ereignisse wie Schläfrigkeit, Mundtrockenheit Hypotonie, verminderter Blutdruck, Bradykardie, Schwindel, Schwäche oder Asthenie, Muskelkrämpfe, Halluzinationen, Müdigkeit, Leberfunktionstest Anomalie und Hepatotoxizität wurden nach dem Inverkehrbringen und in der klinischen Prüfung beobachtet Versuche und werden in früheren Abschnitten dieses Dokuments diskutiert.
Die folgenden Nebenwirkungen wurden als identifiziert in der Post-Marketing-Erfahrung von Zanaflex auftreten. Basierend auf dem Informationen zu diesen Reaktionen, ein kausaler Zusammenhang mit Zanaflex kann nicht vollständig ausgeschlossen werden. Die Ereignisse sind in der Reihenfolge aufgeführt abnehmende klinische Bedeutung; Schweregrad in der Post-Marketing-Umgebung ist nicht gemeldet.
- Stevens-Johnson-Syndrom
- Anaphylaktische Reaktion
- Peeling-Dermatitis
- Ventrikuläre Tachykardie
- Hepatitis
- Krämpfe
- Depression
- Arthralgie
- Parästhesie
- Hautausschlag
- Zittern

Eine Überprüfung der Sicherheitsüberwachungsdatenbank ergab Fälle von absichtlicher und versehentlicher Überdosierung mit Zanaflex. Einige der Fälle führte zum Tod und viele der absichtlichen Überdosierungen waren mit mehreren Medikamente einschließlich ZNS-Depressiva. Die klinischen Manifestationen von Tizanidin Eine Überdosierung stimmte mit der bekannten Pharmakologie überein. In den meisten Fällen Es wurde eine Abnahme des Sensoriums beobachtet, einschließlich Lethargie, Schläfrigkeit und Verwirrung und Koma. Eine depressive Herzfunktion wird auch am häufigsten beobachtet Bradykardie und Hypotonie. Atemdepression ist ein weiteres gemeinsames Merkmal der Überdosierung mit Tizanidin.
Sollte eine Überdosierung auftreten, grundlegende Schritte, um die Angemessenheit sicherzustellen einer Atemwege und die Überwachung von Herz-Kreislauf- und Atmungssystemen sollte unternommen werden. Tizanidin ist ein lipidlösliches Medikament, das nur ist in Wasser und Methanol schwer löslich. Daher ist eine Dialyse wahrscheinlich nicht möglich eine effiziente Methode zum Entfernen von Medikamenten aus dem Körper. Im Allgemeinen Symptome Absetzen innerhalb von ein bis drei Tagen nach Absetzen von Tizanidin und Verabreichung einer geeigneten Therapie. Aufgrund des ähnlichen Wirkmechanismus Die Symptome und das Management einer Überdosierung mit Tizanidin sind ähnlich wie im Folgenden Überdosierung mit Clonidin. Für die neuesten Informationen zum Management Wenden Sie sich bei Überdosierung an ein Giftnotrufzentrum.

Absorption und Verteilung
Nach oraler Verabreichung ist Tizanidin im Wesentlichen vollständig absorbiert. Die absolute orale Bioverfügbarkeit von Tizanidin ist ungefähr 40% (CV = 24%) aufgrund eines umfassenden Leberstoffwechsels im ersten Durchgang. Tizanidin ist mit einer mittleren Steady im ganzen Körper weit verbreitet Zustandsverteilungsvolumen von 2,4 l / kg (CV = 21%) nach intravenösem Verabreichung bei gesunden erwachsenen Freiwilligen. Tizanidin beträgt ungefähr 30% an Plasmaproteine gebunden.
Unterschiede zwischen Zanaflex Capsules® und Zanaflex® Tabletten
Zanaflex Capsules® und Zanaflex® Tabletten sind bioäquivalent zueinander unter Fastenbedingungen, aber nicht unter gefüttert Bedingungen. Eine Einzeldosis von entweder zwei 4-mg-Tabletten oder zwei 4-mg-Kapseln war unter Fütterungs- und Fastenbedingungen auf offenem Etikett, vier Perioden, verabreicht randomisierte Crossover-Studie an 96 freiwilligen Helfern, für die 81 berechtigt waren die statistische Analyse. Nach oraler Verabreichung der Tablette oder Kapsel (im nüchternen Zustand) traten maximale Plasmakonzentrationen von Tizanidin auf 1,0 Stunden nach der Dosierung mit einer Halbwertszeit von ca. 2 Stunden. Wenn zwei 4 mg Tabletten wurden mit Lebensmitteln verabreicht, die mittlere maximale Plasmakonzentration war erhöht um ungefähr 30% und die mittlere Zeit bis zum Peak-Plasma Die Konzentration wurde um 25 Minuten auf 1 Stunde und 25 Minuten erhöht. Im Im Gegensatz dazu, wenn zwei 4-mg-Kapseln mit Lebensmitteln verabreicht wurden, das mittlere Maximum Die Plasmakonzentration war um 20% verringert, die mittlere Zeit bis zum Peak-Plasma Die Konzentration wurde um 2 bis 3 Stunden erhöht. Folglich ist der mittlere Cmax für die Kapsel bei Verabreichung mit der Nahrung beträgt ungefähr 66% der Cmax für die Tablette bei Verabreichung mit Nahrung.
Lebensmittel erhöhten auch das Absorptionsgrad für beide Tabletten und Kapseln. Der Anstieg mit der Tablette (~ 30%) war signifikant größer als bei der Kapsel (~ 10%). Folglich, wenn jeder verabreicht wurde Bei Lebensmitteln betrug die von der Kapsel aufgenommene Menge etwa 80% der Menge von der Tablette absorbiert. Verabreichung des Kapselinhalts aufgespritzt Apfelmus war nicht bioäquivalent zur Verabreichung einer intakten Kapsel unter Fastenbedingungen. Verabreichung des Kapselinhalts auf Apfelmus führte zu einem Anstieg von Cmax und AUC von Tizanidin um 15% bis 20% und einer 15-minütigen Erhöhung Abnahme der mittleren Verzögerungszeit und -zeit bis zur Spitzenkonzentration im Vergleich zu Verabreichung einer intakten Kapsel beim Fasten.
Abbildung 1: Mittlere Tizanidinkonzentration vs. Zeit
Profile für Zanaflex-Tabletten und -Kapseln (2 - 4 mg) unter Fasten und Fütterung
Bedingungen
Stoffwechsel und Ausscheidung
Tizanidin hat linear Pharmakokinetik über die in der klinischen Entwicklung untersuchten Dosen (1–20 mg). Tizanidin hat eine Halbwertszeit von ungefähr 2,5 Stunden (CV = 33%). Ungefähr 95% einer verabreichten Dosis werden metabolisiert. Das primäre Cytochrom P450 Am Tizanidin-Metabolismus beteiligtes Isoenzym ist CYP1A2. Tizanidin-Metaboliten sind nicht als aktiv bekannt; Ihre Halbwertszeiten reichen von 20 bis 40 Stunden.
Einzel und mehrfach folgen orale Dosierung von 14C-Tizanidin, durchschnittlich 60% und 20% der gesamten Radioaktivität wurde im Urin bzw. Kot gewonnen.



