
コンポーネント:
作用機序:
Oliinyk Elizabeth Ivanovna 、薬局による医学的評価、 最終更新日:26.06.2023

アテンション! そのこのページの情報は医療専門家のみを対象としています! その情報が収集したオープン源を含めることが可能である重大な誤差! 注意して、このページ上のすべての情報を再確認してください!
同じ成分を持つトップ20の薬:

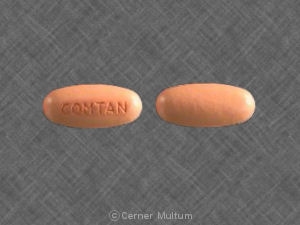
コムタン

コムタン(エンタカポネ) 経口投与のための200mgのフィルム上塗を施してあるタブレットとして供給さ 楕円形の錠剤は、茶色がかったオレンジ色で、無香料で、片側にエンボス加工された"Comtan"です。 錠剤は、以下のようにHDPE容器内に提供される:
ボトル100 NDC 0078-0327-05
25°C(77°F)の店、15°Cへの30°C(59°Fへの86°F)に許可される脱線。
製造:オリオン社、オリオンファーマ(エスポー、フィンランド)。 改訂:Feb2016

Comtanはlevodopaおよびcarbidopaへの付加物としてパーキンソン病の患者の終りの線量"身に着けている"扱うために示されます(見て下さい 臨床薬理学, 臨床研究).
Comtanの有効性は、投与終了時の"着用オフ"を経験しないパーキンソン病患者において体系的に評価されていない。

Comtan(エンタカポン)の推奨用量は、各レボドパおよびカルビドパ用量と同時に投与される200mg錠剤であり、毎日8回(200mg x8=1,600mg/日)の最大投与量である。 1,600mgの上の毎日の線量との臨床経験は限られています。
Comtanは常にlevodopaおよびcarbidopaと関連して投与されるべきである。 エンタカポンは、それ自身の抗パーキンソン作用を有さない。
臨床研究では、レボドパの日用量が800mg以上であった場合、または治療を開始する前に中等度または重度のジスキネジーがあった場合、大多数の患者
個々の患者の応答を最適化するためには、毎日のレボドパ用量の減少または用量間の間隔の延長が必要であり得る。 臨床調査では、毎日のlevodopaの線量の平均減少はlevodopaの線量の減少を要求するそれらの患者の約25%でした。 (レボドパ用量が58mgを超える患者の800%以上が毎日そのような減少を必要とした。)
Comtanは、レボドパおよびカルビドパの即時放出および持続放出製剤の両方と組み合わせることができる。
Comtanは食糧の有無にかかわらず取られるかもしれません( 臨床薬理学).
肝機能障害のある患者
肝機能障害を有する患者は注意して治療すべきである。 エンタカポンのAUCおよびCmaxは、コントロールと比較して、文書化された肝疾患を有する患者で約倍増した。 しかしながら、これらの研究は、レボドパおよびドーパデカルボキシラーゼ阻害剤の同時投与を伴わない単回投与エンタカポンで行われたため、慢性投与エンタカポンの動態に及ぼす肝疾患の影響は評価されていない(参照 臨床薬理学, エンタカポンの薬物動態).
Comtanからの患者の撤退
Comtanの線量の急速な回収か突然の減少はパーキンソン病の印そして徴候の出現の原因となることができます(見て下さい 臨床薬理学, 臨床研究nmsに似た症状の複合体である高発熱および混乱を引き起こす可能性があります(参照 注意事項, ドーパミン作動性療法で報告されたその他のイベント). この症候群は、高熱または重度の剛性を発症する患者の鑑別診断において考慮されるべきである。 Comtanによる治療を中止する決定が下された場合は、患者を注意深く監視し、必要に応じて他のドーパミン作動性治療を調整する必要があります。 テーパーコンタンは体系的に評価されていないが、治療を中止する決定がなされた場合、患者をゆっくりと撤回することが賢明であると思われる。

Comtanは、薬物またはその成分に対する過敏症を示した患者には禁忌である。

警告
モノアミンオキシダーゼ(MAO)とCOMTは二つの主要な酵素である カテコールアミンの代謝に関与する系。 それは理論的には したがって、Comtan(エンタカポン)とaの組み合わせが可能であること 非選択的MAO阻害剤(例えば、フェネルジンおよびトラニルシプロミン)は、 正常に責任がある経路の大部分の阻害において カテコールアミン代謝 このため、患者は通常行われるべきではありません Comtanおよび非選択的MAO阻害剤を併用した。
エンタカポンは選択的と同時に取ることができます MAO-B阻害剤(例えば、セレギリン)。
カテコール-O-メチルトランスフェラーゼによって代謝される薬物(COMT)
エンタカポンの単一の400mgの線量がと与えられたとき 静脈内イソプレナリン(イソプロテレノール)およびエピネフリンを同時投与しないで levodopaおよびdopaのdecarboxylaseの抑制剤、全面的な平均の最高の変更 注入中の心拍数は、プラセボよりも約50%および80%高かった。 イソプレナリンとエピネフリン、それぞれ。
したがって、COMTによって代謝されることが知られている薬物など イソプロテレノール、エピネフリン、ノルエピネフリン、ドーパミン、ドブタミン, アルファメチルドパ、アポモルフィン、イソサリン、ビトルテロールは にもかかわらずentacaponeを受け取っている患者で注意して管理される 投与経路(吸入を含む)は、それらの相互作用が生じる可能性があるため 増加した心拍数、可能性のある不整脈、および血圧の過度の変化において。
心室頻拍は、32歳で認められました エピネフリン注入後の相互作用の研究における健康な男性ボランティアと 経口エンタカポン投与。 プロプラノロールによる治療が必要であった。 A エンタカポン投与との因果関係は可能性があるように見えますが、できません 確かに起因する。
日常生活や傾眠の活動中に眠りに落ちる
Comtanで治療されたパーキンソン病の患者, 血しょうlevodopaのレベルを、またはlevodopaと増加するかどれが突然報告しました 活動に従事している間sleepinessの前の警告なしで眠りに落ちること (自動車の運転を含む)日常生活の。 これらのいくつか エピソードの結果、挟んだりしないでください。 これらの患者の多くは報告しましたが comtanで傾眠している間、いくつかは、次のような警告標識を知覚しませんでした 過度の眠気、そして彼らは直前に警戒していたと信じていました イベントです。 これらのイベントのいくつかは、一年後に遅く報告されています 治療の開始。
傾眠のリスクが増加した(Comtan2%および 対照試験におけるプラセボ0%). 眠りに落ちることが報告されています 日常生活の活動に従事しながら、常に既存の設定で発生します 傾眠、患者はそのような歴史を与えないかもしれませんが. このため, 処方者は、特に眠気や眠気のために患者を再評価する必要があります イベントのいくつかは治療開始後によく起こるので. プロセッサー また、患者が眠気や眠気を認めない可能性があることに注意する必要があります 特定の間に眠気や眠気について直接質問されるまで 活動内容. 患者は運転中に注意を払うように勧められるべきです, Comtanとの処置の間の高さで作動機械、か働くこと. すでに傾眠および/または突然のエピソードを経験している患者 睡眠開始は、治療中にこれらの活動に参加すべきではありません コムタン
Comtanによる治療を開始する前に、患者に助言する 眠気を発症し、具体的にはその要因について尋ねる可能性の 鎮静薬の併用など、このリスクを高める可能性があります。 睡眠障害の存在。 患者が昼間の眠気を発症した場合、または 積極的な参加を必要とする活動中に眠りに落ちるエピソード (例えば、会話、食べるなど。)、Comtanは通常中止されるべきです (参照 適量および管理 Comtanの中止に関するガイダンスのために)。 もし Comtanを継続することが決定され、患者はしないように助言されるべきである ドライブと他の潜在的に危険な活動を避けるために。 そこには 線量の減少が除去するかどうか確立する不十分な情報 日常生活の活動に従事している間に眠りに落ちるエピソード。
注意事項
低血圧、起立性低血圧、および失神
パーキンソン病の患者のDopaminergic療法は持っています 起立性低血圧に関連付けられています。 エンタカポンはレボドパを増強する 従って生物学的利用能は発生をの高めると期待され、 起立性低血圧。 対照研究では、約1.2%および0.8%の 200mgのエンタカポンおよびプラセボ患者は、それぞれ、少なくとも一つを報告した 失神のエピソード。 失神の報告は、一般的に患者でより頻繁であった 文書化された低血圧のエピソードがあった両方の処置のグループで。
幻覚および精神病のような行動
パーキンソン病患者におけるドーパミン作動性療法 幻覚と関連しています 臨床研究では、幻覚 患者の0.8%および0%において薬物中止および早期離脱につながった それぞれ200mgのコムタンおよびプラセボで治療した。 幻覚はにつながった 1.0%および0.3%の患者における入院200mg Comtanおよびプラセボ グループ、それぞれ。 興奮はCOMTANと扱われた患者の1%で起こりました そして0%はプラセボで治療した。
市販後のレポートは患者がかもしれないこと あるかもしれない新しいか悪化の精神状態および行動の変更を経験して下さい、 Comtan治療中またはその後の精神病様行動を含む重度 Comtanの用量を開始または増加させる。 改善するために処方された他の薬 パーキンソン病の症状は、思考と同様の効果を持つことができます 行動。 異常な思考や行動は妄想的思考を引き起こす可能性があります, 妄想、幻覚、混乱、見当識障害、攻撃的な行動, 攪拌、およびせん妄。 精神病様行動はまたの間に観察されました Comtanの臨床開発。
主要な精神病性障害を有する患者は、 通常悪化する危険のためにComtanと扱われないで下さい 精神病だ さらに、精神病を治療するために使用される特定の薬物は、 パーキンソン病の徴候を悪化させ、減らすかもしれません Comtanの有効性。
衝動制御および強迫的な行動
市販後のレポートはと扱われる患者が提案します 抗パーキンソン薬は、ギャンブルに強烈な衝動を経験することができます,増加 性的衝動、制御不能にお金を費やすために強烈な衝動、およびその他の強烈な イージス. 患者は、一つ以上の服用中にこれらの衝動を制御することができない場合があり パーキンソン病の治療のために使用される薬の それはlevodopaと取られるComtanを含む中心dopaminergic調子を、高めます そしてカルビドパ. いくつかのケースでは、すべてではないが、これらの衝動はに報告された 抗パーキンソン薬の用量が減少したときに停止しているか、または 廃止. で患者さんしても認識されない場合がありこれらの行動異常で 処方者が患者またはその介護者に具体的に尋ねることが重要です 新しいまたは増加したギャンブル衝動、性的衝動の開発について, エンタカポンで治療されている間、制御されていない支出やその他の衝動. 医者は患者なら線量の減少かcomtanを停止することを考慮するべきです Comtanを服用しながら、そのような衝動を開発
下痢および大腸炎
臨床試験では、下痢は60の603で発症しました (10%)および16の400(4%)200mg Comtanおよび偽薬と扱われる患者の, それぞれ. Comtanと扱われる患者では下痢は一般に穏やかにでした 中等度(8.6%)であったが、1.3%. 下痢 10の603(1)で撤退しました.7%)患者7人(1.2%)とマイルドで、 適度な下痢と3(0.重度の下痢を伴う5%). 下痢一般 Comtanの中止後に解決されました. 下痢を有する二つの患者は、 入院している方. 通常、下痢は4週から12週の後の内に示します entacaponeは開始されますが、最初の週には早くも遅くも表示されることがあります 治療開始から数ヶ月後. 下痢は関連する可能性があります 減量、脱水および低カリウム血症を使って
市販後の経験は下痢がであるかもしれないことを示しました 薬物誘発性顕微鏡的大腸炎、主にリンパ球性大腸炎の徴候。 では、 これらの場合下痢は通常厳しく、水っぽいに穏健派でした 非血まみれ、脱水、腹痛、体重減少に関連する時には, そして低カリウム血症。 ほとんどの場合、下痢およびその他の大腸炎に関連する 症状はComtan治療を中止したときに解決または有意に改善した。 生検で確認された大腸炎を有する一部の患者では、下痢が解決したか、または Comtanの中止後に有意に改善されたが、後に再発した Comtanとのretreatment。
延長された下痢がに関連していると疑われれば Comtanは、薬物を中止し、適切な医学的治療を行うべきである 考えられる。 長期の下痢の原因が不明なままであるか、または継続する場合 entacaponeを停止した後、それ以上の診断調査を含んでいます 大腸内視鏡検査および生検を考慮すべきである。
ジスキネジー
Comtanはdopaminergic副作用をの増強するかもしれません levodopaは既存のジスキネジーを引き起こすか、または悪化させるかもしれません。 しかし levodopaの線量を減らすことはこの副作用、多くの患者を改善するかもしれません 制御された調査でaにもかかわらず頻繁な運動障害を経験し続けました レボドパのそれらの用量の減少。 ジスキネジーの発生率は、25%であった Comtanによる治療およびプラセボに対する15%。 研究離脱の発生率 ジスキネジーについては1.5%が200mg Comtan、プラセボについては0.8%であった。
ドーパミン作動性療法で報告されたその他のイベント
以下に示すイベントは、以下に関連するイベントです ドーパミン作動性活性を増加させる薬物の使用。
横紋筋融解症
重度の横紋筋融解症の症例が報告されている Comtanの承認の後。 反応は通常発生しましたが 患者はComtanで治療されましたが、これらの症例の複雑な性質 もしあれば、Comtanがどのような役割を果たしたかを判断することが困難になります 病因。 厳しい長期のモーター活動を含むくださで説明できる可能性があ 横紋筋融解症のために。 印および徴候は熱、変化をの含んでいます 意識、筋肉痛、クレアチンホスホキナーゼ(CPK)の値の増加および ミオグロビン( 注意事項, ドーパミン作動性報告されたその他のイベント セラピー).
過熱症および混乱
神経弛緩症に似た症状複合体の症例 高温、筋肉によって特徴付けられる悪性症候群(NMS) 剛性、意識の変化、およびCPKの上昇が報告されています 他のdopaminergicの急速な線量の減少または回収との連合 ドラッグ. これらのケースのほとんどでは、徴候は突然の中断の後での始まりました エンタカポンによる治療またはその用量の減少、またはの開始後 エンタカポンによる治療. これらのケースの複雑な性質はそれを作ります 判断が難しいう役割の場合、Comtanていたそ 病因. 突然の離脱または離脱後の症例は報告されていない。 臨床研究におけるエンタカポン治療の用量削減
処方者は中止するときに注意を払うべきである エンタカポン治療 さらに、必要な撤退が進むべき ゆっくり Comtanによる治療を中止する決定がなされた場合, 推奨事項には、患者を密接に監視し、他の調整が含まれます 必要に応じてドーパミン作動性治療。 この症候群は、以下で考慮されるべきである 高熱または厳しい開発する患者のための鑑別診断 剛性率。 先細りComtanは系統的に評価されていない。
線維性合併症
後腹膜線維症、肺浸潤の症例, 胸水および胸膜肥厚は何人かの患者で報告されました 麦角由来のドーパミン作動性剤で処理したもの. のような合併症が起こった場合の解決 薬物が中止されるが、完全な解決が必ずしも起こるとは限らない場合. これらの有害事象はエルゴリンに関連すると考えられているが これらの化合物の構造は、他のかどうか、非エルゴット由来の薬物(e.g., エンタカポン)ドーパミン作動性活性を増加させることが原因であることは不明である。. それ 線維性合併症の予想される発生率は非常に低いことに留意すべきである エンタカポンがこれらの合併症を引き起こしたとしても、それらと同様の速度で に帰属するその他のドーパミン治療の売れ筋が見える、販売戦略が決まい エンタカポンにさらされたサイズのコホートで検出された. の四つのケース 肺線維症は、エンタカポンの臨床開発中に報告されました, これらの患者の三つはまた、ペルゴリドと一つで治療されました ブロモクリプチン. エンタカポンによる治療期間は7ヶ月の範囲であった 17ヶ月まで
メラノーマ
疫学的研究によると、患者は以下のものを有する パーキンソン病は、リスクが高い(2-約6倍高い)の 一般集団よりも黒色腫を発症する。 リスクが高まるかどうか 観察されたパーキンソン病か他の要因が原因、に使用される薬剤のようなありました パーキンソン病を治療する、不明です。
上記の理由により、患者および提供者は次のとおりです 使用するときメラノーマのために頻繁にそして定期的に監視するように助言される 徴候のためのComtan。 理想的には、定期的な皮膚検査は次のとおりです 適切に修飾された個人(例えば、皮膚科医)によって行われる。
腎毒性
1年間の毒性試験において、エンタカポン( ヒトにおいて最大推奨日量20倍の1,600 mg)は、雄ラットにおける腎毒性の発生率の増加を引き起こした。 再生尿細管、基底膜の肥厚によって特徴付けられる, 単核細胞の浸潤、および管状タンパク質キャスト。 これらの効果 臨床化学パラメータの変化に関連していなかった、とがあります これらの発生の可能性を監視するための確立された方法はありません ヒトの病変。 この毒性は種特specificを表す可能性がありますが 効果は、これがそうであるという証拠はまだありません。
肝障害
肝臓の減損の患者はと扱われるべきです 注意。 エンタカポンのAUCおよびCmaxは、以下の患者でおよそ倍増した コントロールと比較して文書化された肝疾患(参照 臨床薬理学, エンタカポンの薬物動態 そして 適量および管理).
検査室テスト
Comtanは鉄のキレート剤です。 エンタカポンの影響 しかし、体の鉄分貯蔵は不明であり、血清を減少させる傾向がある 鉄濃度は臨床試験で認められた。 制御された臨床では 血清フェリチンレベルを調べる(鉄欠乏および無症状のマーカーとして 貧血)は、プラセボと比較してエンタカポンで変化しなかった。 処置および貧血症の率に相違がなかったですまたは減りました ヘモグロビンレベル
特殊集団
肝臓の減損の患者はと扱われるべきです 注意( 適応症, 適量および管理).
発癌
エンタカポンの二年間の発癌性の調査は次のとおりでした マウスおよびラットで実施. ラットは経口gavageによって一度毎日扱われました 20、90、または400mg/kgのエンタカポン用量. 腎臓の高められた発生 管状のアデノーマおよび癌腫は最も高いと扱われた雄のラットで見つけられ エンタカポンの投与量. この線量と関連付けられる血しょう露出(AUC)はありました ヒトの推定プラズマ曝露よりも約20倍高くなります エンタカポン(1,600mg)の最大推奨日用量(MRDD)を受け取る). マウスは、20、100、または600mg/kgの用量で経口gavageによって一度毎日処理されました エンタカポネの(0.05, 0.3、およびmg/m2の基礎の人間のための2回のMRDD). 受け取るマウスの早期死亡率の高い発生のために エンタカポンの最高用量は、マウスの調査十分な査定のではないです 発がん性. 治療関連腫瘍は動物で観察されなかったが より低い線量を受け取って、entacaponeの発癌性の潜在性は持っていません 完全に評価されています. で投与されるエンタカポンの発癌性の可能性 levodopaおよびcarbidopaとの組合せは評価されませんでした
変異誘発
エンタカポンは、変異原性およびクラストジェニックであった in vitro マウス 代謝活性化の存在下および非存在下でのリンパ腫tkアッセイ、および 代謝の存在下で培養ヒトリンパ球におけるクラストジェニック アクティブ化。 エンタカポン、単独でまたはレボドパと組み合わせて carbidopaは、でclastogenicではありませんでした インビボ マウス小核検査または 細菌の逆の突然変異の試金(エイムズテスト)でmutagenic。
不妊治療の障害
エンタカポンは不妊治療や一般を損なわなかった 最大700mg/kg/日(血漿AUCs)で処理したラットにおける生殖パフォーマンス 28mgのMRDDを受け取っている人間のそれらの1,600回)。 交尾を遅らせたが、 不妊障害は、700mg/kg/日で処理された雌ラットで明らかではありませんでした エンタカポンの
妊娠
妊娠カテゴリーc
胎児発達研究では、エンタカポンは までの用量で臓器形成全体にわたって妊娠中の動物に投与される ラットでは1,000mg/kg/日、ウサギでは300mg/kg/日. 増加した発生率の 胎児の変化は最も高いと扱われたラットからの同腹で明らかでした 母性毒性の明白な徴候がない場合の用量. 母性血しょう この線量と関連付けられる薬剤の露出(AUC)はおよそ34回でした 最大推奨毎日を受けているヒトにおける推定血漿曝露 1,600mgの線量(MRDD). 中絶の頻度の増加、後期および合計 再吸収、および減少した胎児の体重は、のリッターで観察された 100mg/kg/日の母性毒性用量で処理されたウサギ(血漿AUCs0.4 MRDDを受け取っている人間の回)またはそれ以上のもの. そこには証拠がなかったのです これらの研究における催奇形性
しかし、雌ラットにエンタカポンを投与したとき 交配前および妊娠初期には、胎児の眼の発生率が増加する 異常(マクロフタルミア、微小眼球症、無眼球症)が観察された。 160mg/kg/日の用量で処理されたダムのリッター(血漿AUCs7倍 MRDDを受け取っている人間では)またはより大きい、母性的な毒性の不在で。 700mg/kg/日までの投与(血漿Aucはヒトの28倍) MRDDを受け取る)妊娠の後半の間のメスのラットへのおよび 授乳中の発達障害の証拠を作り出さなかった 子孫だ
エンタカポンは常にレボドパと同時に与えられる そして内臓および骨格奇形を引き起こすと知られているcarbidopaは、 うさぎさん レボドパとの組み合わせにおけるエンタカポンの催奇形性 また、カルビドパは動物では評価されなかった。
臨床研究からの経験はありませんに関する 妊娠中の女性におけるコムタンの使用。 従って、Comtanはの間に使用されるべきです 妊娠は、潜在的な利益が胎児への潜在的なリスクを正当化する場合にのみ行われます。
看護女性
動物実験では、エンタカポンは母体中に排泄されました ネズミミルク
エンタカポンが人間に排泄されるかどうかは知られていません ミルク 多くの薬物は人間の乳中に排泄されるので、注意が必要です エンタカポンが授乳中の女性に投与されたときに行使される。
小児用
小児科の患者の安全そして有効性は持っていません 設立されました。

見る 薬物相互作用.

妊娠カテゴリーc
胎児発達研究では、エンタカポンは までの用量で臓器形成全体にわたって妊娠中の動物に投与される ラットでは1,000mg/kg/日、ウサギでは300mg/kg/日. 増加した発生率の 胎児の変化は最も高いと扱われたラットからの同腹で明らかでした 母性毒性の明白な徴候がない場合の用量. 母性血しょう この線量と関連付けられる薬剤の露出(AUC)はおよそ34回でした 最大推奨毎日を受けているヒトにおける推定血漿曝露 1,600mgの線量(MRDD). 中絶の頻度の増加、後期および合計 再吸収、および減少した胎児の体重は、のリッターで観察された 100mg/kg/日の母性毒性用量で処理されたウサギ(血漿AUCs0.4 MRDDを受け取っている人間の回)またはそれ以上のもの. そこには証拠がなかったのです これらの研究における催奇形性
しかし、雌ラットにエンタカポンを投与したとき 交配前および妊娠初期には、胎児の眼の発生率が増加する 異常(マクロフタルミア、微小眼球症、無眼球症)が観察された。 160mg/kg/日の用量で処理されたダムのリッター(血漿AUCs7倍 MRDDを受け取っている人間では)またはより大きい、母性的な毒性の不在で。 700mg/kg/日までの投与(血漿Aucはヒトの28倍) MRDDを受け取る)妊娠の後半の間のメスのラットへのおよび 授乳中の発達障害の証拠を作り出さなかった 子孫だ
エンタカポンは常にレボドパと同時に与えられる そして内臓および骨格奇形を引き起こすと知られているcarbidopaは、 うさぎさん レボドパとの組み合わせにおけるエンタカポンの催奇形性 また、カルビドパは動物では評価されなかった。
臨床研究からの経験はありませんに関する 妊娠中の女性におけるコムタンの使用。 従って、Comtanはの間に使用されるべきです 妊娠は、潜在的な利益が胎児への潜在的なリスクを正当化する場合にのみ行われます。

臨床試験は広く異なる条件下で行われるため、薬物の臨床試験で観察された有害反応の発生率(治療された患者総数あたりの治療に関連する有害反応を経験しているユニークな患者の数)は、他の薬物の臨床試験で観察された有害反応の発生率と直接比較することはできず、実際に観察された有害反応の発生率を反映していない可能性がある。
パーキンソン病の1,450人の患者の合計は市場前臨床調査のComtanと扱われました。 変動する症状を有する患者、ならびにレボドパ療法に対する安定した応答を有する患者が含まれた。 しかし、すべての患者はレボドパ製剤との併用治療を受け、他の臨床的側面でも同様であった。
Comtanの使用に関連する二重盲検、プラセボ対照試験(N=1,003)で最も一般的に観察された有害反応(発生率はプラセボより少なくとも3%大きい)は、ジスキネジー、尿の変色、下痢、吐き気、運動亢進、腹痛、嘔吐、および口渇であった。. 二重盲検、偽薬対照の調査のentacaponeを与えられる患者のおよそ14%603は偽薬を受け取った患者の9%と比較される不利な反作用による処置を中断しました、400. 減少した順序での中止の最も頻繁な原因は、精神障害(2%対)であった。. 1%)、下痢(対2%). 0%)、ジスキネジーおよび高キネジー(2%対. 1%)、吐き気(対2%). 1%)、および腹痛(1%対. 0%)
対照臨床試験における有害事象発生率
表4に、二重盲検、プラセボ対照試験に参加しているエンタカポンで治療された患者の少なくとも1%に発生し、プラセボと比較してComtan群で数値的により一般的であった治療創発的有害事象をリストします。 これらの研究では、レボドパおよびカルビドパ(またはレボドパおよびベンセラジド)にコムタンまたはプラセボのいずれかが添加された。
表4:試験薬剤投与開始後の有害事象を有する患者の概要Comtan群の少なくとも1%およびプラセボよりも大きい
| システム臓器クラス 好ましい用語 | コムタン | プラセボ |
| (n=603) | (n=400)) | |
| 患者の% | 患者の% | |
| 皮膚および付属器の障害 | ||
| 発汗が増えました | 2 | 1 |
| 筋骨格系疾患 | ||
| 背中の痛み | 2 | 1 |
| 中枢および末梢神経系の障害 | ||
| ジスキネジー | 25 | 15 |
| 運動亢進症 | 10 | 5 |
| 運動低下症 | 9 | 8 |
| めまい | 8 | 6 |
| 特別な感覚、その他の障害 | ||
| 味倒錯 | 1 | 0 |
| 精神疾患 | ||
| 不安 | 2 | 1 |
| ソムノレンス | 2 | 0 |
| アジテーション | 1 | 0 |
| 胃腸系疾患 | ||
| 吐き気 | 14 | 8 |
| 下痢 | 10 | 4 |
| 腹痛 | 8 | 4 |
| 便秘 | 6 | 4 |
| 嘔吐 | 4 | 1 |
| 口乾燥 | 3 | 0 |
| 消化不良 | 2 | 1 |
| 鼓腸 | 2 | 0 |
| 胃炎 | 1 | 0 |
| 胃腸障害 | 1 | 0 |
| 呼吸器系の障害 | ||
| 呼吸困難 | 3 | 1 |
| 血小板、出血および凝固障害 | ||
| 紫斑病 | 2 | 1 |
| ウリナリウム> | ||
| 尿の変色 | 10 | 0 |
| 全体としての身体-一般的な障害 | ||
| 背中の痛み | 4 | 2 |
| 疲労 | 6 | 4 |
| 無力症 | 2 | 1 |
| 抵抗性メカニズム障害 | ||
| 感染細菌 | 1 | 0 |
有害反応に対する性別および年齢の影響
エンタカポンに起因する有害事象の割合には、年齢または性別によって差は認められなかった。
市販後のレポート
Comtanに一時的に関連する有害事象に関する以下の自発的な報告は、市場導入以来特定されており、表4には記載されていません。 これらの反応は未知のサイズの集団から自発的に報告されるため、それらの頻度を確実に推定したり、Comtan暴露と因果関係を確立することは必ずし
主に胆汁うっ滞性の特徴を有する肝炎が報告されている。

市販後のデータには、過剰摂取のいくつかの症例が含まれる。 エンタカポンの最も高い報告された線量は少なくとも40,000mgでした。 これらの症例でよく見られる急性症状および徴候には、傾眠および活動の低下、意識レベルの低下(昏睡、混乱および見当識障害など)および皮膚、舌および尿の変色、ならびに落ち着きのなさ、興奮および攻撃性に関連する状態が含まれる。
エンタカポン治療によるCOMT阻害は用量依存的である。 Comtan(entacapone)の大きい過量は理論的にそれにより内生および外生のカテコールの新陳代謝を防ぐ人間のCOMTの酵素の100%の阻止を、作り出すかもしれません。
ヒトに与えられた最高の日用量は2,400mgであり、ある研究ではレボドパおよびカルビドパで毎日400mgとして14日間15パーキンソン病患者で、別の研究では800mgとして7日間8健康なボランティアで毎日三回投与された。. この日用量では、エンタカポンのピーク血漿濃度は平均2.MLあたり0mcg(45分で、1と比較して.MLあたり0mcgおよび1.MLあたり2mcg、200mgのエンタカポンを45分で投与). 腹部の苦痛および緩い腰掛けはこの調査の間に最も一般に観察された不利なでき事でした. 2,000mg Comtan高い毎日の線量は200mgとしてレボドパおよびcarbidopaまたはlevodopaおよびベンセラジドとの10回少なくとも1年10患者の、少なくとも2年8患者および少なくとも3年7患者のために管理されました. しかし、全体的には、1,600mgを超える毎日の用量での臨床経験は限られています
動物データに基づくエンタカポンの致死血漿濃度の範囲は、マウスにおけるmL当たり80mcgからmL当たり130mcgであった。 高経口(gavage)投与後にマウスで呼吸困難,運動失調,低活性およびけいれんが観察された。
過剰摂取の管理
コムタンの過剰摂取の管理は症候性であり、コムタンに対する既知の解毒剤はない. 入院が勧められ、一般的な支援ケアが示されます. 血液透析または血液灌流の経験はありませんが、Comtanは血漿タンパク質に高度に結合しているため、これらの手順は有益ではありません. 炭の即時の胃洗浄そして繰り返された線量はそのうちに胃腸(GI)地域からの吸収そして再吸収の減少によってComtanの除去を早めるかもしれません. 呼吸および循環系の妥当性は注意深く監視され、適切な支える手段は用いられるべきです. 薬物相互作用、特にカテコール構造化薬物との可能性は、念頭に置く必要があります

2016年
However, we will provide data for each active ingredient
国で利用可能
 Argentina
Argentina Australia
Australia Austria
Austria Bangladesh
Bangladesh Belgium
Belgium Brazil
Brazil Bulgaria
Bulgaria Canada
Canada China
China Croatia (Hrvatska)
Croatia (Hrvatska) Cyprus
Cyprus Czech Republic
Czech Republic Denmark
Denmark Ecuador
Ecuador Egypt
Egypt Estonia
Estonia Finland
Finland France
France Germany
Germany Greece
Greece Hong Kong
Hong Kong Hungary
Hungary Iceland
Iceland Indonesia
Indonesia Ireland
Ireland Israel
Israel Italy
Italy Japan
Japan Latvia
Latvia Liechtenstein
Liechtenstein Lithuania
Lithuania Luxembourg
Luxembourg Malaysia
Malaysia Malta
Malta Netherlands
Netherlands New Zealand
New Zealand Norway
Norway Peru
Peru Philippines
Philippines Poland
Poland Portugal
Portugal Romania
Romania Serbia
Serbia Slovakia
Slovakia Slovenia
Slovenia South Africa
South Africa Spain
Spain Sweden
Sweden Switzerland
Switzerland Taiwan
Taiwan Thailand
Thailand Tunisia
Tunisia Turkey
Turkey United Kingdom
United Kingdom USA
USA Venezuela
Venezuela
