



Composition:
Application:
Utilisé dans le traitement:
Examiné médicalement par Oliinyk Elizabeth Ivanovna, Pharmacie Dernière mise à jour le 29.03.2022

Attention! Information sur la page est réservée aux professionnels de la santé! Les informations sont collectées dans des sources ouvertes et peuvent contenir des erreurs significatives! Soyez prudent et revérifiez toutes les informations de cette page!
Top 20 des médicaments avec les mêmes ingrédients:


Formes posologiques et forces
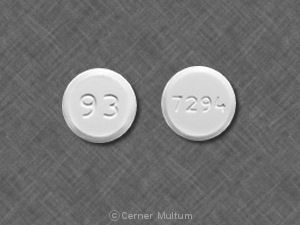
Comprimé, 250 mg blanc à blanc teinté de jaune, comprimés biseautés biseautés imprimés avec «LAMISIL» sous forme circulaire sur un côté et code «250» de l'autre côté.
Stockage et manutention
Tablettes Lamisil sont fournis en blanc à teinté de jaune comprimés à biseau blanc circulaires, bi-convexes, contenant 250 mg de terbinafine imprimé avec «LAMISIL» sous forme circulaire sur une face et code «250» sur le autre.
Bouteilles de 100 comprimés NDC 0078-0179-05
Bouteilles de 30 comprimés NDC 0078-0179-15
Conserver les comprimés Lamisil en dessous de 25 ° C (77 ° F); dans un étanche récipient. Protéger de la lumière.
Distribué par: Novartis Pharmaceuticals Corporation East Hanovre, New Jersey 07936. Révisé: juin / 2013

Lamisil (chlorhydrate de terbinafine) Les comprimés sont indiqués pour le traitement de l'onychomycose de l'ongle ou de l'ongle dû à dermatophytes (tinea unguium).
Avant d'initier le traitement, spécimens d'ongles appropriés pour les tests de laboratoire [préparation d'hydroxyde de potassium (KOH), culture fongique, ou biopsie des ongles] doit être obtenue pour confirmer le diagnostic d'onychomycose.

Onychomycose à ongles: Un comprimé de 250 mg une fois par jour pendant 6 semaines.
Onychomycose à ongles: Un comprimé de 250 mg une fois par jour pour 12 semaines.
L'effet clinique optimal est observé quelques mois après cure mycologique et arrêt du traitement. Ceci est lié à la période requis pour la excroissance des ongles sains.

Lamisil (chlorhydrate de terbinafine) Les granules oraux sont contre-indiqués chez les personnes ayant des antécédents de réaction allergique à la terbinafine orale en raison du risque d'anaphylaxie.

AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Hépatotoxicité
Des cas d'insuffisance hépatique, certains entraînant la mort ou une greffe du foie, se sont produits avec l'utilisation de la terbinafine orale pendant l'expérience post-commercialisation chez des personnes atteintes et non d'une maladie hépatique préexistante. Dans la majorité des cas hépatiques signalés, les patients présentaient de graves conditions systémiques sous-jacentes. La gravité des événements hépatiques et / ou leur issue peuvent être pires chez les patients atteints d'une maladie hépatique active ou chronique. Le traitement par Lamisil Oral Granules (chlorhydrate de terbinafine) doit être interrompu si des signes biochimiques ou cliniques de lésion hépatique se développent.
Les granules oraux de lisil (chlorhydrate de terbinafine) ne sont pas recommandés chez les patients atteints d'une maladie hépatique chronique ou active. Avant de prescrire des granules oraux de Lamisil (chlorhydrate de terbinafine), une maladie hépatique préexistante doit être évaluée. Une hépatotoxicité peut survenir chez les patients atteints et non d'une maladie hépatique préexistante. Les tests de transaminase sérique de prétraitement (ALT et AST) sont conseillés pour tous les patients avant de prendre Lamisil Oral Granules (chlorhydrate de terbinafine). Les patients ont prescrit des granules oraux Lamisil (chlorhydrate de terbinafine) et / ou leurs tuteurs doivent être avertis de signaler immédiatement à leur médecin tout symptôme de nausée persistante, anorexie, fatigue, vomissements, douleur ou jaunisse abdominale supérieure droite, urine foncée ou selles pâles. Les patients présentant ces symptômes doivent cesser de prendre des granules oraux Lamisil (chlorhydrate de terbinafine) et la fonction hépatique du patient doit être immédiatement évaluée.
Surveillance des tests de laboratoire
Les tests de transaminase sérique de prétraitement (ALT et AST) sont conseillés pour tous les patients avant de prendre Lamisil Oral Granules (chlorhydrate de terbinafine).
Hématologique
Des diminutions transitoires du nombre absolu de lymphocytes (ALC) ont été observées dans les essais cliniques. Dans les essais contrôlés contre placebo, 8/465 sujets recevant des comprimés Lamisil (1,7%) et 3/137 sujets recevant un placebo (2,2%) ont présenté une diminution de l'ALC en dessous de 1000 / mm3 à deux ou plusieurs reprises. Chez les patients atteints d'immunodéficience connue ou suspectée, les médecins devraient envisager de surveiller la numération formule sanguine complète si le traitement dépasse six semaines. Des cas de neutropénie sévère ont été rapportés; ceux-ci étaient réversibles à l'arrêt de la terbinafine, avec ou sans traitement de soutien. Si des signes et symptômes cliniques évoquant une infection secondaire se produisent, une numération formule sanguine complète doit être obtenue. Si le nombre de neutrophiles est ≤ 1 000 cellules / mm3, Les granules oraux Lamisil (chlorhydrate de terbinafine) doivent être arrêtés et la gestion de soutien doit être lancée.
Réactions cutanées
Il y a eu des rapports post-commercialisation de réactions cutanées graves (par ex., Syndrome de Stevens-Johnson et nécrolyse épidermique toxique) avec terbinafine orale. En cas d'éruption cutanée progressive, le traitement par Lamisil Oral Granules (chlorhydrate de terbinafine) doit être interrompu.
Fonction rénale
Chez les patients atteints d'insuffisance rénale (clairance de la créatinine <50 ml / min), l'utilisation de granules oraux Lamisil n'a pas été suffisamment étudiée.
Lupus Erythenatosus
Au cours de l'expérience post-commercialisation, des précipitations et une exacerbation du lupus érythémateux cutané et systémique ont été rapportées chez des patients prenant de la terbinafine orale. Le traitement doit être interrompu chez les patients présentant des signes et symptômes cliniques évoquant un lupus érythémateux.
Toxicologie non clinique
Cancérogenèse, mutugénèse, altération de la fertilité
Dans une étude de cancérogénicité orale de 28 mois chez le rat, une augmentation de l'incidence des tumeurs hépatiques a été observée chez les hommes à la dose la plus élevée testée, 69 mg / kg / jour (2x le MRHD basé sur les comparaisons AUC de la terbinafine parentale) cependant, même si la toxicité limitant la dose n'a pas été atteinte à la dose testée la plus élevée, des doses plus élevées n'ont pas été testées.
Les résultats d'une variété de in vitro (mutations en > E. coli et S. typhimurium, Réparation d'ADN dans les hépatocytes de rat, mutagénicité dans les fibroblastes de hamster chinois, aberration chromosomique et échanges de chromatides sœurs dans les cellules pulmonaires de hamster chinois), et in vivo (aberration chromosomique chez les hamsters chinois, test du micronoyau chez la souris) les tests de génotoxicité n'ont donné aucune preuve d'un potentiel mutagène ou clastogène. Les études de reproduction orale chez le rat à des doses allant jusqu'à 300 mg / kg / jour (environ 12 fois le MRHD sur la base des comparaisons BSA) n'ont révélé aucun effet spécifique sur la fertilité ou d'autres paramètres de reproduction. L'application intravaginale de chlorhydrate de terbinafine à 150 mg / jour chez les lapines gravides n'a pas augmenté l'incidence des avortements ou des accouchements prématurés ni affecté les paramètres fœtaux.
Utilisation dans des populations spécifiques
Grossesse
Catégorie de grossesse B .
Des études de reproduction orale ont été réalisées chez le lapin et le rat à des doses allant jusqu'à 300 mg / kg / jour [12x à 23x la dose humaine maximale recommandée (MRHD) chez le lapin et le rat, respectivement, basé sur la surface corporelle (BSA) comparaisons] et n'ont révélé aucun signe d'altération de la fertilité ou de préjudice au fœtus dû à la terbinafine. Il n'y a cependant pas d'études adéquates et bien contrôlées chez la femme enceinte. Étant donné que les études de reproduction animale ne sont pas toujours prédictives de la réponse humaine et que le traitement de l'onychomycose peut être reporté jusqu'à la fin de la grossesse, il est recommandé de ne pas initier de granules oraux Lamisil (chlorhydrate de terbinafine) pendant la grossesse.
Mères infirmières
Après administration orale, la terbinafine est présente dans le lait maternel des mères allaitantes. Le rapport de la terbinafine dans le lait au plasma est de 7: 1. Le traitement par Lamisil Oral Granules (chlorhydrate de terbinafine) n'est pas recommandé chez les mères allaitantes.
Utilisation pédiatrique
Granulés oraux Lamisil (chlorhydrate de terbinafine) a été étudié en deux randomisés, essais contrôlés actifs dans lesquels 1021 sujets ayant un diagnostic clinique de tinea-capitaine confirmé par microscopie KOH ont été traités avec des granules oraux Lamisil (chlorhydrate de terbinafine) à la dose étiquetée jusqu'à 6 semaines. Les événements indésirables les plus courants étaient la nasopharyngite, les céphalées, la pyrexie, la toux, les vomissements et les infections des voies respiratoires supérieures.
Utilisation gériatrique
Lamisil Oral Granules (chlorhydrate de terbinafine) n'a pas été étudié chez les patients gériatriques.

EFFETS CÔTÉ
Expérience en études cliniques
Parce que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux dans les essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
Lamisil (chlorhydrate de terbinafine) Granulés oraux
Les données décrites ci-dessous reflètent l'exposition à la terbinafine, dont 1042 sujets exposés pendant une médiane de 42 jours. Lamisil Oral Granules (chlorhydrate de terbinafine) a été étudié dans 2 essais contrôlés actifs (n = 1042). La population était composée d'enfants âgés de 4 à 12 ans, de 64% d'hommes et de 36% de femmes, de 21% de race blanche, de 47% de Noirs, de 32% d'autres. Les caractéristiques de la maladie de base (dermatophyte) des sujets comprenaient 49% des T. tonsurans, 15% T. violaceum, 15% M. canis, 2% M. audouinii, et 1% d'autres. Sujets reçus une fois par jour, pendant 6 semaines, doses orales de granulés oraux de Lamisil (chlorhydrate de terbinafine) en fonction du poids corporel: <25 kg 125 mg / jour, 25-35 kg 187,5 mg / jour et> 35 kg 250 mg / jour. Les événements indésirables rapportés dans les 2 essais sont répertoriés dans le tableau ci-dessous.
Tableau 2 Événements indésirables (≥ 1%) dans les essais de cobaye
| Lamisil® Granulés oraux (%) N = 1042 | Griseofulvin oral suspension (%) N = 507 | |
| Nasopharyngite | dix | 11 |
| Maux de tête | 7 | 8 |
| Pyrexia | 7 | 6 |
| Toux | 6 | 5 |
| Vomissements | 5 | 5 |
| Infection des voies respiratoires supérieures | 5 | 5 |
| Douleur abdominale supérieure | 4 | 4 |
| Diarrhée | 3 | 4 |
| Grippe | 2 | 1 |
| Douleur abdominale | 2 | 1 |
| Douleur pharyngolaryngée | 2 | 2 |
| Nausées | 2 | 2 |
| Éruption cutanée | 2 | 2 |
| Rhinorrhée | 2 | 0 |
| Congestion nasale | 2 | 1 |
| Prurit | 1 | 1 |
| Maux de dents | 1 | 1 |
Dans les essais pivots groupés, 2% (17/1042) des sujets du groupe terbinafine et 2% (6/507) du groupe griseofulvin ont connu l'arrêt du médicament à l'étude en raison d'événements indésirables. Les catégories les plus courantes d'événements indésirables provoquant l'arrêt de la situation chez les personnes exposées à la terbinafine comprenaient les troubles gastro-intestinaux, les troubles cutanés et sous-cutanés, ainsi que les infections et infestations.
Aucun signal de sécurité ophtalmologique n'a été identifié dans les essais pivots groupés. Les évaluations ophtalmologiques comprenaient une fundoscopie diluée pour évaluer les corps réfractaires dans la rétine, une évaluation de l'acuité visuelle et des tests de vision des couleurs. Sur les 940 sujets du groupe terbinafine et 471 sujets du groupe griseofulvin qui ont achevé la fundoscopie dilatée lors des visites post-traitement, aucun des sujets n'a été trouvé ayant des corps réfractaires de la rétine au départ ou à la fin du traitement. Pour l'acuité visuelle, 1% (11/837) des sujets traités par la terbinafine et 2% (7/426) des sujets traités par griseofulvin ont montré un doublement de l'angle visuel après 6 semaines de traitement, tandis que 2% (15/837) traité avec de la terbinafine et 3% (12/426) traité avec du griseofulvin a montré une réduction de moitié de l'angle visuel après 6 semaines de traitement. Parmi les sujets qui ont terminé l'évaluation de la vision des couleurs jaune-bleu pour les défauts acquis, 5% (13/262) des sujets traités par la terbinafine et 6% (8/129) des sujets traités par griseofulvin avaient une confusion des couleurs sur plus d'un symbole à la semaine 6 qu'au départ, tandis que 13% (33/262) des sujets traités par la terbinafine et 13% (17/129) des sujets traités par griseofulvin ont identifié plus de symboles correctement à la semaine 6 qu'au départ.
Tablettes Lamisil (chlorhydrate de terbinafine)
Les événements indésirables rapportés dans trois essais contrôlés contre placebo aux États-Unis et au Canada comprenaient la diarrhée (6%), les éruptions cutanées (6%), la dyspepsie (4%), les nausées (3%), les anomalies hépatiques (3%), troubles du goût (3%), douleurs abdominales (2%) et urticaire (1%).
Des changements dans la lentille oculaire et la rétine ont été rapportés à la suite de l'utilisation des comprimés Lamisil dans les essais cliniques chez des sujets adultes atteints d'onychomycose. La signification clinique de ces changements est inconnue.
Expérience post-commercialisation
Les événements indésirables suivants ont été identifiés lors de l'utilisation post-approbation de Lamisil. Étant donné que ces événements sont signalés volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament.
Les événements indésirables rapportés avec l'utilisation de la terbinafine par voie orale comprennent: une lésion hépatique idiosyncrasique et symptomatique et, cas d'insuffisance hépatique, certains conduisant à la mort ou à une greffe du foie, réactions cutanées graves, neutropénie sévère, thrombocytopénie, agranulocytose, pancytopénie, anémie, œdème de Quincke et réactions allergiques (y compris l'anaphylaxie).
Des éruptions psoriasiformes ou une exacerbation du psoriasis, une pustulose exanthémateuse généralisée aiguë et des précipitations et une exacerbation du lupus érythémateux cutané et systémique ont été rapportées. La terbinafine orale peut provoquer des troubles du goût (y compris une perte de goût) qui se rétablissent généralement dans les quelques semaines suivant l'arrêt du médicament. Des troubles gustatifs prolongés (supérieurs à un an) ont été signalés. Des troubles du goût auraient été suffisamment graves pour entraîner une diminution de l'apport alimentaire entraînant une perte de poids importante et indésirable.
Les autres effets indésirables qui ont été signalés comprennent le malaise, la fatigue, l'arthralgie, la myalgie, les vomissements, la pancréatite aiguë, la rhabdomyolyse, l'acuité visuelle réduite, les défauts du champ visuel et la perte de cheveux. Les événements indésirables signalés spontanément depuis la commercialisation du médicament comprennent une modification du temps de prothrombine (prolongation et réduction) chez les patients traités simultanément par la warfarine.
INTERACTIONS DE DROGUES
Interactions médicament-médicament
In vivo des études ont montré que la terbinafine est un inhibiteur de l'isozyme CYP450 2D6. Les médicaments principalement métabolisés par l'isozyme CYP450 2D6 comprennent les classes de médicaments suivantes: antidépresseurs tricycliques, inhibiteurs sélectifs du recaptage de la sérotonine, bêta-bloquants, antiarythmiques de classe 1C (par ex., flécaïnide et propafénone) et inhibiteurs de la monoamine oxydase de type B. L'administration concomitante de granules oraux de Lamisil (chlorhydrate de terbinafine) doit être effectuée avec une surveillance attentive et peut nécessiter une réduction de la dose du médicament métabolisé en 2D6. Dans une étude visant à évaluer les effets de la terbinafine sur la désipramine chez des volontaires sains caractérisés comme des métaboliseurs normaux, l'administration de terbinafine a entraîné une augmentation de 2 fois de la Cmax et une augmentation de 5 fois de l'ASC. Dans cette étude, il a été démontré que ces effets persistent lors de la dernière observation 4 semaines après l'arrêt de Lamisil. Dans les études menées sur des sujets sains caractérisés comme des métaboliseurs extensifs du dextrométhorphane, la terbinafine augmente le rapport métabolite dextrométhorphane / dextrorphane dans l'urine de 16 à 97 fois, en moyenne. In vitro des études avec des microsomes hépatiques humains ont montré que la terbinafine n'inhibe pas le métabolisme du tolbutamide, de l'éthinylestradiol, de l'éthoxycoumarine, de la cyclosporine, du cisapride et de la fluvastatine.
In vivo des études d'interaction médicamenteuse menées chez des sujets volontaires sains ont montré que la terbinafine n'affecte pas la clairance de l'antipyrine ou de la digoxine. La terbinafine diminue la clairance de la caféine de 19%. La terbinafine augmente la clairance de la cyclosporine de 15%.
L'influence de la terbinafine sur la pharmacocinétique du fluconazole, du triméthoprime, du sulfaméthoxazole, de la zidovudine ou de la théophylline n'a pas été considérée comme cliniquement significative.
La co-administration d'une dose unique de fluconazole (100 mg) avec une dose unique de terbinafine a entraîné une augmentation de 52% et 69% de la Cmax et de l'ASC de la terbinafine, respectivement. Le fluconazole est un inhibiteur des enzymes CYP 2C9 et CYP 3A. Sur la base de cette constatation, il est probable que d'autres inhibiteurs du CYP2C9 et du CYP3A4 (par ex., le kétoconazole, l'amiodarone) peut également entraîner une augmentation substantielle de l'exposition systémique (Cmax et AUC) à la terbinafine.
Des cas spontanés d'augmentation ou de diminution du temps de prothrombine ont été signalés chez des patients prenant simultanément de la terbinafine orale et de la warfarine, mais aucune relation causale entre les comprimés de Lamisil et ces changements n'a été établie.
La clairance de la terbinafine est augmentée de 100% par la rifampicine, un inducteur enzymatique du CYP450, et diminuée de 33% par la cimétidine, un inhibiteur de l'enzyme CYP450. La clairance de la terbinafine n'est pas affectée par la cyclosporine. Aucune information n'est disponible à partir d'études adéquates d'interaction médicamenteuse avec les classes de médicaments suivantes: contraceptifs oraux, thérapies hormonales de remplacement, hypoglycémie, phénytoïnes, diurétiques thiazidiques et inhibiteurs calciques.
Interactions alimentaires
Aucune évaluation de l'effet des aliments sur les granules oraux de Lamisil (chlorhydrate de terbinafine) n'a été effectuée. Cependant, dans les essais cliniques, Lamisil (chlorhydrate de terbinafine) Oral Granules a été administré avec de la nourriture.

Catégorie de grossesse B .
Des études de reproduction orale ont été réalisées chez le lapin et le rat à des doses allant jusqu'à 300 mg / kg / jour [12x à 23x la dose humaine maximale recommandée (MRHD) chez le lapin et le rat, respectivement, basé sur la surface corporelle (BSA) comparaisons] et n'ont révélé aucun signe d'altération de la fertilité ou de préjudice au fœtus dû à la terbinafine. Il n'y a cependant pas d'études adéquates et bien contrôlées chez la femme enceinte. Étant donné que les études de reproduction animale ne sont pas toujours prédictives de la réponse humaine et que le traitement de l'onychomycose peut être reporté jusqu'à la fin de la grossesse, il est recommandé de ne pas initier de granules oraux Lamisil (chlorhydrate de terbinafine) pendant la grossesse.

Expérience en études cliniques
Parce que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux dans les essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
Lamisil (chlorhydrate de terbinafine) Granulés oraux
Les données décrites ci-dessous reflètent l'exposition à la terbinafine, dont 1042 sujets exposés pendant une médiane de 42 jours. Lamisil Oral Granules (chlorhydrate de terbinafine) a été étudié dans 2 essais contrôlés actifs (n = 1042). La population était composée d'enfants âgés de 4 à 12 ans, de 64% d'hommes et de 36% de femmes, de 21% de race blanche, de 47% de Noirs, de 32% d'autres. Les caractéristiques de la maladie de base (dermatophyte) des sujets comprenaient 49% des T. tonsurans, 15% T. violaceum, 15% M. canis, 2% M. audouinii, et 1% d'autres. Sujets reçus une fois par jour, pendant 6 semaines, doses orales de granulés oraux de Lamisil (chlorhydrate de terbinafine) en fonction du poids corporel: <25 kg 125 mg / jour, 25-35 kg 187,5 mg / jour et> 35 kg 250 mg / jour. Les événements indésirables rapportés dans les 2 essais sont répertoriés dans le tableau ci-dessous.
Tableau 2 Événements indésirables (≥ 1%) dans les essais de cobaye
| Lamisil® Granulés oraux (%) N = 1042 | Griseofulvin oral suspension (%) N = 507 | |
| Nasopharyngite | dix | 11 |
| Maux de tête | 7 | 8 |
| Pyrexia | 7 | 6 |
| Toux | 6 | 5 |
| Vomissements | 5 | 5 |
| Infection des voies respiratoires supérieures | 5 | 5 |
| Douleur abdominale supérieure | 4 | 4 |
| Diarrhée | 3 | 4 |
| Grippe | 2 | 1 |
| Douleur abdominale | 2 | 1 |
| Douleur pharyngolaryngée | 2 | 2 |
| Nausées | 2 | 2 |
| Éruption cutanée | 2 | 2 |
| Rhinorrhée | 2 | 0 |
| Congestion nasale | 2 | 1 |
| Prurit | 1 | 1 |
| Maux de dents | 1 | 1 |
Dans les essais pivots groupés, 2% (17/1042) des sujets du groupe terbinafine et 2% (6/507) du groupe griseofulvin ont connu l'arrêt du médicament à l'étude en raison d'événements indésirables. Les catégories les plus courantes d'événements indésirables provoquant l'arrêt de la situation chez les personnes exposées à la terbinafine comprenaient les troubles gastro-intestinaux, les troubles cutanés et sous-cutanés, ainsi que les infections et infestations.
Aucun signal de sécurité ophtalmologique n'a été identifié dans les essais pivots groupés. Les évaluations ophtalmologiques comprenaient une fundoscopie diluée pour évaluer les corps réfractaires dans la rétine, une évaluation de l'acuité visuelle et des tests de vision des couleurs. Sur les 940 sujets du groupe terbinafine et 471 sujets du groupe griseofulvin qui ont achevé la fundoscopie dilatée lors des visites post-traitement, aucun des sujets n'a été trouvé ayant des corps réfractaires de la rétine au départ ou à la fin du traitement. Pour l'acuité visuelle, 1% (11/837) des sujets traités par la terbinafine et 2% (7/426) des sujets traités par griseofulvin ont montré un doublement de l'angle visuel après 6 semaines de traitement, tandis que 2% (15/837) traité avec de la terbinafine et 3% (12/426) traité avec du griseofulvin a montré une réduction de moitié de l'angle visuel après 6 semaines de traitement. Parmi les sujets qui ont terminé l'évaluation de la vision des couleurs jaune-bleu pour les défauts acquis, 5% (13/262) des sujets traités par la terbinafine et 6% (8/129) des sujets traités par griseofulvin avaient une confusion des couleurs sur plus d'un symbole à la semaine 6 qu'au départ, tandis que 13% (33/262) des sujets traités par la terbinafine et 13% (17/129) des sujets traités par griseofulvin ont identifié plus de symboles correctement à la semaine 6 qu'au départ.
Tablettes Lamisil (chlorhydrate de terbinafine)
Les événements indésirables rapportés dans trois essais contrôlés contre placebo aux États-Unis et au Canada comprenaient la diarrhée (6%), les éruptions cutanées (6%), la dyspepsie (4%), les nausées (3%), les anomalies hépatiques (3%), troubles du goût (3%), douleurs abdominales (2%) et urticaire (1%).
Des changements dans la lentille oculaire et la rétine ont été rapportés à la suite de l'utilisation des comprimés Lamisil dans les essais cliniques chez des sujets adultes atteints d'onychomycose. La signification clinique de ces changements est inconnue.
Expérience post-commercialisation
Les événements indésirables suivants ont été identifiés lors de l'utilisation post-approbation de Lamisil. Étant donné que ces événements sont signalés volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament.
Les événements indésirables rapportés avec l'utilisation de la terbinafine par voie orale comprennent: une lésion hépatique idiosyncrasique et symptomatique et, cas d'insuffisance hépatique, certains conduisant à la mort ou à une greffe du foie, réactions cutanées graves, neutropénie sévère, thrombocytopénie, agranulocytose, pancytopénie, anémie, œdème de Quincke et réactions allergiques (y compris l'anaphylaxie).
Des éruptions psoriasiformes ou une exacerbation du psoriasis, une pustulose exanthémateuse généralisée aiguë et des précipitations et une exacerbation du lupus érythémateux cutané et systémique ont été rapportées. La terbinafine orale peut provoquer des troubles du goût (y compris une perte de goût) qui se rétablissent généralement dans les quelques semaines suivant l'arrêt du médicament. Des troubles gustatifs prolongés (supérieurs à un an) ont été signalés. Des troubles du goût auraient été suffisamment graves pour entraîner une diminution de l'apport alimentaire entraînant une perte de poids importante et indésirable.
Les autres effets indésirables qui ont été signalés comprennent le malaise, la fatigue, l'arthralgie, la myalgie, les vomissements, la pancréatite aiguë, la rhabdomyolyse, l'acuité visuelle réduite, les défauts du champ visuel et la perte de cheveux. Les événements indésirables signalés spontanément depuis la commercialisation du médicament comprennent une modification du temps de prothrombine (prolongation et réduction) chez les patients traités simultanément par la warfarine.

L'expérience clinique concernant un surdosage avec de la terbinafine orale est limitée. Des doses allant jusqu'à 5 grammes chez l'adulte (20 fois la dose thérapeutique quotidienne chez l'adulte) ont été rapportées sans provoquer d'effets indésirables graves. Les symptômes d'un surdosage comprenaient des nausées, des vomissements, des douleurs abdominales, des étourdissements, des éruptions cutanées, des mictions fréquentes et des maux de tête.

La pharmacodynamique des granules oraux Lamisil ® (chlorhydrate de terbinafine) est inconnue.

La pharmacocinétique chez les enfants de 4 à 8 ans atteints de tinea capite a été étudiée dans une étude pharmacocinétique après une seule et répétée (pendant 42 jours) administration orale de granules oraux Lamisil (chlorhydrate de terbinafine) (N = 16) une fois par jour, en utilisant les groupes de poids corporel et les doses décrites dans la section 2.2. L'exposition systémique (Cmax et AUC0-24) de la terbinafine chez les enfants présentait une variabilité interindividuelle relativement élevée (allant de 36% à 64%). À l'état d'équilibre, l'AUC0-24 augmenté d'un facteur moyen de 1,9 à 2,1 à travers les doses. La demi-vie efficace moyenne (ET) obtenue à partir de l'accumulation observée était de 26,7 (13,8) heures et de 30,5 (9,3) heures pour les doses de 125 mg et 187,5 mg, respectivement.
L'exposition systémique à la terbinafine chez les enfants n'a pas dépassé les valeurs les plus élevées de l'exposition systémique chez les adultes recevant des doses répétées une fois par jour de 250 mg de comprimés Lamisil (terbinafine). Une évaluation pharmacocinétique de population de la terbinafine orale qui comprenait des enfants de 4 à 12 ans et des adultes de 18 à 45 ans (N = 113) a révélé que la clairance (CL / F) de la terbinafine dépend du poids corporel de manière non linéaire. Pour un enfant typique de 25 kg CL / F devait être de 19 L / h et pour un adulte typique de 70 kg de poids corporel, il était prévu de 27 L / h. Sur la plage de poids des patients pédiatriques incluse dans l'analyse (14,1 kg-68 kg), le CL / F prévu variait entre 15,6 et 26,7 L / h. Dans le plasma, la terbinafine est> 99% liée aux protéines plasmatiques. Avant l'excrétion, la terbinafine est rapidement et largement métabolisée par au moins sept isoenzymes du CYP avec des contributions majeures des CYP2C9, CYP1A2, CYP3A4, CYP2C8 et CYP2C19. Aucun métabolite n'a été identifié ayant une activité antifongique similaire à la terbinafine. Environ 70% de la dose administrée est éliminée dans l'urine. Chez les patients adultes atteints d'insuffisance rénale (clairance de la créatinine ≤ 50 ml / min) ou de cirrhose hépatique, la clairance de la terbinafine est diminuée d'environ 50% par rapport aux volontaires normaux.



