



Componentes:
Método de ação:
Opção de tratamento:
Medicamente revisado por Oliinyk Elizabeth Ivanovna, Farmácia Última atualização em 29.03.2022

Atenção! As informações na página são apenas para profissionais de saúde! As informações são coletadas em fontes abertas e podem conter erros significativos! Tenha cuidado e verifique novamente todas as informações desta página!
20 principais medicamentos com os mesmos componentes:


Dosage Forms And Strengths
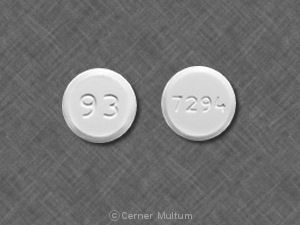
Tablet, 250 mg white to yellow-tinged white circular, bi-convex, beveled tablets imprinted with “LAMISIL” in circular form on one side and code “250” on the other side.
Storage And Handling
Lamisil Tablets are supplied as white to yellow-tinged white circular, bi-convex, beveled tablets containing 250 mg of terbinafine imprinted with “LAMISIL” in circular form on one side and code “250” on the other.
Bottles of 100 tablets NDC 0078-0179-05
Bottles of 30 tablets NDC 0078-0179-15
Store Lamisil Tablets below 25°C (77°F); in a tight container. Protect from light.
Distributed by: Novartis Pharmaceuticals Corporation East Hanover, New Jersey 07936. Revised: June/2013

Lamisil (cloridrato de terbinafina) Os comprimidos são indicados para o tratamento da onicomicose da unha ou unha devido a dermatofitos (tinea unguium).
Antes de iniciar o tratamento, amostras de unhas apropriadas para testes de laboratório [preparação de hidróxido de potássio (KOH), cultura de fungos, ou biópsia das unhas] deve ser obtida para confirmar o diagnóstico de onicomicose.

Onicomicose da unha: Um comprimido de 250 mg uma vez ao dia por 6 semanas.
Unhas onicomicose: Um comprimido de 250 mg uma vez ao dia para 12 semanas.
O efeito clínico ideal é observado alguns meses depois cura micológica e cessação do tratamento. Isso está relacionado ao período necessário para o crescimento de unhas saudáveis.

O Lamisil (cloridrato de terbinafina) Oral Granules está contra-indicado em indivíduos com histórico de reação alérgica à terbinafina oral devido ao risco de anafilaxia.

AVISO
Incluído como parte do PRECAUÇÕES seção.
PRECAUÇÕES
Hepatotoxicidade
Ocorreram casos de insuficiência hepática, alguns levando à morte ou transplante de fígado, com o uso de terbinafina oral durante a experiência pós-comercialização em indivíduos com e sem doença hepática pré-existente. Na maioria dos casos de fígado relatados, os pacientes apresentavam condições sistêmicas subjacentes graves. A gravidade dos eventos hepáticos e / ou seu resultado pode ser pior em pacientes com doença hepática ativa ou crônica. O tratamento com grânulos orais de Lamisil (cloridrato de terbinafina) deve ser interrompido se houver evidência bioquímica ou clínica de lesão hepática.
Grânulos orais de Lamisil (cloridrato de terbinafina) não é recomendado em pacientes com doença hepática crônica ou ativa. Antes de prescrever os grânulos orais de Lamisil (cloridrato de terbinafina), a doença hepática preexistente deve ser avaliada. Pode ocorrer hepatotoxicidade em pacientes com e sem doença hepática preexistente. Os testes de transaminase sérica pré-tratamento (ALT e AST) são recomendados para todos os pacientes antes de tomar Lamisil Oral Granules (cloridrato de terbinafina). Os pacientes prescreveram grânulos orais de Lamisil (cloridrato de terbinafina) e / ou seus responsáveis devem ser avisados para relatar imediatamente ao médico quaisquer sintomas de náusea persistente, anorexia, fadiga, vômito, dor ou icterícia na parte superior direita do abdome, urina escura ou fezes pálidas. Os pacientes com esses sintomas devem interromper o uso de Lamisil Oral Granules (cloridrato de terbinafina) e a função hepática do paciente deve ser avaliada imediatamente.
Testes de laboratório de monitoramento
Os testes de transaminase sérica pré-tratamento (ALT e AST) são recomendados para todos os pacientes antes de tomar Lamisil Oral Granules (cloridrato de terbinafina).
Hematológico
Reduções transitórias na contagem absoluta de linfócitos (CAL) foram observadas em ensaios clínicos. Em ensaios controlados por placebo, 8/465 indivíduos que receberam comprimidos de Lamisil (1,7%) e 3/137 indivíduos que receberam placebo (2,2%) tiveram reduções na ALC para menos de 1000 / mm3 em duas ou mais ocasiões. Em pacientes com imunodeficiência conhecida ou suspeita, os médicos devem considerar o monitoramento de hemogramas completos se o tratamento exceder seis semanas. Casos de neutropenia grave foram relatados; estes eram reversíveis com a descontinuação da terbinafina, com ou sem terapia de suporte. Se ocorrerem sinais e sintomas clínicos sugestivos de infecção secundária, deve-se obter um hemograma completo. Se a contagem de neutrófilos for ≤ 1.000 células / mm3, Os grânulos orais de Lamisil (cloridrato de terbinafina) devem ser descontinuados e o gerenciamento de suporte deve ser iniciado.
Reações cutâneas
Houve relatos pós-comercialização de reações cutâneas graves (por exemplo,.Síndrome de Stevens-Johnson e necrólise epidérmica tóxica) com terbinafina oral. Se ocorrer erupção cutânea progressiva, o tratamento com Lamisil Oral Granules (cloridrato de terbinafina) deve ser interrompido.
Função Renal
Em pacientes com insuficiência renal (depuração da creatinina <50 mL / min), o uso de Lamisil Oral Granules não foi adequadamente estudado.
Lúpus Erythenatosus
Durante a experiência pós-comercialização, foram relatadas precipitação e exacerbação do lúpus eritematoso cutâneo e sistêmico em pacientes em uso de terbinafina oral. A terapia deve ser descontinuada em pacientes com sinais e sintomas clínicos sugestivos de lúpus eritematoso.
Toxicologia Não Clínica
Carcinogênese, Mutugênese, Compromisso de Fertilidade
Num estudo de carcinogenicidade oral de 28 meses em ratos, foi observado um aumento na incidência de tumores hepáticos em homens na dose mais alta testada, 69 mg / kg / dia (2x o MRHD com base nas comparações da AUC do terbinafina original) Contudo, embora a toxicidade limitante da dose não tenha sido alcançada na dose mais alta testada, doses mais altas não foram testadas.
Os resultados de uma variedade de in vitro (mutações em > E. coli e S. typhimurium, Reparo de DNA em hepatócitos de rato, mutagenicidade em fibroblastos de hamster chinês, aberração cromossômica e trocas cromátides irmãs em células pulmonares de hamster chinês) e in vivo (aberração cromossômica em hamsters chineses, teste de micronúcleos em camundongos) os testes de genotoxicidade não deram evidência de um potencial mutagênico ou clastogênico. Os estudos de reprodução oral em ratos em doses de até 300 mg / kg / dia (aproximadamente 12x o MRHD com base em comparações de BSA) não revelaram efeitos específicos na fertilidade ou em outros parâmetros reprodutivos. A aplicação intravaginal de cloridrato de terbinafina a 150 mg / dia em coelhos prenhes não aumentou a incidência de abortos ou partos prematuros nem afetou os parâmetros fetais.
Use em populações específicas
Gravidez
Categoria de gravidez B .
Estudos de reprodução oral foram realizados em coelhos e ratos em doses de até 300 mg / kg / dia [12x a 23x a dose humana máxima recomendada (MRHD) em coelhos e ratos, respectivamente, com base na área da superfície corporal (BSA) comparações] e não revelaram evidências de fertilidade prejudicada ou danos ao feto devido à terbinafina. No entanto, não existem estudos adequados e bem controlados em mulheres grávidas. Como os estudos de reprodução animal nem sempre são preditivos da resposta humana e como o tratamento da onicomicose pode ser adiado até a conclusão da gravidez, recomenda-se que os grânulos orais de Lamisil (cloridrato de terbinafina) não sejam iniciados durante a gravidez.
Mães de enfermagem
Após administração oral, a terbinafina está presente no leite materno das nutrizes. A proporção de terbinafina no leite e no plasma é de 7: 1. O tratamento com grânulos orais de Lamisil (cloridrato de terbinafina) não é recomendado em nutrizes.
Uso pediátrico
Grânulos orais de Lamisil (cloridrato de terbinafina) foi estudado em dois randomizados, ensaios controlados por ativos, nos quais 1021 indivíduos com diagnóstico clínico de tinea capitis confirmada por microscopia KOH foram tratados com Lamisil Oral Granules (cloridrato de terbinafina) na dose rotulada por até 6 semanas. Os eventos adversos mais comuns foram nasofaringite, dor de cabeça, pirexia, tosse, vômito e infecção do trato respiratório superior.
Uso geriátrico
Os grânulos orais de Lamisil (cloridrato de terbinafina) não foram estudados em pacientes geriátricos.

EFEITOS SECUNDÁRIOS
Experiência em Estudos Clínicos
Porque os ensaios clínicos são conduzidos sob condições muito variadas, as taxas de reação adversa nos ensaios clínicos de um medicamento não podem ser comparadas diretamente às taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
Grânulos orais de lamisil (cloridrato de terbinafina)
Os dados descritos abaixo refletem a exposição à terbinafina, incluindo 1042 indivíduos expostos por uma mediana de 42 dias. Os grânulos orais de Lamisil (cloridrato de terbinafina) foram estudados em 2 ensaios controlados por ativos (n = 1042). A população era de crianças de 4 a 12 anos, 64% do sexo masculino e 36% do sexo feminino, 21% caucasiano, 47% preto e 32% outro. As características da doença de base (dermatophyte) dos indivíduos incluíram 49% de doenças T. amedrontadores15% T. violaceum15% M. canis2% M. audouiniie 1% outros. Indivíduos recebidos uma vez ao dia, durante 6 semanas, doses orais de grânulos orais de Lamisil (cloridrato de terbinafina) com base no peso corporal: <25 kg 125 mg / dia, 25-35 kg 187,5 mg / dia e> 35 kg 250 mg / dia. Os eventos adversos relatados nos 2 ensaios estão listados na tabela abaixo.
Tabela 2 Eventos adversos (≥ 1%) nos ensaios de Tinea Capitis
| Lamisil® Grânulos orais (%) N = 1042 | Griseofulvin oral suspensão (%) N = 507 | |
| Nasofaringite | 10) | 11) |
| Dor de cabeça | 7 | 8 |
| Pirexia | 7 | 6 |
| Tosse | 6 | 5 |
| Vômitos | 5 | 5 |
| Infecção do trato respiratório superior | 5 | 5 |
| Dor abdominal superior | 4 | 4 |
| Diarréia | 3 | 4 |
| Gripe | 2 | 1 |
| Dor abdominal | 2 | 1 |
| Dor faringolaríngea | 2 | 2 |
| Náusea | 2 | 2 |
| Erupção cutânea | 2 | 2 |
| Rinorréia | 2 | 0 |
| Congestão nasal | 2 | 1 |
| Prurido | 1 | 1 |
| Dor de dente | 1 | 1 |
Nos ensaios principais agrupados, 2% (17/1042) dos indivíduos do grupo terbinafina e 2% (6/507) do grupo griseofulvina sofreram a descontinuação do medicamento do estudo devido a eventos adversos. As categorias mais comuns de eventos adversos que causam descontinuação naqueles expostos à terbinafina incluíram distúrbios gastrointestinais, distúrbios cutâneos e subcutâneos e infecções e infestações.
Nenhum sinal de segurança oftalmológico foi identificado nos ensaios principais combinados. As avaliações oftalmológicas incluíram a fundoscopia dilatada para avaliar corpos refratários na retina, avaliação da acuidade visual e teste da visão de cores. Dos 940 indivíduos do grupo terbinafina e 471 indivíduos do grupo griseofulvina que concluíram a fundoscopia dilatada nas visitas pós-tratamento, nenhum dos indivíduos teve corpos refratários da retina na linha de base ou no final do tratamento. Para acuidade visual, 1% (11/837) de indivíduos tratados com terbinafina e 2% (7/426) dos indivíduos tratados com griseofulvina mostraram uma duplicação do ângulo visual após 6 semanas de tratamento, enquanto 2% (15/837) tratado com terbinafina e 3% (12/426) tratado com griseofulvina mostrou uma metade do ângulo visual após 6 semanas de tratamento. De indivíduos que concluíram a avaliação da visão de cores amarelo-azul para defeitos adquiridos, 5% (13/262) de indivíduos tratados com terbinafina e 6% (8/129) dos indivíduos tratados com griseofulvin tiveram confusão de cores em mais de um símbolo na semana 6 do que na linha de base, enquanto 13% (33/262) de indivíduos tratados com terbinafina e 13% (17/129) dos indivíduos tratados com griseofulvin identificaram mais símbolos corretamente na semana 6 do que na linha de base.
Lamisil (cloridrato de terbinafina) Comprimidos
Os eventos adversos relatados em três ensaios controlados por placebo nos EUA / Canadá incluíram diarréia (6%), erupções cutâneas (6%), dispepsia (4%), náusea (3%), anormalidades hepáticas (3%), prurido (3%), distúrbios do paladar (3%), dor abdominal (2%) e urticária (1%).
Alterações na lente ocular e na retina foram relatadas após o uso de comprimidos de Lamisil em ensaios clínicos em indivíduos adultos com onicomicose. O significado clínico dessas alterações é desconhecido.
Experiência pós-comercialização
Os seguintes eventos adversos foram identificados durante o uso pós-aprovação de Lamisil. Como esses eventos são relatados voluntariamente a partir de uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição a medicamentos.
Os eventos adversos relatados com o uso oral de terbinafina incluem: lesão hepática idiossincrática e sintomática e, casos de insuficiência hepática, alguns levando à morte ou transplante de fígado, reações cutâneas graves, neutropenia grave, trombocitopenia, agranulocitose, pancitopenia, anemia, angioedema e reações alérgicas (incluindo anafilaxia).
Erupções psoríase ou exacerbação da psoríase, pustulose exanthematosa generalizada aguda e precipitação e exacerbação do lúpus eritematoso cutâneo e sistêmico foram relatadas. A terbinafina oral pode causar distúrbios do paladar (incluindo perda de paladar), que geralmente se recupera dentro de várias semanas após a descontinuação do medicamento. Houve relatos de distúrbios prolongados (maiores que um ano) do paladar. Foi relatado que distúrbios do paladar são graves o suficiente para resultar em diminuição da ingestão de alimentos, levando a uma perda de peso significativa e indesejada.
Outras reações adversas relatadas incluem mal-estar, fadiga, artralgia, mialgia, vômito, pancreatite aguda, rabdomiólise, acuidade visual reduzida, defeitos no campo visual e perda de cabelo. Eventos adversos relatados espontaneamente desde que o medicamento foi comercializado incluem tempo de protrombina alterado (prolongamento e redução) em pacientes tratados concomitantemente com varfarina.
INTERAÇÕES DE DROGAS
Interações medicamentosas
In vivo estudos demonstraram que a terbinafina é um inibidor da isozima CYP450 2D6. Os medicamentos predominantemente metabolizados pela isozima CYP450 2D6 incluem as seguintes classes de medicamentos: antidepressivos tricíclicos, inibidores seletivos da recaptação de serotonina, betabloqueadores, classe antiarrítmica 1C (por exemplo,., flecainida e propafenona) e inibidores da monoamina oxidase Tipo B. A administração concomitante de Lamisil (cloridrato de terbinafina) Os grânulos orais deve ser realizada com monitoramento cuidadoso e pode exigir uma redução na dose do medicamento metabolizado em 2D6. Em um estudo para avaliar os efeitos da terbinafina na desipramina em voluntários saudáveis caracterizados como metabolizadores normais, a administração de terbinafina resultou em um aumento de 2 vezes na Cmax e em 5 vezes na AUC. Neste estudo, estes efeitos demonstraram persistir na última observação, 4 semanas após a descontinuação do Lamisil. Em estudos em indivíduos saudáveis caracterizados como metabolizadores extensos de dextrometorfano, a terbinafina aumenta a razão dextrometorfano / metabolito dextrófano na urina em 16 a 97 vezes, em média. In vitro estudos com microssomas hepáticos humanos mostraram que a terbinafina não inibe o metabolismo da tolbutamida, etinilestradiol, etoxicumarina, ciclosporina, cisaprida e fluvastatina.
In vivo estudos de interação medicamentosa realizados em indivíduos voluntários saudáveis mostraram que a terbinafina não afeta a depuração da antipirina ou digoxina. A terbinafina diminui a depuração da cafeína em 19%. A terbinafina aumenta a depuração da ciclosporina em 15%.
A influência da terbinafina na farmacocinética do fluconazol, trimetoprim, sulfametoxazol, zidovudina ou teofilina não foi considerada clinicamente significativa.
A administração concomitante de uma dose única de fluconazol (100 mg) com uma dose única de terbinafina resultou em um aumento de 52% e 69% na Cmax e na AUC da terbinafina, respectivamente. O fluconazol é um inibidor das enzimas CYP 2C9 e CYP 3A. Com base nesse achado, é provável que outros inibidores do CYP2C9 e do CYP3A4 (por exemplo,., cetoconazol, amiodarona) também pode levar a um aumento substancial na exposição sistêmica (Cmax e AUC) da terbinafina.
Houve relatos espontâneos de aumento ou diminuição dos tempos de protrombina em pacientes que tomavam concomitantemente terbinafina oral e varfarina, no entanto, uma relação causal entre os comprimidos de Lamisil e essas alterações não foi estabelecida.
A depuração da terbinafina é aumentada em 100% pela rifampicina, um indutor enzimático do CYP450, e diminuiu 33% pela cimetidina, um inibidor da enzima CYP450. A depuração da terbinafina não é afetada pela ciclosporina. Não há informações disponíveis em estudos adequados de interação medicamentosa com as seguintes classes de medicamentos: contraceptivos orais, terapias de reposição hormonal, hipoglicemia, fenitoínas, diuréticos tiazídicos e bloqueadores dos canais de cálcio.
Interações alimentares
Não foi realizada uma avaliação do efeito dos alimentos nos grânulos orais Lamisil (cloridrato de terbinafina). No entanto, nos ensaios clínicos, Lamisil (cloridrato de terbinafina) Oral Granules foi administrado com alimentos.

Categoria de gravidez B .
Estudos de reprodução oral foram realizados em coelhos e ratos em doses de até 300 mg / kg / dia [12x a 23x a dose humana máxima recomendada (MRHD) em coelhos e ratos, respectivamente, com base na área da superfície corporal (BSA) comparações] e não revelaram evidências de fertilidade prejudicada ou danos ao feto devido à terbinafina. No entanto, não existem estudos adequados e bem controlados em mulheres grávidas. Como os estudos de reprodução animal nem sempre são preditivos da resposta humana e como o tratamento da onicomicose pode ser adiado até a conclusão da gravidez, recomenda-se que os grânulos orais de Lamisil (cloridrato de terbinafina) não sejam iniciados durante a gravidez.

Experiência em Estudos Clínicos
Porque os ensaios clínicos são conduzidos sob condições muito variadas, as taxas de reação adversa nos ensaios clínicos de um medicamento não podem ser comparadas diretamente às taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
Grânulos orais de lamisil (cloridrato de terbinafina)
Os dados descritos abaixo refletem a exposição à terbinafina, incluindo 1042 indivíduos expostos por uma mediana de 42 dias. Os grânulos orais de Lamisil (cloridrato de terbinafina) foram estudados em 2 ensaios controlados por ativos (n = 1042). A população era de crianças de 4 a 12 anos, 64% do sexo masculino e 36% do sexo feminino, 21% caucasiano, 47% preto e 32% outro. As características da doença de base (dermatophyte) dos indivíduos incluíram 49% de doenças T. amedrontadores15% T. violaceum15% M. canis2% M. audouiniie 1% outros. Indivíduos recebidos uma vez ao dia, durante 6 semanas, doses orais de grânulos orais de Lamisil (cloridrato de terbinafina) com base no peso corporal: <25 kg 125 mg / dia, 25-35 kg 187,5 mg / dia e> 35 kg 250 mg / dia. Os eventos adversos relatados nos 2 ensaios estão listados na tabela abaixo.
Tabela 2 Eventos adversos (≥ 1%) nos ensaios de Tinea Capitis
| Lamisil® Grânulos orais (%) N = 1042 | Griseofulvin oral suspensão (%) N = 507 | |
| Nasofaringite | 10) | 11) |
| Dor de cabeça | 7 | 8 |
| Pirexia | 7 | 6 |
| Tosse | 6 | 5 |
| Vômitos | 5 | 5 |
| Infecção do trato respiratório superior | 5 | 5 |
| Dor abdominal superior | 4 | 4 |
| Diarréia | 3 | 4 |
| Gripe | 2 | 1 |
| Dor abdominal | 2 | 1 |
| Dor faringolaríngea | 2 | 2 |
| Náusea | 2 | 2 |
| Erupção cutânea | 2 | 2 |
| Rinorréia | 2 | 0 |
| Congestão nasal | 2 | 1 |
| Prurido | 1 | 1 |
| Dor de dente | 1 | 1 |
Nos ensaios principais agrupados, 2% (17/1042) dos indivíduos do grupo terbinafina e 2% (6/507) do grupo griseofulvina sofreram a descontinuação do medicamento do estudo devido a eventos adversos. As categorias mais comuns de eventos adversos que causam descontinuação naqueles expostos à terbinafina incluíram distúrbios gastrointestinais, distúrbios cutâneos e subcutâneos e infecções e infestações.
Nenhum sinal de segurança oftalmológico foi identificado nos ensaios principais combinados. As avaliações oftalmológicas incluíram a fundoscopia dilatada para avaliar corpos refratários na retina, avaliação da acuidade visual e teste da visão de cores. Dos 940 indivíduos do grupo terbinafina e 471 indivíduos do grupo griseofulvina que concluíram a fundoscopia dilatada nas visitas pós-tratamento, nenhum dos indivíduos teve corpos refratários da retina na linha de base ou no final do tratamento. Para acuidade visual, 1% (11/837) de indivíduos tratados com terbinafina e 2% (7/426) dos indivíduos tratados com griseofulvina mostraram uma duplicação do ângulo visual após 6 semanas de tratamento, enquanto 2% (15/837) tratado com terbinafina e 3% (12/426) tratado com griseofulvina mostrou uma metade do ângulo visual após 6 semanas de tratamento. De indivíduos que concluíram a avaliação da visão de cores amarelo-azul para defeitos adquiridos, 5% (13/262) de indivíduos tratados com terbinafina e 6% (8/129) dos indivíduos tratados com griseofulvin tiveram confusão de cores em mais de um símbolo na semana 6 do que na linha de base, enquanto 13% (33/262) de indivíduos tratados com terbinafina e 13% (17/129) dos indivíduos tratados com griseofulvin identificaram mais símbolos corretamente na semana 6 do que na linha de base.
Lamisil (cloridrato de terbinafina) Comprimidos
Os eventos adversos relatados em três ensaios controlados por placebo nos EUA / Canadá incluíram diarréia (6%), erupções cutâneas (6%), dispepsia (4%), náusea (3%), anormalidades hepáticas (3%), prurido (3%), distúrbios do paladar (3%), dor abdominal (2%) e urticária (1%).
Alterações na lente ocular e na retina foram relatadas após o uso de comprimidos de Lamisil em ensaios clínicos em indivíduos adultos com onicomicose. O significado clínico dessas alterações é desconhecido.
Experiência pós-comercialização
Os seguintes eventos adversos foram identificados durante o uso pós-aprovação de Lamisil. Como esses eventos são relatados voluntariamente a partir de uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição a medicamentos.
Os eventos adversos relatados com o uso oral de terbinafina incluem: lesão hepática idiossincrática e sintomática e, casos de insuficiência hepática, alguns levando à morte ou transplante de fígado, reações cutâneas graves, neutropenia grave, trombocitopenia, agranulocitose, pancitopenia, anemia, angioedema e reações alérgicas (incluindo anafilaxia).
Erupções psoríase ou exacerbação da psoríase, pustulose exanthematosa generalizada aguda e precipitação e exacerbação do lúpus eritematoso cutâneo e sistêmico foram relatadas. A terbinafina oral pode causar distúrbios do paladar (incluindo perda de paladar), que geralmente se recupera dentro de várias semanas após a descontinuação do medicamento. Houve relatos de distúrbios prolongados (maiores que um ano) do paladar. Foi relatado que distúrbios do paladar são graves o suficiente para resultar em diminuição da ingestão de alimentos, levando a uma perda de peso significativa e indesejada.
Outras reações adversas relatadas incluem mal-estar, fadiga, artralgia, mialgia, vômito, pancreatite aguda, rabdomiólise, acuidade visual reduzida, defeitos no campo visual e perda de cabelo. Eventos adversos relatados espontaneamente desde que o medicamento foi comercializado incluem tempo de protrombina alterado (prolongamento e redução) em pacientes tratados concomitantemente com varfarina.

A experiência clínica em relação à sobredosagem com terbinafina oral é limitada. Doses de até 5 gramas em adultos (20 vezes a dose terapêutica diária de adultos) foram relatadas sem induzir reações adversas graves. Os sintomas de sobredosagem incluíram náusea, vômito, dor abdominal, tontura, erupção cutânea, micção frequente e dor de cabeça.

A farmacodinâmica dos grânulos orais Lamisil ® (cloridrato de terbinafina) é desconhecida.

A farmacocinética em crianças de 4 a 8 anos de idade com tinea capitis foi investigada em um estudo farmacocinético após simples e repetido (por 42 dias) administração oral de grânulos orais de Lamisil (cloridrato de terbinafina) (N = 16) uma vez ao dia, usando os grupos de peso corporal e doses descritas na seção 2.2. A exposição sistêmica (Cmax e AUC0-24) da terbinafina em crianças teve uma variabilidade interindividual relativamente alta (variando de 36% a 64%). No estado estacionário da AUC0-24 aumentado por um fator médio de 1,9 a 2,1 em doses. A meia-vida média (DP) efetiva obtida do acúmulo observado foi de 26,7 (13,8) horas e 30,5 (9,3) horas para as doses de 125 mg e 187,5 mg, respectivamente.
A exposição sistêmica à terbinafina nas crianças não excedeu os valores mais altos da exposição sistêmica em adultos que receberam doses repetidas uma vez ao dia de 250 mg de comprimidos de Lamisil (terbinafina). Uma avaliação farmacocinética populacional da terbinafina oral que incluiu crianças de 4 a 12 anos de idade e adultos de 18 a 45 anos (N = 113) constatou que a depuração (CL / F) da terbinafina depende do peso corporal de maneira não linear. Para uma criança típica de 25 kg de CL / F, previa-se 19 L / he para um adulto típico de 70 kg de peso corporal, previa-se que fosse 27 L / h. Na faixa de peso para pacientes pediátricos incluídos na análise (14,1 kg-68 kg), o CL / F previsto variou entre 15,6 - 26,7 L / h. No plasma, a terbinafina está> 99% ligada às proteínas plasmáticas. Antes da excreção, a terbinafina é rápida e extensamente metabolizada por pelo menos sete isoenzimas do CYP, com grandes contribuições do CYP2C9, CYP1A2, CYP3A4, CYP2C8 e CYP2C19. Não foram identificados metabolitos que apresentem atividade antifúngica semelhante à terbinafina. Aproximadamente 70% da dose administrada é eliminada na urina. Em pacientes adultos com insuficiência renal (depuração da creatinina ≤ 50 mL / min) ou cirrose hepática, a depuração da terbinafina é reduzida em aproximadamente 50% em comparação com os voluntários normais.



