



Composición:
Solicitud:
Usado en tratamiento:
Revisión médica por Oliinyk Elizabeth Ivanovna Última actualización de farmacia el 29.03.2022

¡Atención! ¡La información en la página es solo para profesionales médicos! ¡La información se recopila en Fuentes abiertas y puede contener errores significativos! ¡Tenga cuidado y vuelva a verificar toda la información de esta página!
Los 20 mejores medicamentos con los mismos ingredientes:


Formas de dosificación y fortalezas
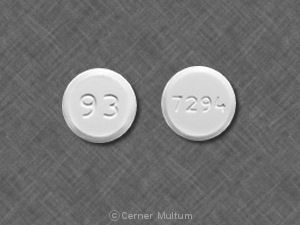
Tableta, circular blanca a amarilla de 250 mg tabletas biseladas bi-convex impresas con "LAMISIL" en forma circular en una lado y código "250" en el otro lado.
Almacenamiento y manejo
Tabletas Lamisil se suministran como teñido de blanco a amarillo tabletas biseladas circulares blancas, bi-convexas que contienen 250 mg de terbinafina impreso con "LAMISIL" en forma circular en un lado y código "250" en el otro.
Botellas de 100 tabletas NDC 0078-0179-05
Botellas de 30 tabletas NDC 0078-0179-15
Almacene las tabletas Lamisil por debajo de 25 ° C (77 ° F); en un apretado contenedor. Proteger de la luz.
Distribuido por: Novartis Pharmaceuticals Corporation East Hannover, Nueva Jersey 07936. Revisado: junio / 2013

Lamisil (clorhidrato de terbinafina) Se indican tabletas para el tratamiento de la onicomicosis de la uña del pie o la uña del dedo debido a dermatofitos (cinea unguium).
Antes de iniciar el tratamiento, muestras de uñas apropiadas para pruebas de laboratorio [preparación de hidróxido de potasio (KOH), cultivo de hongos, o biopsia de uñas] debe obtenerse para confirmar el diagnóstico de onicomicosis.

Onicomicosis de la uña: Una tableta de 250 mg una vez al día por 6 semanas.
Onicomicosis de la uña del pie: Una tableta de 250 mg una vez al día 12 semanas.
El efecto clínico óptimo se observa algunos meses después cura micológica y cese del tratamiento. Esto está relacionado con el período requerido para el crecimiento de uñas sanas.

Lamisil (clorhidrato de terbinafina) Los gránulos orales están contraindicados en individuos con antecedentes de reacción alérgica a la terbinafina oral debido al riesgo de anafilaxia.

ADVERTENCIAS
Incluido como parte de la PRECAUCIONES sección.
PRECAUCIONES
Hepatotoxicidad
Se han producido casos de insuficiencia hepática, algunos de los cuales provocan la muerte o el trasplante de hígado, con el uso de terbinafina oral durante la experiencia posterior a la comercialización en individuos con y sin enfermedad hepática preexistente. En la mayoría de los casos hepáticos informados, los pacientes tenían afecciones sistémicas subyacentes graves. La gravedad de los eventos hepáticos y / o su resultado pueden ser peores en pacientes con enfermedad hepática activa o crónica. El tratamiento con gránulos orales de lamisil (clorhidrato de terbinafina) debe suspenderse si se desarrolla evidencia bioquímica o clínica de lesión hepática.
No se recomienda el gránulo oral de lamisil (clorhidrato de terbinafina) para pacientes con enfermedad hepática crónica o activa. Antes de recetar gránulos orales de lamisil (clorhidrato de terbinafina), se debe evaluar la enfermedad hepática preexistente. La hepatotoxicidad puede ocurrir en pacientes con y sin enfermedad hepática preexistente. Se recomiendan pruebas de transaminasa sérica previa al tratamiento (ALT y AST) para todos los pacientes antes de tomar gránulos orales de lamisil (clorhidrato de terbinafina). Los pacientes recetaron gránulos orales de Lamisil (clorhidrato de terbinafina) y / o se debe advertir a sus tutores que informen inmediatamente a su médico sobre cualquier síntoma de náuseas persistentes, anorexia, fatiga, vómitos, dolor abdominal superior derecho o ictericia, orina oscura o heces pálidas. Los pacientes con estos síntomas deben dejar de tomar gránulos orales de lamisil (clorhidrato de terbinafina), y la función hepática del paciente debe evaluarse de inmediato.
Monitoreo de pruebas de laboratorio
Se recomiendan pruebas de transaminasa sérica previa al tratamiento (ALT y AST) para todos los pacientes antes de tomar gránulos orales de lamisil (clorhidrato de terbinafina).
Hematológico
Se han observado disminuciones transitorias en los recuentos absolutos de linfocitos (ALC) en ensayos clínicos. En ensayos controlados con placebo, 8/465 sujetos que recibieron tabletas Lamisil (1.7%) y 3/137 sujetos que recibieron placebo (2.2%) tuvieron disminuciones en ALC a menos de 1000 / mm3 en dos o más ocasiones. En pacientes con inmunodeficiencia conocida o sospechada, los médicos deben considerar controlar los recuentos sanguíneos completos si el tratamiento excede las seis semanas. Se han informado casos de neutropenia grave; estos fueron reversibles tras la interrupción de la terbinafina, con o sin terapia de apoyo. Si se presentan signos y síntomas clínicos que sugieren una infección secundaria, se debe obtener un recuento sanguíneo completo. Si el recuento de neutrófilos es ≤ 1,000 células / mm3, Los gránulos orales de lamisil (clorhidrato de terbinafina) deben suspenderse y comenzar el tratamiento de soporte.
Reacciones cutáneas
Ha habido informes posteriores a la comercialización de reacciones cutáneas graves (p. Ej., Síndrome de Stevens-Johnson y necrólisis epidérmica tóxica) con terbinafina oral. Si se produce erupción cutánea progresiva, se debe suspender el tratamiento con gránulos orales de Lamisil (clorhidrato de terbinafina).
Función renal
En pacientes con insuficiencia renal (aclaramiento de creatinina <50 ml / min), el uso de gránulos orales de Lamisil no se ha estudiado adecuadamente.
Lupus Erythenatosus
Durante la experiencia posterior a la comercialización, se han notificado precipitaciones y exacerbación del lupus eritematoso cutáneo y sistémico en pacientes que toman terbinafina oral. La terapia debe suspenderse en pacientes con signos y síntomas clínicos que sugieran lupus eritematoso.
Toxicología no clínica
Carcinogénesis, Mutugenesia, Deterioro de la fertilidad
En un estudio de carcinogenicidad oral de 28 meses en ratas, Se observó un aumento en la incidencia de tumores hepáticos en hombres con la dosis más alta probada, 69 mg / kg / día (2 veces el MRHD basado en comparaciones de AUC de la terbinafina original) sin embargo, a pesar de que la toxicidad limitante de la dosis no se logró con la dosis más alta probada, no se probaron dosis más altas.
Los resultados de una variedad de in vitro (mutaciones en >MI. coli y S. typhimurium, Reparación de ADN en hepatocitos de rata, mutagenicidad en fibroblastos de hámster chino, aberración cromosómica e intercambios de cromátidas hermanas en células de pulmón de hámster chino), y in vivo (aberración cromosómica en hámsters chinos, prueba de micronúcleos en ratones) las pruebas de genotoxicidad no dieron evidencia de un potencial mutagénico o clastogénico. Los estudios de reproducción oral en ratas a dosis de hasta 300 mg / kg / día (aproximadamente 12 veces el MRHD basado en comparaciones de BSA) no revelaron ningún efecto específico sobre la fertilidad u otros parámetros reproductivos. La aplicación intravaginal de clorhidrato de terbinafina a 150 mg / día en conejos preñados no aumentó la incidencia de abortos o partos prematuros ni afectó los parámetros fetales.
Uso en poblaciones específicas
Embarazo
Embarazo Categoría B .
Se han realizado estudios de reproducción oral en conejos y ratas a dosis de hasta 300 mg / kg / día [12x a 23x la dosis humana máxima recomendada (MRHD) en conejos y ratas, respectivamente, basado en el área de superficie corporal (BSA) comparaciones] y no han revelado evidencia de fertilidad deteriorada o daño al feto debido a la terbinafina. Sin embargo, no hay estudios adecuados y bien controlados en mujeres embarazadas. Debido a que los estudios de reproducción en animales no siempre predicen la respuesta humana, y debido a que el tratamiento de la onicomicosis puede posponerse hasta después de que se complete el embarazo, se recomienda que los gránulos orales Lamisil (clorhidrato de terbinafina) no se inicien durante el embarazo.
Madres lactantes
Después de la administración oral, la terbinafina está presente en la leche materna de las madres lactantes. La proporción de terbinafina en la leche al plasma es de 7: 1. No se recomienda el tratamiento con gránulos orales de lamisil (clorhidrato de terbinafina) en madres lactantes.
Uso pediátrico
Gránulos orales de Lamisil (clorhidrato de terbinafina) fue estudiado en dos aleatorizados, ensayos controlados activos en los que 1021 sujetos con un diagnóstico clínico de tiña capitis confirmado por microscopía KOH fueron tratados con gránulos orales de Lamisil (clorhidrato de terbinafina) a la dosis etiquetada por hasta 6 semanas. Los eventos adversos más comunes fueron nasofaringitis, dolor de cabeza, pirexia, tos, vómitos e infección del tracto respiratorio superior.
Uso geriátrico
Los gránulos orales de lamisil (clorhidrato de terbinafina) no se han estudiado en pacientes geriátricos.

EFECTOS ADVERSOS
Experiencia en estudios clínicos
Porque los ensayos clínicos se realizan en condiciones muy variables, Las tasas de reacciones adversas en los ensayos clínicos de un medicamento no se pueden comparar directamente con las tasas en los ensayos clínicos de otro medicamento y pueden no reflejar las tasas observadas en la práctica.
Lamisil (clorhidrato de terbinafina) Gránulos orales
Los datos descritos a continuación reflejan la exposición a terbinafina, incluidos 1042 sujetos expuestos durante una mediana de 42 días. Se estudiaron los gránulos orales de lamisil (clorhidrato de terbinafina) en 2 ensayos controlados activos (n = 1042). La población era niños de 4 a 12 años, 64% hombres y 36% mujeres, 21% caucásicos, 47% negros, 32% otros. Las características de la enfermedad basal (dermatofito) de los sujetos incluyeron el 49% T. tonsurans, 15% T. violaceum, 15% M. canis2% M. audouinii, y 1% otros. Sujetos recibidos una vez al día, durante 6 semanas, dosis orales de gránulos orales de Lamisil (clorhidrato de terbinafina) en función del peso corporal: <25 kg 125 mg / día, 25-35 kg 187.5 mg / día y> 35 kg 250 mg / día. Los eventos adversos informados en los 2 ensayos se enumeran en la tabla a continuación.
Tabla 2 Eventos adversos (≥ 1%) en los ensayos de tiña capitis
| Lamisil® Gránulos orales (%) N = 1042 | Griseofulvin oral suspensión (%) N = 507 | |
| Nasofaringitis | 10) | 11) |
| Dolor de cabeza | 7 | 8 |
| Pirexia | 7 | 6 |
| Tos | 6 | 5 |
| Vómitos | 5 | 5 |
| Infección del tracto respiratorio superior | 5 | 5 |
| Dolor abdominal superior | 4 | 4 |
| Diarrea | 3 | 4 |
| Influenza | 2 | 1 |
| Dolor abdominal | 2 | 1 |
| Dolor faringolaríngeo | 2 | 2 |
| Náuseas | 2 | 2 |
| Sarpullido | 2 | 2 |
| Rhinorrhea | 2 | 0 |
| Congestión nasal | 2 | 1 |
| Prurito | 1 | 1 |
| Dolor de muelas | 1 | 1 |
En los ensayos fundamentales agrupados, el 2% (17/1042) de los sujetos del grupo terbinafina y el 2% (6/507) en el grupo griseofulvin experimentaron la interrupción del fármaco del estudio debido a eventos adversos. Las categorías más comunes de eventos adversos que causaron la interrupción en las personas expuestas a terbinafina incluyeron trastornos gastrointestinales, trastornos cutáneos y subcutáneos, e infecciones e infestaciones.
No se identificó ninguna señal de seguridad oftalmológica en los ensayos fundamentales agrupados. Las evaluaciones oftalmológicas incluyeron fundoscopia dilatada para evaluar los cuerpos refractiles en la retina, la evaluación de la agudeza visual y las pruebas de visión del color. De los 940 sujetos en el grupo terbinafino y 471 sujetos en el grupo griseofulvin que completaron la fundoscopia dilatada en las visitas posteriores al tratamiento, ninguno de los sujetos tenía cuerpos refractiles de la retina al inicio o al final del tratamiento. Para agudeza visual, 1% (11/837) de sujetos tratados con terbinafina y 2% (7/426) de los sujetos tratados con griseofulvina mostraron una duplicación del ángulo visual después de 6 semanas de tratamiento, mientras que 2% (15/837) tratado con terbinafina y 3% (12/426) tratado con griseofulvin mostró una reducción a la mitad del ángulo visual después de 6 semanas de tratamiento. De los sujetos que completaron la evaluación de la visión del color amarillo-azul para defectos adquiridos, 5% (13/262) de sujetos tratados con terbinafina y 6% (8/129) de los sujetos tratados con griseofulvin tenían confusión de color en más de un símbolo en la semana 6 que en el valor inicial, mientras que 13% (33/262) de sujetos tratados con terbinafina y 13% (17/129) de los sujetos tratados con griseofulvin identificaron más símbolos correctamente en la semana 6 que al inicio del estudio.
Lamisil (clorhidrato de terbinafina) Tabletas
Los eventos adversos informados en tres ensayos controlados con placebo en EE. UU. / Canadá incluyeron diarrea (6%), erupciones cutáneas (6%), dispepsia (4%), náuseas (3%), anomalías hepáticas (3%), prurito (3%), alteraciones del gusto (3%), dolor abdominal (2%) y urticaria (1%).
Se han informado cambios en la lente ocular y la retina después del uso de tabletas Lamisil en ensayos clínicos en sujetos adultos con onicomicosis. Se desconoce la importancia clínica de estos cambios.
Experiencia de postmarketing
Se han identificado los siguientes eventos adversos durante el uso posterior a la aprobación de Lamisil. Debido a que estos eventos se informan voluntariamente de una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición a drogas.
Los eventos adversos informados con el uso de terbinafina oral incluyen: lesión hepática idiosincrásica y sintomática y, casos de insuficiencia hepática, algunos que conducen a la muerte o al trasplante de hígado, reacciones cutáneas graves, neutropenia severa, trombocitopenia, agranulocitosis, pancitopenia, anemia, angioedema y reacciones alérgicas (incluyendo anafilaxia).
Se han informado erupciones psoriasiformes o exacerbación de la psoriasis, pustulosis exantematosa generalizada aguda y precipitación y exacerbación del lupus eritematoso cutáneo y sistémico. La terbinafina oral puede causar alteración del sabor (incluida la pérdida del sabor) que generalmente se recupera dentro de varias semanas después de la interrupción del medicamento. Ha habido informes de alteraciones prolongadas (más de un año) del sabor. Se ha informado que las alteraciones del gusto son lo suficientemente graves como para provocar una disminución de la ingesta de alimentos, lo que lleva a una pérdida de peso significativa y no deseada.
Otras reacciones adversas que se han informado incluyen malestar general, fatiga, artralgia, mialgia, vómitos, pancreatitis aguda, rabdomiólisis, agudeza visual reducida, defectos del campo visual y pérdida de cabello. Los eventos adversos informados espontáneamente desde que se comercializó el medicamento incluyen un tiempo alterado de protrombina (prolongación y reducción) en pacientes tratados concomitantemente con warfarina.
INTERACCIONES DE DROGAS
Interacciones farmacológicas
In vivo Los estudios han demostrado que la terbinafina es un inhibidor de la isoenzima CYP450 2D6. Los medicamentos metabolizados predominantemente por la isoenzima CYP450 2D6 incluyen las siguientes clases de medicamentos: antidepresivos tricíclicos, inhibidores selectivos de la recaptación de serotonina, betabloqueantes, antiarrítmicos clase 1C (p. Ej., flecainida y propafenona) e inhibidores de la monoaminooxidasa Tipo B. La administración conjunta de Lamisil (clorhidrato de terbinafina) Los gránulos orales deben realizarse con un control cuidadoso y pueden requerir una reducción en la dosis del fármaco metabolizado 2D6. En un estudio para evaluar los efectos de la terbinafina sobre la desipramina en voluntarios sanos caracterizados como metabolizadores normales, La administración de terbinafina resultó en un aumento de 2 veces en la Cmáx y un aumento de 5 veces en el AUC. En este estudio, Se demostró que estos efectos persisten en la última observación a las 4 semanas después de la interrupción de Lamisil. En estudios en sujetos sanos caracterizados como metabolizadores extensos de dextrometorfano, la terbinafina aumenta la relación de metabolito dextrometorfano / dextrorfano en la orina en un promedio de 16 a 97 veces. In vitro Los estudios con microsomas hepáticos humanos mostraron que la terbinafina no inhibe el metabolismo de tolbutamida, etinilestradiol, etoxicumarina, ciclosporina, cisaprida y fluvastatina.
In vivo Los estudios de interacción fármaco-fármaco realizados en sujetos voluntarios sanos mostraron que la terbinafina no afecta el aclaramiento de antipirina o digoxina. La terbinafina disminuye el aclaramiento de cafeína en un 19%. La terbinafina aumenta el aclaramiento de ciclosporina en un 15%.
La influencia de la terbinafina en la farmacocinética de fluconazol, trimetoprima, sulfametoxazol, zidovudina o teofilina no se consideró clínicamente significativa.
La administración conjunta de una dosis única de fluconazol (100 mg) con una dosis única de terbinafina resultó en un aumento del 52% y 69% en la Cmáx y el AUC de terbinafina, respectivamente. El fluconazol es un inhibidor de las enzimas CYP 2C9 y CYP 3A. Según este hallazgo, es probable que otros inhibidores de CYP2C9 y CYP3A4 (p. Ej., ketoconazol, amiodarona) también puede conducir a un aumento sustancial en la exposición sistémica (Cmax y AUC) de terbinafina.
Ha habido informes espontáneos de aumento o disminución en los tiempos de protrombina en pacientes que toman concomitantemente terbinafina oral y warfarina, sin embargo, no se ha establecido una relación causal entre las tabletas de Lamisil y estos cambios.
El aclaramiento de terbinafina aumenta al 100% con rifampicina, un inductor de la enzima CYP450, y disminuye al 33% con cimetidina, un inhibidor de la enzima CYP450. El aclaramiento de terbinafina no se ve afectado por la ciclosporina. No hay información disponible de estudios adecuados de interacción fármaco-fármaco con las siguientes clases de medicamentos: anticonceptivos orales, terapias de reemplazo hormonal, hipoglucemiantes, fenitoínas, diuréticos tiazídicos y bloqueadores de los canales de calcio.
Interacciones alimentarias
No se realizó una evaluación del efecto de los alimentos sobre los gránulos orales Lamisil (clorhidrato de terbinafina). Sin embargo, en los ensayos clínicos, Lamisil (clorhidrato de terbinafina) Oral Granules se administró con alimentos.

Embarazo Categoría B .
Se han realizado estudios de reproducción oral en conejos y ratas a dosis de hasta 300 mg / kg / día [12x a 23x la dosis humana máxima recomendada (MRHD) en conejos y ratas, respectivamente, basado en el área de superficie corporal (BSA) comparaciones] y no han revelado evidencia de fertilidad deteriorada o daño al feto debido a la terbinafina. Sin embargo, no hay estudios adecuados y bien controlados en mujeres embarazadas. Debido a que los estudios de reproducción en animales no siempre predicen la respuesta humana, y debido a que el tratamiento de la onicomicosis puede posponerse hasta después de que se complete el embarazo, se recomienda que los gránulos orales Lamisil (clorhidrato de terbinafina) no se inicien durante el embarazo.

Experiencia en estudios clínicos
Porque los ensayos clínicos se realizan en condiciones muy variables, Las tasas de reacciones adversas en los ensayos clínicos de un medicamento no se pueden comparar directamente con las tasas en los ensayos clínicos de otro medicamento y pueden no reflejar las tasas observadas en la práctica.
Lamisil (clorhidrato de terbinafina) Gránulos orales
Los datos descritos a continuación reflejan la exposición a terbinafina, incluidos 1042 sujetos expuestos durante una mediana de 42 días. Se estudiaron los gránulos orales de lamisil (clorhidrato de terbinafina) en 2 ensayos controlados activos (n = 1042). La población era niños de 4 a 12 años, 64% hombres y 36% mujeres, 21% caucásicos, 47% negros, 32% otros. Las características de la enfermedad basal (dermatofito) de los sujetos incluyeron el 49% T. tonsurans, 15% T. violaceum, 15% M. canis2% M. audouinii, y 1% otros. Sujetos recibidos una vez al día, durante 6 semanas, dosis orales de gránulos orales de Lamisil (clorhidrato de terbinafina) en función del peso corporal: <25 kg 125 mg / día, 25-35 kg 187.5 mg / día y> 35 kg 250 mg / día. Los eventos adversos informados en los 2 ensayos se enumeran en la tabla a continuación.
Tabla 2 Eventos adversos (≥ 1%) en los ensayos de tiña capitis
| Lamisil® Gránulos orales (%) N = 1042 | Griseofulvin oral suspensión (%) N = 507 | |
| Nasofaringitis | 10) | 11) |
| Dolor de cabeza | 7 | 8 |
| Pirexia | 7 | 6 |
| Tos | 6 | 5 |
| Vómitos | 5 | 5 |
| Infección del tracto respiratorio superior | 5 | 5 |
| Dolor abdominal superior | 4 | 4 |
| Diarrea | 3 | 4 |
| Influenza | 2 | 1 |
| Dolor abdominal | 2 | 1 |
| Dolor faringolaríngeo | 2 | 2 |
| Náuseas | 2 | 2 |
| Sarpullido | 2 | 2 |
| Rhinorrhea | 2 | 0 |
| Congestión nasal | 2 | 1 |
| Prurito | 1 | 1 |
| Dolor de muelas | 1 | 1 |
En los ensayos fundamentales agrupados, el 2% (17/1042) de los sujetos del grupo terbinafina y el 2% (6/507) en el grupo griseofulvin experimentaron la interrupción del fármaco del estudio debido a eventos adversos. Las categorías más comunes de eventos adversos que causaron la interrupción en las personas expuestas a terbinafina incluyeron trastornos gastrointestinales, trastornos cutáneos y subcutáneos, e infecciones e infestaciones.
No se identificó ninguna señal de seguridad oftalmológica en los ensayos fundamentales agrupados. Las evaluaciones oftalmológicas incluyeron fundoscopia dilatada para evaluar los cuerpos refractiles en la retina, la evaluación de la agudeza visual y las pruebas de visión del color. De los 940 sujetos en el grupo terbinafino y 471 sujetos en el grupo griseofulvin que completaron la fundoscopia dilatada en las visitas posteriores al tratamiento, ninguno de los sujetos tenía cuerpos refractiles de la retina al inicio o al final del tratamiento. Para agudeza visual, 1% (11/837) de sujetos tratados con terbinafina y 2% (7/426) de los sujetos tratados con griseofulvina mostraron una duplicación del ángulo visual después de 6 semanas de tratamiento, mientras que 2% (15/837) tratado con terbinafina y 3% (12/426) tratado con griseofulvin mostró una reducción a la mitad del ángulo visual después de 6 semanas de tratamiento. De los sujetos que completaron la evaluación de la visión del color amarillo-azul para defectos adquiridos, 5% (13/262) de sujetos tratados con terbinafina y 6% (8/129) de los sujetos tratados con griseofulvin tenían confusión de color en más de un símbolo en la semana 6 que en el valor inicial, mientras que 13% (33/262) de sujetos tratados con terbinafina y 13% (17/129) de los sujetos tratados con griseofulvin identificaron más símbolos correctamente en la semana 6 que al inicio del estudio.
Lamisil (clorhidrato de terbinafina) Tabletas
Los eventos adversos informados en tres ensayos controlados con placebo en EE. UU. / Canadá incluyeron diarrea (6%), erupciones cutáneas (6%), dispepsia (4%), náuseas (3%), anomalías hepáticas (3%), prurito (3%), alteraciones del gusto (3%), dolor abdominal (2%) y urticaria (1%).
Se han informado cambios en la lente ocular y la retina después del uso de tabletas Lamisil en ensayos clínicos en sujetos adultos con onicomicosis. Se desconoce la importancia clínica de estos cambios.
Experiencia de postmarketing
Se han identificado los siguientes eventos adversos durante el uso posterior a la aprobación de Lamisil. Debido a que estos eventos se informan voluntariamente de una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición a drogas.
Los eventos adversos informados con el uso de terbinafina oral incluyen: lesión hepática idiosincrásica y sintomática y, casos de insuficiencia hepática, algunos que conducen a la muerte o al trasplante de hígado, reacciones cutáneas graves, neutropenia severa, trombocitopenia, agranulocitosis, pancitopenia, anemia, angioedema y reacciones alérgicas (incluyendo anafilaxia).
Se han informado erupciones psoriasiformes o exacerbación de la psoriasis, pustulosis exantematosa generalizada aguda y precipitación y exacerbación del lupus eritematoso cutáneo y sistémico. La terbinafina oral puede causar alteración del sabor (incluida la pérdida del sabor) que generalmente se recupera dentro de varias semanas después de la interrupción del medicamento. Ha habido informes de alteraciones prolongadas (más de un año) del sabor. Se ha informado que las alteraciones del gusto son lo suficientemente graves como para provocar una disminución de la ingesta de alimentos, lo que lleva a una pérdida de peso significativa y no deseada.
Otras reacciones adversas que se han informado incluyen malestar general, fatiga, artralgia, mialgia, vómitos, pancreatitis aguda, rabdomiólisis, agudeza visual reducida, defectos del campo visual y pérdida de cabello. Los eventos adversos informados espontáneamente desde que se comercializó el medicamento incluyen un tiempo alterado de protrombina (prolongación y reducción) en pacientes tratados concomitantemente con warfarina.

La experiencia clínica con respecto a la sobredosis con terbinafina oral es limitada. Se han informado dosis de hasta 5 gramos en adultos (20 veces la dosis terapéutica diaria para adultos) sin inducir reacciones adversas graves. Los síntomas de sobredosis incluyeron náuseas, vómitos, dolor abdominal, mareos, erupción cutánea, micción frecuente y dolor de cabeza.

Se desconoce la farmacodinámica de los gránulos orales Lamisil ® (clorhidrato de terbinafina).

La farmacocinética en niños de 4 a 8 años de edad con tiña capitis se investigó en un estudio farmacocinético después de una sola y repetida (por 42 días) administración oral de gránulos orales de Lamisil (clorhidrato de terbinafina) (N = 16) una vez al día, utilizando los grupos de peso corporal y las dosis descritas en la sección 2.2. La exposición sistémica (Cmax y AUC0-24) de terbinafina en niños tenía una variabilidad interindividual relativamente alta (que oscilaba entre 36% y 64%). En estado estacionario, las AUC0-24 aumentado en un factor medio de 1.9 a 2.1 en dosis. La vida media efectiva (DE) obtenida de la acumulación observada fue de 26,7 (13,8) h y 30,5 (9,3) h para las dosis de 125 mg y 187,5 mg, respectivamente.
La exposición sistémica a la terbinafina en los niños no excedió los valores más altos de la exposición sistémica en adultos que recibieron dosis repetidas una vez al día de tabletas Lamisil (terbinafina) de 250 mg. Una evaluación farmacocinética poblacional de terbinafina oral que incluyó niños de 4 a 12 años de edad y adultos de 18 a 45 años de edad (N = 113) encontró que el aclaramiento (CL / F) de terbinafina depende del peso corporal de manera no lineal. Para un niño típico de 25 kg, se pronosticó que CL / F sería de 19 L / hy para un adulto típico de 70 kg de peso corporal se predijo que sería de 27 L / h. Sobre el rango de peso para pacientes pediátricos incluidos en el análisis (14.1 kg-68 kg), el CL / F predicho varió entre 15.6 - 26.7 L / h. En plasma, la terbinafina se une> 99% a las proteínas plasmáticas. Antes de la excreción, la terbinafina se metaboliza rápida y ampliamente por al menos siete isoenzimas CYP con contribuciones importantes de CYP2C9, CYP1A2, CYP3A4, CYP2C8 y CYP2C19. No se han identificado metabolitos que tengan una actividad antimicótica similar a la terbinafina. Aproximadamente el 70% de la dosis administrada se elimina en la orina. En pacientes adultos con insuficiencia renal (aclaramiento de creatinina ≤ 50 ml / min) o cirrosis hepática, el aclaramiento de terbinafina disminuye en aproximadamente un 50% en comparación con los voluntarios normales.



