



コンポーネント:
治療オプション:
Oliinyk Elizabeth Ivanovna 、薬局による医学的評価、 最終更新日:29.03.2022

アテンション! そのこのページの情報は医療専門家のみを対象としています! その情報が収集したオープン源を含めることが可能である重大な誤差! 注意して、このページ上のすべての情報を再確認してください!


投薬形態と強さ。
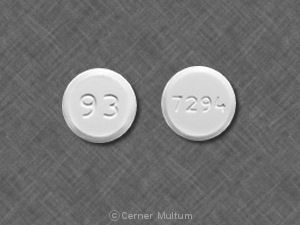
錠剤、250 mgの白から黄色の白の円形。 1つに円形の「LAMISIL」が刻印された2 ⁇ 面ベベル錠。 側面と反対側のコード「250」。.
保管と取り扱い。
ラミシルタブレット。 白から黄味で供給されます。 250 mgのテルビナフィンを含む白い円形の両 ⁇ の面取り錠。 片面に円形の「LAMISIL」、片面に「250」のコードが刻印されています。 その他。.
100錠のボトル。 NDC。 0078-0179-05。
30錠のボトル。 NDC。 0078-0179-15。
ラミシルタブレットを25°C(77°F)未満に保管します。タイトで。 コンテナ。. 光から守ってください。.
配布者:Novartis Pharmaceuticals Corporation East。 ハノーバー、ニュージャージー07936。. 改訂:2013年6月。

ラミシル(塩酸テルビナフィン)錠剤が示されています。 足の爪または爪のオニコミコーシスの治療のため。 皮膚糸状菌(tinea unguium)。.
治療を開始する前に、適切な爪の標本。 実験室試験用[水酸化カリウム(KOH)の準備、真菌培養、。 または爪生検]は、爪真菌症の診断を確認するために取得する必要があります。.

爪爪真菌症。:1日1回250 mg錠1錠。 6週間。.
爪爪真菌症。:1日1回250 mgタブレット1つ。 12週間。.
最適な臨床効果は数か月後に見られます。 菌学的治癒と治療の中止。. これは期間に関連しています。 健康な爪の成長に必要です。.

ラミシル(塩酸テルビナフィン)経口 ⁇ 粒は、アナフィラキシーのリスクがあるため、経口テルビナフィンに対するアレルギー反応の病歴のある個人には禁 ⁇ です。.

警告。
の一部として含まれています。 注意。 セクション。.
注意。
肝毒性。
肝不全の症例、一部は死亡または肝移植につながり、既存の肝疾患の有無にかかわらず、市販後の経験中に経口テルビナフィンを使用して発生しました。. 報告された肝臓の症例の大部分では、患者は深刻な基礎全身状態を有していました。. 肝事象の重症度および/またはその結果は、活動性または慢性肝疾患の患者では悪化する可能性があります。. 肝障害の生化学的または臨床的証拠が生じた場合は、ラミシル経口 ⁇ 粒(塩酸テルビナフィン)による治療を中止する必要があります。.
ラミシル経口 ⁇ 粒(塩酸テルビナフィン)は、慢性または活発な肝疾患の患者には推奨されません。. ラミシル経口 ⁇ 粒(塩酸テルビナフィン)を処方する前に、既存の肝疾患を評価する必要があります。. 肝毒性は、既存の肝疾患の有無にかかわらず患者に発生する可能性があります。. ラミシル経口 ⁇ 粒(塩酸テルビナフィン)を服用する前に、すべての患者に前処理血清トランスアミナーゼ(ALTおよびAST)検査をお勧めします。. 患者はラミシル経口 ⁇ 粒を処方した。 (塩酸テルビナフィン。) および/または彼らの保護者は、持続的な吐き気の症状があれば直ちに医師に報告するよう警告されるべきです。, 拒食症。, 疲労。, ⁇ 吐。, 右上腹部の痛みまたは黄 ⁇ 。, 暗い尿または淡い便。. これらの症状のある患者は、ラミシル経口 ⁇ 粒(塩酸テルビナフィン)の服用を中止し、患者の肝機能を直ちに評価する必要があります。.
モニタリングラボテスト。
ラミシル経口 ⁇ 粒(塩酸テルビナフィン)を服用する前に、すべての患者に前処理血清トランスアミナーゼ(ALTおよびAST)検査をお勧めします。.
血液学。
臨床試験では、絶対リンパ球数(ALC)の一時的な減少が観察されています。. プラセボ対照試験では、ラミシルタブレットを投与された8/465人の被験者(1.7%)とプラセボを投与された3/137人の被験者(2.2%)がALCで1000 / mm未満に減少しました。3 2回以上。. 既知または疑われる免疫不全の患者では、治療が6週間を超える場合、医師は完全な血球数のモニタリングを検討する必要があります。. 重度の好中球減少症の症例が報告されています。これらは、支持療法の有無にかかわらず、テルビナフィンの中止時に可逆的でした。. 二次感染を示唆する臨床徴候および症状が発生した場合、完全な血球数を取得する必要があります。. 好中球数が≤1,000細胞/ mmの場合。3、ラミシル経口 ⁇ 粒(塩酸テルビナフィン)を中止し、支持管理を開始する必要があります。.
皮膚反応。
深刻な皮膚反応のマーケティング後の報告があります(例:.、スティーブンス・ジョンソン症候群および中毒性表皮壊死症)、経口テルビナフィン。. 進行性の皮膚の発疹が発生した場合は、ラミシル経口 ⁇ 粒(塩酸テルビナフィン)による治療を中止する必要があります。.
腎機能。
腎機能障害(クレアチニンクリアランス<50 mL / min)の患者では、ラミシル経口 ⁇ 粒の使用は十分に研究されていません。.
Lupus Erythenatosus。
市販後の経験では、経口テルビナフィンを服用している患者で、皮膚および全身性エリテマトーデスの沈殿と悪化が報告されています。. エリテマトーデスを示唆する臨床症状や症状のある患者では、治療を中止する必要があります。.
非臨床毒性学。
発がん、突然変異誘発、生殖能力の障害。
ラットを用いた28ヶ月間の経口発がん性試験。, 肝腫瘍の発生率の増加は、テストされた最高用量で男性で観察されました。, 69 mg / kg /日。 (親テルビナフィンのAUC比較に基づく2x MRHD。) しかしながら。, 最高試験量では用量制限毒性は達成されなかったとしても。, 高用量はテストされませんでした。.
さまざまな結果。 in vitro。 (変異。 > E。コリ。 と。 S.チフィムリウム。、ラット肝細胞のDNA修復、チャイニーズハムスター線維芽細胞の変異原性、染色体異常およびチャイニーズハムスター肺細胞の姉妹染色分体交換)、および。 in vivo。 (チャイニーズハムスターの染色体異常、マウスの小核試験)遺伝毒性試験では、変異原性または染色体異常誘発性の可能性の証拠はありませんでした。. 300 mg / kg /日までの用量でのラットの経口生殖試験(BSA比較に基づくMRHDの約12倍)では、生殖能力やその他の生殖パラメーターに対する特定の影響は明らかになりませんでした。. 妊娠中のウサギに150 mg /日で塩酸テルビナフィンを血管内投与しても、流産や早産の発生率は増加せず、胎児のパラメーターにも影響しませんでした。.
特定の集団で使用します。
妊娠。
妊娠カテゴリーB .
ウサギとラットで300 mg / kg /日までの用量で経口生殖試験が行われた。 [最大推奨ヒト用量の12倍から23倍。 (MRHD。) ウサギとラットで。, それぞれ。, 体表面積に基づく。 (BSA。) 比較。] テルビナフィンによる受胎能障害や胎児への危害の証拠は明らかにされていません。. しかし、妊婦を対象とした適切で適切に管理された研究はありません。. 動物生殖試験は常に人間の反応を予測するとは限らないため、オニコミコシスの治療は妊娠が完了するまで延期できるため、妊娠中にラミシル(塩酸テルビナフィン)経口 ⁇ 粒を開始しないことをお勧めします。.
授乳中の母親。
経口投与後、テルビナフィンは授乳中の母親の母乳中に存在します。. 牛乳中のテルビナフィンと血漿の比率は7:1です。. ラミシル経口 ⁇ 粒(塩酸テルビナフィン)による治療は、授乳中の母親には推奨されません。.
小児用。
ラミシル経口 ⁇ 粒。 (塩酸テルビナフィン。) 無作為化された2つで研究されました。, KOH顕微鏡で確認された白 ⁇ 炎の臨床診断を受けた1021人の被験者がラミシル経口 ⁇ 粒で治療されたアクティブ対照試験。 (塩酸テルビナフィン。) 表示された用量で最大6週間。. 最も一般的な有害事象は、鼻 ⁇ 頭炎、頭痛、発熱、咳、 ⁇ 吐、および上気道感染症でした。.
老人用。
ラミシル経口 ⁇ 粒(塩酸テルビナフィン)は、老人患者では研究されていません。.

副作用。
臨床研究の経験。
臨床試験はさまざまな条件下で行われているためです。, 薬物の臨床試験における副作用率は、他の薬物の臨床試験における率と直接比較することはできず、実際に観察された率を反映していない可能性があります。.
ラミシル(塩酸テルビナフィン)経口 ⁇ 粒。
以下に説明するデータは、中央値42日間暴露された1042人の被験者を含むテルビナフィンへの暴露を反映しています。. ラミシル経口 ⁇ 粒(塩酸テルビナフィン)は、2つの活性対照試験(n = 1042)で研究されました。. 人口は4〜12歳の子供、64%が男性、36%が女性、21%が白人、47%が黒人、32%その他でした。. 被験者のベースライン疾患(皮膚糸状菌)の特徴には、49%が T.トンスラン。、15%。 T. violaceum。、15%。 M.カニス。、2%。 M. audouinii。、その他1%。. 被験者は、体重に基づいて、1日1回、6週間、ラミシル経口 ⁇ 粒(塩酸テルビナフィン)の経口投与を受けました:<25kg 125 mg /日、25-35kg 187.5 mg /日、> 35kg 250 mg /日。. 2つの試験で報告された有害事象は、以下の表にリストされています。.
表2白 ⁇ 炎試験の有害事象(≥1%)。
| ラミシル®。 経口 ⁇ 粒(%)。 N = 1042。 | グリセオフルビン経口。 一時停止(%)。 N = 507。 | |
| 鼻 ⁇ 頭炎。 | 10。 | 11。 |
| 頭痛。 | 7 | 8 |
| 発熱。 | 7 | 6 |
| 咳。 | 6 | 5 |
| ⁇ 吐。 | 5 | 5 |
| 上気道感染症。 | 5 | 5 |
| 上腹部の痛み。 | 4 | 4 |
| 下 ⁇ 。 | 3 | 4 |
| インフルエンザ。 | 2 | 1 |
| 腹痛。 | 2 | 1 |
| ⁇ 頭痛の痛み。 | 2 | 2 |
| 吐き気。 | 2 | 2 |
| 発疹。 | 2 | 2 |
| 鼻漏。 | 2 | 0 |
| 鼻づまり。 | 2 | 1 |
| ⁇ 。 | 1 | 1 |
| 歯痛。 | 1 | 1 |
プールされた重要な試験では、テルビナフィン群の被験者の2%(17/1042)とグリセオフルビン群の2%(6/507)が、有害事象による研究薬物の中止を経験しました。. テルビナフィンに暴露されたもので中止を引き起こす有害事象の最も一般的なカテゴリーには、胃腸障害、皮膚および皮下障害、ならびに感染症および寄生虫症が含まれました。.
プールされた重要な試験では、眼科の安全信号は確認されませんでした。. 眼科の評価には、網膜の屈折体を評価するための拡張眼内視鏡検査、視力評価、色視力検査が含まれていました。. 治療後の訪問で拡張眼底検査を完了したテルビナフィン群の940人の被験者とグリセオフルビングループの471人の被験者のうち、ベースラインまたは治療終了時に網膜の屈折体を持っている被験者はいませんでした。. 視力のために。, 1%。 (11/837。) テルビナフィンと2%で治療された被験者の。 (7/426。) グリセオフルビンで治療された被験者の6週間の治療後、視覚角が2倍になりました。, 一方、2%。 (15/837。) テルビナフィンと3%で治療。 (12/426。) グリセオフルビンで治療すると、6週間の治療後に視角が半分になりました。. 後天性欠損症の黄青色視力評価を完了した被験者の。, 5%。 (13/262。) テルビナフィンと6%で治療された被験者の。 (8/129。) グリセオフルビンで治療された被験者のうち、ベースライン時よりも6週目に複数のシンボルで色の混乱がありました。, 一方、13%。 (33/262。) テルビナフィンと13%で治療された被験者の。 (17/129。) グリセオフルビンで治療された被験者のうち、6週目にベースラインよりも多くのシンボルを正しく識別しました。.
ラミシル(塩酸テルビナフィン)錠剤。
米国/カナダの3つのプラセボ対照試験で報告された有害事象には、下 ⁇ (6%)、発疹(6%)、消化不良(4%)、吐き気(3%)、肝異常(3%)、そう ⁇ (3%)、味覚障害(3%)、腹痛(2%)、じんま疹(1%)。.
爪真菌症の成人被験者を対象とした臨床試験でのラミシル錠の使用に続いて、眼の水晶体および網膜の変化が報告されています。. これらの変化の臨床的意義は不明です。.
市販後の経験。
ラミシルの承認後の使用中に、以下の有害事象が確認されました。. これらのイベントは不確実なサイズの集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることは常に可能ではありません。.
テルビナフィンの経口使用で報告された有害事象には、特異性および症候性の肝障害および, 肝不全の症例。, 一部は死亡または肝移植につながります。, 深刻な皮膚反応。, 重度の好中球減少症。, 血小板減少症。, 無 ⁇ 粒球症。, 汎血球減少症。, 貧血。, 血管浮腫とアレルギー反応。 (アナフィラキシーを含む。).
乾 ⁇ の乾 ⁇ 性発疹または増悪、急性全身性発疹性 ⁇ 炎、皮膚および全身性エリテマトーデスの沈殿および増悪が報告されています。. 経口テルビナフィンは、通常、薬物の中止後数週間以内に回復する味覚障害(味覚喪失を含む)を引き起こす可能性があります。. 長期にわたる(1年を超える)味覚障害の報告があります。. 味覚障害は、食物摂取量の減少をもたらし、重大かつ望ましくない体重減少をもたらすほど深刻であると報告されています。.
報告されている他の副作用には、 ⁇ 怠感、疲労、関節痛、筋肉痛、 ⁇ 吐、急性 ⁇ 炎、横紋筋融解症、視力の低下、視野欠損、脱毛などがあります。. 薬剤が販売されてから自発的に報告された有害事象には、ワルファリンを併用して治療された患者のプロトロンビン時間の変化(延長と減少)が含まれます。.
薬物相互作用。
薬物間相互作用。
生体内で。 研究によると、テルビナフィンはCYP450 2D6アイソザイムの阻害剤です。. CYP450 2D6アイソザイムによって主に代謝される薬物には、次の薬物クラスが含まれます:三環系抗うつ薬、選択的セロトニン再取り込み阻害剤、ベータ遮断薬、抗不整脈薬クラス1C(例:.、フレカイニドとプロパフェノン)およびモノアミンオキシダーゼ阻害剤タイプB。ラミシル(塩酸テルビナフィン)の経口 ⁇ 粒の同時投与は、注意深く監視して行う必要があり、2D6代謝薬の用量を減らす必要がある場合があります。. 通常の代謝者として特徴付けられる健康なボランティアのデシプラミンに対するテルビナフィンの影響を評価する研究で。, テルビナフィンの投与により、Cmaxが2倍、AUCが5倍に増加しました。この研究で。, これらの影響は、ラミシルの中止後4週間の最後の観察で持続することが示されました。. デキストロメトルファンの広範な代謝者として特徴付けられる健康な被験者を対象とした研究では、テルビナフィンは尿中のデキストロメトルファン/デキストロルファン代謝産物の比率を平均で16〜97倍に増加させます。. In vitro。 ヒト肝ミクロソームを用いた研究では、テルビナフィンはトルブタミド、エチニルエストラジオール、エトキシクマリン、シクロスポリン、シサプリド、フルバスタチンの代謝を阻害しないことが示されました。.
生体内で。 健康なボランティアの被験者を対象に実施された薬物間相互作用研究は、テルビナフィンがアンチピリンまたはジゴキシンのクリアランスに影響を与えないことを示しました。. テルビナフィンは、カフェインのクリアランスを19%減少させます。. テルビナフィンはシクロスポリンのクリアランスを15%増加させます。.
フルコナゾール、トリメトプリム、スルファメトキサゾール、ジドブジンまたはテオフィリンの薬物動態に対するテルビナフィンの影響は、臨床的に重要であるとは考えられていませんでした。.
フルコナゾール(100 mg)の単回投与とテルビナフィンの単回投与の同時投与により、テルビナフィンCmaxとAUCがそれぞれ52%と69%増加しました。. フルコナゾールは、CYP 2C9およびCYP 3A酵素の阻害剤です。. この発見に基づいて、CYP2C9とCYP3A4の両方の他の阻害剤(例えば、.、ケトコナゾール、アミオダロン)もテルビナフィンの全身曝露(CmaxおよびAUC)の大幅な増加につながる可能性があります。.
経口テルビナフィンとワルファリンを併用している患者では、プロトロンビン時間の増加または減少の自発的な報告がありましたが、ラミシルタブレットとこれらの変化との因果関係は確立されていません。.
テルビナフィンのクリアランスは、CYP450酵素誘導剤であるリファンピンによって100%増加し、CYP450酵素阻害剤であるシメチジンによって33%減少しました。. テルビナフィンのクリアランスはシクロスポリンの影響を受けません。. 以下のクラスの薬物との適切な薬物間相互作用研究から入手できる情報はありません:経口避妊薬、ホルモン補充療法、低血糖症、フェニトイン、チアジド利尿薬、およびカルシウムチャネル遮断薬。.
食品相互作用。
ラミシル(塩酸テルビナフィン)経口 ⁇ 粒に対する食物の影響の評価は行われませんでした。. しかし、臨床試験では、ラミシル(塩酸テルビナフィン)経口 ⁇ 粒を食物とともに投与しました。.

妊娠カテゴリーB .
ウサギとラットで300 mg / kg /日までの用量で経口生殖試験が行われた。 [最大推奨ヒト用量の12倍から23倍。 (MRHD。) ウサギとラットで。, それぞれ。, 体表面積に基づく。 (BSA。) 比較。] テルビナフィンによる受胎能障害や胎児への危害の証拠は明らかにされていません。. しかし、妊婦を対象とした適切で適切に管理された研究はありません。. 動物生殖試験は常に人間の反応を予測するとは限らないため、オニコミコシスの治療は妊娠が完了するまで延期できるため、妊娠中にラミシル(塩酸テルビナフィン)経口 ⁇ 粒を開始しないことをお勧めします。.

臨床研究の経験。
臨床試験はさまざまな条件下で行われているためです。, 薬物の臨床試験における副作用率は、他の薬物の臨床試験における率と直接比較することはできず、実際に観察された率を反映していない可能性があります。.
ラミシル(塩酸テルビナフィン)経口 ⁇ 粒。
以下に説明するデータは、中央値42日間暴露された1042人の被験者を含むテルビナフィンへの暴露を反映しています。. ラミシル経口 ⁇ 粒(塩酸テルビナフィン)は、2つの活性対照試験(n = 1042)で研究されました。. 人口は4〜12歳の子供、64%が男性、36%が女性、21%が白人、47%が黒人、32%その他でした。. 被験者のベースライン疾患(皮膚糸状菌)の特徴には、49%が T.トンスラン。、15%。 T. violaceum。、15%。 M.カニス。、2%。 M. audouinii。、その他1%。. 被験者は、体重に基づいて、1日1回、6週間、ラミシル経口 ⁇ 粒(塩酸テルビナフィン)の経口投与を受けました:<25kg 125 mg /日、25-35kg 187.5 mg /日、> 35kg 250 mg /日。. 2つの試験で報告された有害事象は、以下の表にリストされています。.
表2白 ⁇ 炎試験の有害事象(≥1%)。
| ラミシル®。 経口 ⁇ 粒(%)。 N = 1042。 | グリセオフルビン経口。 一時停止(%)。 N = 507。 | |
| 鼻 ⁇ 頭炎。 | 10。 | 11。 |
| 頭痛。 | 7 | 8 |
| 発熱。 | 7 | 6 |
| 咳。 | 6 | 5 |
| ⁇ 吐。 | 5 | 5 |
| 上気道感染症。 | 5 | 5 |
| 上腹部の痛み。 | 4 | 4 |
| 下 ⁇ 。 | 3 | 4 |
| インフルエンザ。 | 2 | 1 |
| 腹痛。 | 2 | 1 |
| ⁇ 頭痛の痛み。 | 2 | 2 |
| 吐き気。 | 2 | 2 |
| 発疹。 | 2 | 2 |
| 鼻漏。 | 2 | 0 |
| 鼻づまり。 | 2 | 1 |
| ⁇ 。 | 1 | 1 |
| 歯痛。 | 1 | 1 |
プールされた重要な試験では、テルビナフィン群の被験者の2%(17/1042)とグリセオフルビン群の2%(6/507)が、有害事象による研究薬物の中止を経験しました。. テルビナフィンに暴露されたもので中止を引き起こす有害事象の最も一般的なカテゴリーには、胃腸障害、皮膚および皮下障害、ならびに感染症および寄生虫症が含まれました。.
プールされた重要な試験では、眼科の安全信号は確認されませんでした。. 眼科の評価には、網膜の屈折体を評価するための拡張眼内視鏡検査、視力評価、色視力検査が含まれていました。. 治療後の訪問で拡張眼底検査を完了したテルビナフィン群の940人の被験者とグリセオフルビングループの471人の被験者のうち、ベースラインまたは治療終了時に網膜の屈折体を持っている被験者はいませんでした。. 視力のために。, 1%。 (11/837。) テルビナフィンと2%で治療された被験者の。 (7/426。) グリセオフルビンで治療された被験者の6週間の治療後、視覚角が2倍になりました。, 一方、2%。 (15/837。) テルビナフィンと3%で治療。 (12/426。) グリセオフルビンで治療すると、6週間の治療後に視角が半分になりました。. 後天性欠損症の黄青色視力評価を完了した被験者の。, 5%。 (13/262。) テルビナフィンと6%で治療された被験者の。 (8/129。) グリセオフルビンで治療された被験者のうち、ベースライン時よりも6週目に複数のシンボルで色の混乱がありました。, 一方、13%。 (33/262。) テルビナフィンと13%で治療された被験者の。 (17/129。) グリセオフルビンで治療された被験者のうち、6週目にベースラインよりも多くのシンボルを正しく識別しました。.
ラミシル(塩酸テルビナフィン)錠剤。
米国/カナダの3つのプラセボ対照試験で報告された有害事象には、下 ⁇ (6%)、発疹(6%)、消化不良(4%)、吐き気(3%)、肝異常(3%)、そう ⁇ (3%)、味覚障害(3%)、腹痛(2%)、じんま疹(1%)。.
爪真菌症の成人被験者を対象とした臨床試験でのラミシル錠の使用に続いて、眼の水晶体および網膜の変化が報告されています。. これらの変化の臨床的意義は不明です。.
市販後の経験。
ラミシルの承認後の使用中に、以下の有害事象が確認されました。. これらのイベントは不確実なサイズの集団から自発的に報告されるため、その頻度を確実に推定したり、薬物曝露との因果関係を確立したりすることは常に可能ではありません。.
テルビナフィンの経口使用で報告された有害事象には、特異性および症候性の肝障害および, 肝不全の症例。, 一部は死亡または肝移植につながります。, 深刻な皮膚反応。, 重度の好中球減少症。, 血小板減少症。, 無 ⁇ 粒球症。, 汎血球減少症。, 貧血。, 血管浮腫とアレルギー反応。 (アナフィラキシーを含む。).
乾 ⁇ の乾 ⁇ 性発疹または増悪、急性全身性発疹性 ⁇ 炎、皮膚および全身性エリテマトーデスの沈殿および増悪が報告されています。. 経口テルビナフィンは、通常、薬物の中止後数週間以内に回復する味覚障害(味覚喪失を含む)を引き起こす可能性があります。. 長期にわたる(1年を超える)味覚障害の報告があります。. 味覚障害は、食物摂取量の減少をもたらし、重大かつ望ましくない体重減少をもたらすほど深刻であると報告されています。.
報告されている他の副作用には、 ⁇ 怠感、疲労、関節痛、筋肉痛、 ⁇ 吐、急性 ⁇ 炎、横紋筋融解症、視力の低下、視野欠損、脱毛などがあります。. 薬剤が販売されてから自発的に報告された有害事象には、ワルファリンを併用して治療された患者のプロトロンビン時間の変化(延長と減少)が含まれます。.

経口テルビナフィンの過剰摂取に関する臨床経験は限られています。. 成人の最大5グラム(成人の治療用量の20倍)の用量が、深刻な副作用を引き起こすことなく報告されています。. 過剰摂取の症状には、吐き気、 ⁇ 吐、腹痛、めまい、発疹、頻繁な排尿、頭痛が含まれていました。.

ラミシル®(塩酸テルビナフィン)経口 ⁇ 粒の薬力学は不明です。.

白 ⁇ 炎の4〜8歳の子供の薬物動態は、単回および反復後の薬物動態研究で調査されました。 (42日間。) ラミシル経口 ⁇ 粒の経口投与。 (塩酸テルビナフィン。) 。(N = 16。) 1日1回。, セクション2.2で説明されている体重グループと用量を使用する。. 全身曝露(CmaxおよびAUC。0-24。)子供のテルビナフィンの個人間の変動は比較的高かった(36%から64%の範囲)。. 定常状態では、AUC。0-24。 用量全体で平均1.9から2.1の係数で増加した。. 観察された蓄積から得られた平均(SD)有効半減期は、それぞれ125 mgおよび187.5 mgの用量で26.7(13.8)時間および30.5(9.3)時間でした。.
子供のテルビナフィンへの全身曝露は、250 mgのラミシル(テルビナフィン)錠剤を1日1回繰り返し投与された成人の全身曝露の最高値を超えませんでした。. 4〜12歳の子供と18〜45歳の成人(N = 113)を含む経口テルビナフィンの母集団薬物動態評価では、テルビナフィンのクリアランス(CL / F)は非線形的に体重に依存することがわかりました。. CL / F 25 kgの典型的な子供の場合、19 L / hと予測され、体重70 kgの典型的な成人の場合、27 L / hと予測されました。. 分析に含まれる小児患者の体重範囲(14.1 kg-68 kg)で、予測されたCL / Fは15.6〜26.7 L / hrの範囲でした。. 血漿では、テルビナフィンは血漿タンパク質に99%以上結合しています。. 排 ⁇ 前に、テルビナフィンは少なくとも7つのCYPアイソザイムによって急速かつ広範囲に代謝され、CYP2C9、CYP1A2、CYP3A4、CYP2C8およびCYP2C19からの主要な寄与があります。. テルビナフィンに似た抗真菌活性を持つ代謝物は確認されていません。. 投与量の約70%が尿から排出されます。. 腎障害(クレアチニンクリアランス≤50 mL / min)または肝硬変の成人患者では、テルビナフィンのクリアランスは通常のボランティアと比較して約50%減少します。.



