



Komposition:
Anwendung:
Wird bei der Behandlung verwendet:
Medizinisch geprüft von Oliinyk Elizabeth Ivanovna, Apotheke Zuletzt aktualisiert am 29.03.2022

Achtung! Die Informationen auf der Seite sind nur für medizinisches Fachpersonal! Die Informationen werden in öffentlichen Quellen gesammelt und können aussagekräftige Fehler enthalten! Seien Sie vorsichtig und überprüfen Sie alle Informationen auf dieser Seite!
Top 20 Medikamente mit den gleichen Inhaltsstoffen:


Dosierungsformen und Stärken
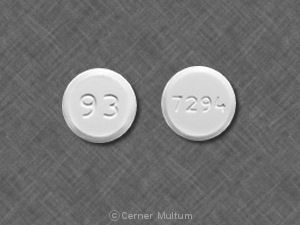
Tablette, 250 mg weiß bis gelb gefärbt weiß kreisförmig, zweikonvexe, abgeschrägte Tabletten, die auf einer kreisförmigen Form mit „LAMISIL“ bedruckt sind Seite und Code "250" auf der anderen Seite.
Lagerung und Handhabung
Lamisil Tabletten werden als weiß bis gelb gefärbt geliefert weiße kreisförmige, zweikonvexe, abgeschrägte Tabletten mit 250 mg Terbinafin auf einer Seite mit „LAMISIL“ in kreisförmiger Form und auf der mit dem Code „250“ bedruckt andere.
Flaschen mit 100 Tabletten NDC 0078-0179-05
Flaschen mit 30 Tabletten NDC 0078-0179-15
Lagern Sie Lamisil-Tabletten unter 25 ° C. in einem engen Container. Vor Licht schützen.
Vertrieb durch: Novartis Pharmaceuticals Corporation East Hannover, New Jersey 07936. Überarbeitet: Juni / 2013

Lamisil-Tabletten (Terbinafinhydrochlorid) sind angegeben zur Behandlung von Onychomykose des Zehennagels oder Fingernagels aufgrund von Dermatophyten (Tinea Unguium).
Vor Beginn der Behandlung geeignete Nagelproben für Labortests [Kaliumhydroxid (KOH) -Vorbereitung, Pilzkultur, oder Nagelbiopsie] sollte erhalten werden, um die Diagnose einer Onychomykose zu bestätigen.

Fingernagel-Onychomykose: Eine 250-mg-Tablette einmal täglich für 6 Wochen.
Zehennagel-Onychomykose: Eine 250 mg Tablette einmal täglich für 12 Wochen.
Der optimale klinische Effekt wird einige Monate später beobachtet mykologische Heilung und Beendigung der Behandlung. Dies hängt mit dem Zeitraum zusammen erforderlich für das Auswachsen eines gesunden Nagels.

Lamisil (Terbinafinhydrochlorid) Orales Granulat ist bei Personen mit allergischer Reaktion auf orales Terbinafin in der Vorgeschichte wegen des Risikos einer Anaphylaxie kontraindiziert.

WARNHINWEISE
Im Rahmen der enthalten VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Hepatotoxizität
Fälle von Leberversagen, von denen einige zum Tod oder zur Lebertransplantation führten, traten bei oralem Terbinafin während der Erfahrung nach dem Inverkehrbringen bei Personen mit und ohne bereits bestehende Lebererkrankung auf. In den meisten gemeldeten Leberfällen hatten die Patienten schwerwiegende systemische Grundzustände. Die Schwere von Leberereignissen und / oder deren Ausgang kann bei Patienten mit aktiver oder chronischer Lebererkrankung schlimmer sein. Die Behandlung mit Lamisil Oral Granules (Terbinafinhydrochlorid) sollte abgebrochen werden, wenn sich ein biochemischer oder klinischer Nachweis einer Leberschädigung entwickelt.
Lamisil Oral Granules (Terbinafinhydrochlorid) wird bei Patienten mit chronischer oder aktiver Lebererkrankung nicht empfohlen. Vor der Verschreibung von Lamisil Oral Granules (Terbinafinhydrochlorid) sollte eine bereits bestehende Lebererkrankung untersucht werden. Hepatotoxizität kann bei Patienten mit und ohne bereits bestehende Lebererkrankung auftreten. Vorbehandlung Serumtransaminase-Tests (ALT und AST) werden für alle Patienten empfohlen, bevor Lamisil Oral Granules (Terbinafinhydrochlorid) eingenommen wird. Patienten verschrieben Lamisil Oral Granules (Terbinafinhydrochlorid) und / oder ihre Erziehungsberechtigten sollten gewarnt werden, ihrem Arzt unverzüglich alle Symptome anhaltender Übelkeit zu melden, Magersucht, Müdigkeit, Erbrechen, Schmerzen oder Gelbsucht im rechten Oberbauch, dunkler Urin oder blasser Stuhl. Patienten mit diesen Symptomen sollten die Einnahme von Lamisil Oral Granules (Terbinafinhydrochlorid) abbrechen, und die Leberfunktion des Patienten sollte sofort bewertet werden.
Überwachung von Labortests
Vorbehandlung Serumtransaminase-Tests (ALT und AST) werden für alle Patienten empfohlen, bevor Lamisil Oral Granules (Terbinafinhydrochlorid) eingenommen wird.
Hämatologisch
In klinischen Studien wurde eine vorübergehende Abnahme der absoluten Lymphozytenzahlen (ALC) beobachtet. In placebokontrollierten Studien hatten 8/465 Probanden, die Lamisil-Tabletten (1,7%) und 3/137 Probanden, die Placebo erhielten (2,2%), einen ALC-Abfall auf unter 1000 / mm3 bei zwei oder mehr Gelegenheiten. Bei Patienten mit bekannter oder vermuteter Immunschwäche sollten Ärzte erwägen, das vollständige Blutbild zu überwachen, wenn die Behandlung sechs Wochen überschreitet. Fälle von schwerer Neutropenie wurden berichtet; Diese waren nach Absetzen von Terbinafin mit oder ohne unterstützende Therapie reversibel. Wenn klinische Anzeichen und Symptome auftreten, die auf eine Sekundärinfektion hinweisen, sollte ein vollständiges Blutbild erhalten werden. Wenn die Neutrophilenzahl ≤ 1.000 Zellen / mm beträgt3Lamisil Oral Granules (Terbinafinhydrochlorid) sollte abgesetzt und die unterstützende Behandlung begonnen werden.
Hautreaktionen
Nach dem Inverkehrbringen wurden Berichte über schwerwiegende Hautreaktionen (z.Stevens-Johnson-Syndrom und toxische epidermale Nekrolyse) mit oralem Terbinafin. Wenn ein fortschreitender Hautausschlag auftritt, sollte die Behandlung mit Lamisil Oral Granules (Terbinafinhydrochlorid) abgebrochen werden.
Nierenfunktion
Bei Patienten mit Nierenfunktionsstörung (Kreatinin-Clearance <50 ml / min) wurde die Verwendung von Lamisil Oral Granules nicht ausreichend untersucht.
Lupus Erythenatosus
Während der Erfahrung nach dem Inverkehrbringen wurde bei Patienten, die orales Terbinafin einnahmen, über Niederschläge und Exazerbationen des kutanen und systemischen Lupus erythematodes berichtet. Die Therapie sollte bei Patienten mit klinischen Anzeichen und Symptomen, die auf Lupus erythematodes hinweisen, abgebrochen werden.
Nichtklinische Toxikologie
Karzinogenese, Mutugenese, Beeinträchtigung der Fruchtbarkeit
In einer 28-monatigen oralen Kanzerogenitätsstudie an Ratten, Bei Männern wurde bei der höchsten getesteten Dosis ein Anstieg der Inzidenz von Lebertumoren beobachtet, 69 mg / kg / Tag (2x MRHD basierend auf AUC-Vergleichen des Eltern-Terbinafins) jedoch, obwohl bei der höchsten getesteten Dosis keine dosislimitierende Toxizität erreicht wurde, höhere Dosen wurden nicht getestet.
Die Ergebnisse einer Vielzahl von in vitro (Mutationen in > E. coli und S. typhimuriumDNA-Reparatur in Rattenhepatozyten, Mutagenität in chinesischen Hamsterfibroblasten, Chromosomenaberration und Schwesterchromatidaustausch in Lungenzellen des chinesischen Hamsters) und in vivo (Chromosomenaberration in chinesischen Hamstern, Mikronukleus-Test in Mäusen) Genotoxizitätstests ergaben keine Hinweise auf ein mutagenes oder klastogenes Potential. Orale Reproduktionsstudien an Ratten in Dosen von bis zu 300 mg / kg / Tag (ungefähr das 12-fache der MRHD basierend auf BSA-Vergleichen) ergaben keine spezifischen Auswirkungen auf die Fruchtbarkeit oder andere Reproduktionsparameter. Die intravaginale Anwendung von Terbinafinhydrochlorid bei trächtigen Kaninchen mit 150 mg / Tag erhöhte weder die Inzidenz von Abtreibungen oder vorzeitigen Lieferungen noch beeinflusste sie die fetalen Parameter.
Verwendung in bestimmten Populationen
Schwangerschaft
Schwangerschaftskategorie B .
Orale Reproduktionsstudien wurden an Kaninchen und Ratten in Dosen von bis zu 300 mg / kg / Tag durchgeführt [12x bis 23x die maximal empfohlene Dosis für den Menschen (MRHD) bei Kaninchen und Ratten, beziehungsweise, basierend auf der Körperoberfläche (BSA) Vergleiche] und haben keine Hinweise auf eine beeinträchtigte Fruchtbarkeit oder eine Schädigung des Fötus durch Terbinafin ergeben. Es gibt jedoch keine angemessenen und gut kontrollierten Studien bei schwangeren Frauen. Da Tierreproduktionsstudien nicht immer die Reaktion des Menschen vorhersagen und die Behandlung der Onychomykose bis nach Abschluss der Schwangerschaft verschoben werden kann, wird empfohlen, Lamisil (Terbinafinhydrochlorid) Oral Granulate nicht während der Schwangerschaft zu beginnen.
Stillende Mütter
Nach oraler Verabreichung ist Terbinafin in der Muttermilch stillender Mütter enthalten. Das Verhältnis von Terbinafin in Milch zu Plasma beträgt 7: 1. Die Behandlung mit Lamisil Oral Granules (Terbinafinhydrochlorid) wird bei stillenden Müttern nicht empfohlen.
Pädiatrische Anwendung
Lamisil Oral Granules (Terbinafinhydrochlorid) wurde in zwei randomisierten untersucht, aktiv kontrollierte Studien, in denen 1021 Probanden mit einer durch KOH-Mikroskopie bestätigten klinischen Diagnose einer Tinea-Kapitis mit Lamisil Oral Granules behandelt wurden (Terbinafinhydrochlorid) bei der markierten Dosis für bis zu 6 Wochen. Die häufigsten unerwünschten Ereignisse waren Nasopharyngitis, Kopfschmerzen, Pyrexie, Husten, Erbrechen und Infektionen der oberen Atemwege.
Geriatrische Anwendung
Lamisil Oral Granules (Terbinafinhydrochlorid) wurde bei geriatrischen Patienten nicht untersucht.

SEITENWIRKUNGEN
Erfahrung in klinischen Studien
Weil klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, Nebenwirkungen in den klinischen Studien eines Arzneimittels können nicht direkt mit den Raten in den klinischen Studien eines anderen Arzneimittels verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Lamisil (Terbinafinhydrochlorid) Orales Granulat
Die nachstehend beschriebenen Daten spiegeln die Exposition gegenüber Terbinafin wider, einschließlich 1042 Probanden, die über einen Median von 42 Tagen exponiert wurden. Lamisil Oral Granules (Terbinafinhydrochlorid) wurde in 2 aktiv kontrollierten Studien untersucht (n = 1042). Die Bevölkerung bestand aus Kindern im Alter von 4 bis 12 Jahren, 64% Männern und 36% Frauen, 21% Kaukasiern, 47% Schwarzen und 32% anderen. Die Merkmale der Grundkrankheit (Dermatophyt) der Probanden umfassten 49% mit T. Monsurans15% T. violaceum15% M. canis2% M. audouiniiund 1% andere. Die Probanden erhielten 6 Wochen lang einmal täglich orale Dosen von Lamisil Oral Granules (Terbinafinhydrochlorid) basierend auf dem Körpergewicht: <25 kg 125 mg / Tag, 25-35 kg 187,5 mg / Tag und> 35 kg 250 mg / Tag. Unerwünschte Ereignisse, die in den beiden Studien gemeldet wurden, sind in der folgenden Tabelle aufgeführt.
Tabelle 2 Unerwünschte Ereignisse (≥ 1%) in den Tinea-Kapitis-Studien
| Lamisil® Orales Granulat (%) N = 1042 | Griseofulvin oral Suspension (%) N = 507 | |
| Nasopharyngitis | 10 | 11 |
| Kopfschmerzen | 7 | 8 |
| Pyrexie | 7 | 6 |
| Husten | 6 | 5 |
| Erbrechen | 5 | 5 |
| Infektion der oberen Atemwege | 5 | 5 |
| Oberbauchschmerzen | 4 | 4 |
| Durchfall | 3 | 4 |
| Influenza | 2 | 1 |
| Bauchschmerzen | 2 | 1 |
| Pharyngolaryngealer Schmerz | 2 | 2 |
| Übelkeit | 2 | 2 |
| Hautausschlag | 2 | 2 |
| Rhinorrhoe | 2 | 0 |
| Verstopfung der Nase | 2 | 1 |
| Pruritus | 1 | 1 |
| Zahnschmerzen | 1 | 1 |
In den gepoolten Zulassungsstudien traten bei 2% (17/1042) der Probanden in der Terbinafingruppe und 2% (6/507) in der Griseofulvin-Gruppe aufgrund unerwünschter Ereignisse ein Absetzen des Studienarzneimittels auf. Die häufigsten Kategorien von unerwünschten Ereignissen, die bei Patienten, die Terbinafin ausgesetzt waren, ein Absetzen verursachten, waren Magen-Darm-Störungen, Haut- und Unterhautstörungen sowie Infektionen und Befall.
In den gepoolten Zulassungsversuchen wurde kein ophthalmologisches Sicherheitssignal identifiziert. Zu den ophthalmologischen Bewertungen gehörten eine erweiterte Fundoskopie zur Beurteilung von refraktilen Körpern in der Netzhaut, eine Beurteilung der Sehschärfe und Farbsichttests. Von den 940 Probanden in der Terbinafingruppe und 471 Probanden in der Griseofulvin-Gruppe, die bei Nachbehandlungsbesuchen eine erweiterte Fundoskopie abgeschlossen hatten, hatte keine der Probanden zu Studienbeginn oder am Ende der Behandlung refraktile Körper der Netzhaut. Für Sehschärfe, 1% (11/837) von mit Terbinafin behandelten Probanden und 2% (7/426) von mit Griseofulvin behandelten Probanden zeigte nach 6-wöchiger Behandlung eine Verdoppelung des Sehwinkels, während 2% (15/837) behandelt mit Terbinafin und 3% (12/426) mit Griseofulvin behandelt, zeigte nach 6-wöchiger Behandlung eine Halbierung des Sehwinkels. Von Probanden, die eine gelb-blaue Farbsichtbewertung für erworbene Mängel abgeschlossen haben, 5% (13/262) von mit Terbinafin behandelten Probanden und 6% (8/129) Von mit Griseofulvin behandelten Probanden hatte in Woche 6 Farbverwirrung auf mehr als einem Symbol als zu Studienbeginn, während 13% (33/262) von mit Terbinafin behandelten Probanden und 13% (17/129) von mit Griseofulvin behandelten Probanden identifizierten in Woche 6 mehr Symbole korrekt als zu Studienbeginn.
Lamisil-Tabletten (Terbinafinhydrochlorid)
Unerwünschte Ereignisse, die in drei placebokontrollierten Studien in den USA / Kanada gemeldet wurden, waren Durchfall (6%), Hautausschläge (6%), Dyspepsie (4%), Übelkeit (3%), Leberanomalien (3%) und Juckreiz (3%). Geschmacksstörungen (3%), Bauchschmerzen (2%) und Urtikaria (1%).
Veränderungen der Augenlinse und der Netzhaut wurden nach der Verwendung von Lamisil-Tabletten in klinischen Studien bei erwachsenen Probanden mit Onychomykose berichtet. Die klinische Bedeutung dieser Veränderungen ist unbekannt.
Postmarketing-Erfahrung
Die folgenden unerwünschten Ereignisse wurden bei der Anwendung von Lamisil nach der Zulassung festgestellt. Da diese Ereignisse freiwillig von einer Population ungewisser Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Exposition gegenüber Arzneimitteln herzustellen.
Unerwünschte Ereignisse, die bei oraler Anwendung von Terbinafin berichtet wurden, umfassen: eigenwillige und symptomatische Leberschäden und, Fälle von Leberversagen, Einige führen zum Tod oder zur Lebertransplantation, schwerwiegende Hautreaktionen, schwere Neutropenie, Thrombozytopenie, Agranulozytose, Panzytopenie, Anämie, Angioödem und allergische Reaktionen (einschließlich Anaphylaxie).
Es wurde über Psoriasiformausbrüche oder eine Verschlimmerung der Psoriasis, akute generalisierte exanthematische Pustulose und Ausfällung sowie eine Verschlimmerung des kutanen und systemischen Lupus erythematodes berichtet. Orales Terbinafin kann Geschmacksstörungen (einschließlich Geschmacksverlust) verursachen, die sich normalerweise innerhalb einiger Wochen nach Absetzen des Arzneimittels erholen. Es wurde über eine anhaltende (größere als ein Jahr) Geschmacksstörung berichtet. Es wurde berichtet, dass Geschmacksstörungen schwerwiegend genug sind, um zu einer verringerten Nahrungsaufnahme zu führen, was zu einem signifikanten und unerwünschten Gewichtsverlust führt.
Andere Nebenwirkungen, über die berichtet wurde, sind Unwohlsein, Müdigkeit, Arthralgie, Myalgie, Erbrechen, akute Pankreatitis, Rhabdomyolyse, verminderte Sehschärfe, Gesichtsfeldfehler und Haarausfall. Unerwünschte Ereignisse, die seit der Vermarktung des Arzneimittels spontan gemeldet wurden, umfassen eine veränderte Prothrombinzeit (Verlängerung und Reduktion) bei Patienten, die gleichzeitig mit Warfarin behandelt wurden.
Drogeninteraktionen
Arzneimittel-Arzneimittel-Wechselwirkungen
In vivo Studien haben gezeigt, dass Terbinafin ein Inhibitor des CYP450 2D6-Isozyms ist. Arzneimittel, die überwiegend durch das CYP450 2D6-Isozyme metabolisiert werden, umfassen die folgenden Arzneimittelklassen: trizyklische Antidepressiva, selektive Serotonin-Wiederaufnahmehemmer, Betablocker, Antiarrhythmika der Klasse 1C (z., Flecainid und Propafenon) und Monoaminoxidasehemmer Typ B. Die gleichzeitige Anwendung von Lamisil (Terbinafinhydrochlorid) Oral Granulat sollte mit sorgfältiger Überwachung erfolgen und erfordert möglicherweise eine Dosisreduktion des 2D6-metabolisierten Arzneimittels. In einer Studie zur Bewertung der Auswirkungen von Terbinafin auf Desipramin bei gesunden Probanden, die als normale Metabolisierer charakterisiert sind, Die Verabreichung von Terbinafin führte zu einem zweifachen Anstieg der Cmax und einem 5-fachen Anstieg der AUC. In dieser Studie, Es wurde gezeigt, dass diese Effekte bei der letzten Beobachtung 4 Wochen nach Absetzen von Lamisil bestehen bleiben. In Studien an gesunden Probanden, die als ausgedehnte Metabolisierer von Dextromethorphan charakterisiert sind, erhöht Terbinafin das Dextromethorphan / Dextrorphan-Metabolitenverhältnis im Urin im Durchschnitt um das 16- bis 97-fache. In vitro Studien mit menschlichen Lebermikrosomen zeigten, dass Terbinafin den Metabolismus von Tolbutamid, Ethinylestradiol, Ethoxycumarin, Cyclosporin, Cisaprid und Fluvastatin nicht hemmt.
In vivo Arzneimittel-Arzneimittel-Wechselwirkungsstudien an gesunden Freiwilligen zeigten, dass Terbinafin die Clearance von Antipyrin oder Digoxin nicht beeinflusst. Terbinafin verringert die Clearance von Koffein um 19%. Terbinafin erhöht die Clearance von Cyclosporin um 15%.
Der Einfluss von Terbinafin auf die Pharmakokinetik von Fluconazol, Trimethoprim, Sulfamethoxazol, Zidovudin oder Theophyllin wurde als klinisch nicht signifikant angesehen.
Die gleichzeitige Anwendung einer Einzeldosis Fluconazol (100 mg) mit einer Einzeldosis Terbinafin führte zu einem Anstieg der Terbinafin-Cmax bzw. AUC um 52% bzw. 69%. Fluconazol ist ein Inhibitor der Enzyme CYP 2C9 und CYP 3A. Basierend auf diesem Befund ist es wahrscheinlich, dass andere Inhibitoren sowohl von CYP2C9 als auch von CYP3A4 (z.Ketoconazol, Amiodaron) kann auch zu einem erheblichen Anstieg der systemischen Exposition (Cmax und AUC) von Terbinafin führen.
Es gab spontane Berichte über eine Zunahme oder Abnahme der Prothrombinzeiten bei Patienten, die gleichzeitig orales Terbinafin und Warfarin einnahmen. Ein kausaler Zusammenhang zwischen Lamisil-Tabletten und diesen Veränderungen wurde jedoch nicht festgestellt.
Die Terbinafin-Clearance wird durch Rifampin, einen CYP450-Enzyminduktor, um 100% erhöht und durch Cimetidin, einen CYP450-Enzyminhibitor, um 33% verringert. Die Terbinafin-Clearance wird von Cyclosporin nicht beeinflusst. Aus angemessenen Arzneimittel-Arzneimittel-Wechselwirkungsstudien mit den folgenden Arzneimittelklassen liegen keine Informationen vor: orale Kontrazeptiva, Hormonersatztherapien, Hypoglykämika, Phenytoine, Thiaziddiuretika und Kalziumkanalblocker.
Lebensmittelwechselwirkungen
Eine Bewertung der Wirkung von Lebensmitteln auf Lamisil (Terbinafinhydrochlorid) Oral Granulat wurde nicht durchgeführt. In den klinischen Studien wurde Lamisil (Terbinafinhydrochlorid) Oral Granulat jedoch zusammen mit Lebensmitteln verabreicht.

Schwangerschaftskategorie B .
Orale Reproduktionsstudien wurden an Kaninchen und Ratten in Dosen von bis zu 300 mg / kg / Tag durchgeführt [12x bis 23x die maximal empfohlene Dosis für den Menschen (MRHD) bei Kaninchen und Ratten, beziehungsweise, basierend auf der Körperoberfläche (BSA) Vergleiche] und haben keine Hinweise auf eine beeinträchtigte Fruchtbarkeit oder eine Schädigung des Fötus durch Terbinafin ergeben. Es gibt jedoch keine angemessenen und gut kontrollierten Studien bei schwangeren Frauen. Da Tierreproduktionsstudien nicht immer die Reaktion des Menschen vorhersagen und die Behandlung der Onychomykose bis nach Abschluss der Schwangerschaft verschoben werden kann, wird empfohlen, Lamisil (Terbinafinhydrochlorid) Oral Granulate nicht während der Schwangerschaft zu beginnen.

Erfahrung in klinischen Studien
Weil klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, Nebenwirkungen in den klinischen Studien eines Arzneimittels können nicht direkt mit den Raten in den klinischen Studien eines anderen Arzneimittels verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Lamisil (Terbinafinhydrochlorid) Orales Granulat
Die nachstehend beschriebenen Daten spiegeln die Exposition gegenüber Terbinafin wider, einschließlich 1042 Probanden, die über einen Median von 42 Tagen exponiert wurden. Lamisil Oral Granules (Terbinafinhydrochlorid) wurde in 2 aktiv kontrollierten Studien untersucht (n = 1042). Die Bevölkerung bestand aus Kindern im Alter von 4 bis 12 Jahren, 64% Männern und 36% Frauen, 21% Kaukasiern, 47% Schwarzen und 32% anderen. Die Merkmale der Grundkrankheit (Dermatophyt) der Probanden umfassten 49% mit T. Monsurans15% T. violaceum15% M. canis2% M. audouiniiund 1% andere. Die Probanden erhielten 6 Wochen lang einmal täglich orale Dosen von Lamisil Oral Granules (Terbinafinhydrochlorid) basierend auf dem Körpergewicht: <25 kg 125 mg / Tag, 25-35 kg 187,5 mg / Tag und> 35 kg 250 mg / Tag. Unerwünschte Ereignisse, die in den beiden Studien gemeldet wurden, sind in der folgenden Tabelle aufgeführt.
Tabelle 2 Unerwünschte Ereignisse (≥ 1%) in den Tinea-Kapitis-Studien
| Lamisil® Orales Granulat (%) N = 1042 | Griseofulvin oral Suspension (%) N = 507 | |
| Nasopharyngitis | 10 | 11 |
| Kopfschmerzen | 7 | 8 |
| Pyrexie | 7 | 6 |
| Husten | 6 | 5 |
| Erbrechen | 5 | 5 |
| Infektion der oberen Atemwege | 5 | 5 |
| Oberbauchschmerzen | 4 | 4 |
| Durchfall | 3 | 4 |
| Influenza | 2 | 1 |
| Bauchschmerzen | 2 | 1 |
| Pharyngolaryngealer Schmerz | 2 | 2 |
| Übelkeit | 2 | 2 |
| Hautausschlag | 2 | 2 |
| Rhinorrhoe | 2 | 0 |
| Verstopfung der Nase | 2 | 1 |
| Pruritus | 1 | 1 |
| Zahnschmerzen | 1 | 1 |
In den gepoolten Zulassungsstudien traten bei 2% (17/1042) der Probanden in der Terbinafingruppe und 2% (6/507) in der Griseofulvin-Gruppe aufgrund unerwünschter Ereignisse ein Absetzen des Studienarzneimittels auf. Die häufigsten Kategorien von unerwünschten Ereignissen, die bei Patienten, die Terbinafin ausgesetzt waren, ein Absetzen verursachten, waren Magen-Darm-Störungen, Haut- und Unterhautstörungen sowie Infektionen und Befall.
In den gepoolten Zulassungsversuchen wurde kein ophthalmologisches Sicherheitssignal identifiziert. Zu den ophthalmologischen Bewertungen gehörten eine erweiterte Fundoskopie zur Beurteilung von refraktilen Körpern in der Netzhaut, eine Beurteilung der Sehschärfe und Farbsichttests. Von den 940 Probanden in der Terbinafingruppe und 471 Probanden in der Griseofulvin-Gruppe, die bei Nachbehandlungsbesuchen eine erweiterte Fundoskopie abgeschlossen hatten, hatte keine der Probanden zu Studienbeginn oder am Ende der Behandlung refraktile Körper der Netzhaut. Für Sehschärfe, 1% (11/837) von mit Terbinafin behandelten Probanden und 2% (7/426) von mit Griseofulvin behandelten Probanden zeigte nach 6-wöchiger Behandlung eine Verdoppelung des Sehwinkels, während 2% (15/837) behandelt mit Terbinafin und 3% (12/426) mit Griseofulvin behandelt, zeigte nach 6-wöchiger Behandlung eine Halbierung des Sehwinkels. Von Probanden, die eine gelb-blaue Farbsichtbewertung für erworbene Mängel abgeschlossen haben, 5% (13/262) von mit Terbinafin behandelten Probanden und 6% (8/129) Von mit Griseofulvin behandelten Probanden hatte in Woche 6 Farbverwirrung auf mehr als einem Symbol als zu Studienbeginn, während 13% (33/262) von mit Terbinafin behandelten Probanden und 13% (17/129) von mit Griseofulvin behandelten Probanden identifizierten in Woche 6 mehr Symbole korrekt als zu Studienbeginn.
Lamisil-Tabletten (Terbinafinhydrochlorid)
Unerwünschte Ereignisse, die in drei placebokontrollierten Studien in den USA / Kanada gemeldet wurden, waren Durchfall (6%), Hautausschläge (6%), Dyspepsie (4%), Übelkeit (3%), Leberanomalien (3%) und Juckreiz (3%). Geschmacksstörungen (3%), Bauchschmerzen (2%) und Urtikaria (1%).
Veränderungen der Augenlinse und der Netzhaut wurden nach der Verwendung von Lamisil-Tabletten in klinischen Studien bei erwachsenen Probanden mit Onychomykose berichtet. Die klinische Bedeutung dieser Veränderungen ist unbekannt.
Postmarketing-Erfahrung
Die folgenden unerwünschten Ereignisse wurden bei der Anwendung von Lamisil nach der Zulassung festgestellt. Da diese Ereignisse freiwillig von einer Population ungewisser Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Exposition gegenüber Arzneimitteln herzustellen.
Unerwünschte Ereignisse, die bei oraler Anwendung von Terbinafin berichtet wurden, umfassen: eigenwillige und symptomatische Leberschäden und, Fälle von Leberversagen, Einige führen zum Tod oder zur Lebertransplantation, schwerwiegende Hautreaktionen, schwere Neutropenie, Thrombozytopenie, Agranulozytose, Panzytopenie, Anämie, Angioödem und allergische Reaktionen (einschließlich Anaphylaxie).
Es wurde über Psoriasiformausbrüche oder eine Verschlimmerung der Psoriasis, akute generalisierte exanthematische Pustulose und Ausfällung sowie eine Verschlimmerung des kutanen und systemischen Lupus erythematodes berichtet. Orales Terbinafin kann Geschmacksstörungen (einschließlich Geschmacksverlust) verursachen, die sich normalerweise innerhalb einiger Wochen nach Absetzen des Arzneimittels erholen. Es wurde über eine anhaltende (größere als ein Jahr) Geschmacksstörung berichtet. Es wurde berichtet, dass Geschmacksstörungen schwerwiegend genug sind, um zu einer verringerten Nahrungsaufnahme zu führen, was zu einem signifikanten und unerwünschten Gewichtsverlust führt.
Andere Nebenwirkungen, über die berichtet wurde, sind Unwohlsein, Müdigkeit, Arthralgie, Myalgie, Erbrechen, akute Pankreatitis, Rhabdomyolyse, verminderte Sehschärfe, Gesichtsfeldfehler und Haarausfall. Unerwünschte Ereignisse, die seit der Vermarktung des Arzneimittels spontan gemeldet wurden, umfassen eine veränderte Prothrombinzeit (Verlängerung und Reduktion) bei Patienten, die gleichzeitig mit Warfarin behandelt wurden.

Die klinische Erfahrung mit einer Überdosierung mit oralem Terbinafin ist begrenzt. Es wurde über Dosen von bis zu 5 Gramm bei Erwachsenen (20-fache der therapeutischen Tagesdosis für Erwachsene) berichtet, ohne dass schwerwiegende Nebenwirkungen hervorgerufen wurden. Die Symptome einer Überdosierung waren Übelkeit, Erbrechen, Bauchschmerzen, Schwindel, Hautausschlag, häufiges Wasserlassen und Kopfschmerzen.

Die Pharmakodynamik von Lamisil ® (Terbinafinhydrochlorid) Oral Granulat ist unbekannt.

Die Pharmakokinetik bei Kindern im Alter von 4 bis 8 Jahren mit Tinea capitis wurde in einer pharmakokinetischen Studie nach einmaliger und wiederholter Behandlung untersucht (für 42 Tage) orale Verabreichung von Lamisil Oral Granules (Terbinafinhydrochlorid) (N = 16) einmal täglich, unter Verwendung der in Abschnitt 2.2 beschriebenen Körpergewichtsgruppen und -dosen. Die systemische Exposition (Cmax und AUC0-24) von Terbinafin bei Kindern hatte eine relativ hohe interindividuelle Variabilität (zwischen 36% und 64%). Im stationären Zustand die AUC0-24 erhöht um einen mittleren Faktor von 1,9 bis 2,1 über Dosen hinweg. Die mittlere (SD) effektive Halbwertszeit, die aus der beobachteten Akkumulation erhalten wurde, betrug 26,7 (13,8) Stunden und 30,5 (9,3) Stunden für die Dosen von 125 mg bzw. 187,5 mg.
Die systemische Exposition gegenüber Terbinafin bei Kindern überschritt nicht die höchsten Werte der systemischen Exposition bei Erwachsenen, die wiederholt einmal täglich 250 mg Lamisil-Tabletten (Terbinafin) erhielten. Eine populationspharmakokinetische Bewertung von oralem Terbinafin, an der Kinder im Alter von 4 bis 12 Jahren und Erwachsene im Alter von 18 bis 45 Jahren teilnahmen (N = 113), ergab, dass die Clearance (CL / F) von Terbinafin nichtlinear vom Körpergewicht abhängt. Für ein typisches Kind von 25 kg CL / F wurde ein Körpergewicht von 19 l / h und für einen typischen Erwachsenen von 70 kg ein Körpergewicht von 27 l / h vorhergesagt. Über den in die Analyse einbezogenen Gewichtsbereich für pädiatrische Patienten (14,1 kg - 68 kg) lag der vorhergesagte CL / F zwischen 15,6 und 26,7 l / h. Im Plasma ist Terbinafin zu> 99% an Plasmaproteine gebunden. Vor der Ausscheidung wird Terbinafin durch mindestens sieben CYP-Isoenzyme mit Hauptbeiträgen aus CYP2C9, CYP1A2, CYP3A4, CYP2C8 und CYP2C19 schnell und umfassend metabolisiert. Es wurden keine Metaboliten identifiziert, die eine ähnliche antimykotische Aktivität wie Terbinafin aufweisen. Ungefähr 70% der verabreichten Dosis werden im Urin eliminiert. Bei erwachsenen Patienten mit Nierenfunktionsstörung (Kreatinin-Clearance ≤ 50 ml / min) oder Leberzirrhose ist die Clearance von Terbinafin im Vergleich zu normalen Freiwilligen um etwa 50% verringert.



