



Kompozisyon:
Uygulama:
Tedavide kullanılır:
Oliinyk Elizabeth Ivanovna tarafından tıbbi olarak gözden geçirilmiştir, Eczane Son güncelleme: 29.03.2022

Dikkat! Sayfadaki bilgiler sadece sağlık profesyonelleri içindir! Bilgi kamu kaynaklarında toplanır ve anlamlı hatalar içerebilir! Dikkatli olun ve bu sayfadaki tüm bilgileri tekrar kontrol edin!


Dozaj Formları ve Güçlü Yönleri
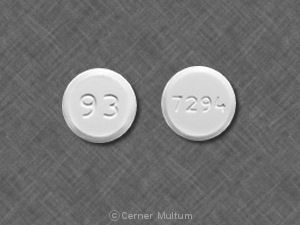
Tablet, 250 mg beyaz ila sarı renkli beyaz dairesel, iki konveks, “LAMISIL” ile dairesel formda beveled tabletler yan ve diğer tarafta “250” kodu.
Depolama ve Taşıma
Lamisil Tabletler beyaz ila sarı renkli olarak tedarik edilir 250 mg terbinafin içeren beyaz dairesel, iki konveks, eğimli tabletler bir tarafta dairesel formda “LAMISIL” ve üzerinde “250” kodu ile basılmıştır diğer.
100 tablet şişeler NDC 0078-0179-05
30 tabletlik şişeler NDC 0078-0179-15
Lamisil Tabletleri 25 ° C'nin (77 ° F) altında saklayın; sıkıca konteyner. Işıktan koruyun.
Dağıtımı: Novartis Pharmaceuticals Corporation East Hannover, New Jersey 07936. Gözden geçirilmiş: Haziran / 2013

Lamisil (terbinafin hidroklorür) Tabletler endikedir nedeniyle ayak tırnağı veya tırnak onikomikozunun tedavisi için dermatofitler (tinea unguium).
Tedaviye başlamadan önce uygun tırnak örnekleri laboratuvar testi için [potasyum hidroksit (KOH) preparatı, mantar kültürü, veya tırnak biyopsisi] onikomikoz tanısını doğrulamak için alınmalıdır.

Tırnak onikomikozu: Günde bir kez 250 mg tablet 6 hafta boyunca.
Ayak tırnağı onikomikozu: Günde bir kez 250 mg tablet 12 hafta.
Optimal klinik etki birkaç ay sonra görülür mikolojik tedavi ve tedavinin kesilmesi. Bu dönemle ilgilidir sağlıklı çivinin büyümesi için gereklidir.

Lamisil (terbinafin hidroklorür) Oral Granüller, anafilaksi riski nedeniyle oral terbinafine alerjik reaksiyon öyküsü olan bireylerde kontrendikedir.

UYARILAR
Bir parçası olarak dahil ÖNLEMLER Bölüm.
ÖNLEMLER
Hepatotoksisite
Bazıları ölüme veya karaciğer nakline yol açan karaciğer yetmezliği vakaları, önceden karaciğer hastalığı olan ve olmayan bireylerde pazarlama sonrası deneyim sırasında oral terbinafin kullanımı ile meydana gelmiştir. Bildirilen karaciğer vakalarının çoğunda, hastalarda altta yatan ciddi sistemik durumlar vardı. Aktif veya kronik karaciğer hastalığı olan hastalarda hepatik olayların şiddeti ve / veya sonuçları daha kötü olabilir. Karaciğer hasarının biyokimyasal veya klinik kanıtı gelişirse Lamisil Oral Granüllerle (terbinafin hidroklorür) tedavi kesilmelidir.
Lamisil Oral Granüller (terbinafin hidroklorür) kronik veya aktif karaciğer hastalığı olan hastalar için önerilmez. Lamisil Oral Granülleri (terbinafin hidroklorür) reçete etmeden önce, önceden var olan karaciğer hastalığı değerlendirilmelidir. Önceden karaciğer hastalığı olan ve olmayan hastalarda hepatotoksisite oluşabilir. Lamisil Oral Granülleri (terbinafin hidroklorür) almadan önce tüm hastalar için ön tedavi serum transaminaz (ALT ve AST) testleri önerilmektedir. Hastalara Lamisil Oral Granül reçete edildi (terbinafin hidroklorür) ve / veya velileri, kalıcı bulantı belirtilerini derhal doktorlarına bildirmeleri konusunda uyarılmalıdır, anoreksiya, yorgunluk, kusma, sağ üst karın ağrısı veya sarılık, koyu idrar veya soluk dışkı. Bu semptomları olan hastalar Lamisil Oral Granülleri (terbinafin hidroklorür) almayı bırakmalı ve hastanın karaciğer fonksiyonu derhal değerlendirilmelidir.
Laboratuvar Testlerini İzleme
Lamisil Oral Granülleri (terbinafin hidroklorür) almadan önce tüm hastalar için ön tedavi serum transaminaz (ALT ve AST) testleri önerilmektedir.
Hematolojik
Klinik çalışmalarda mutlak lenfosit sayısında (ALC) geçici düşüşler gözlenmiştir. Plasebo kontrollü çalışmalarda, Lamisil Tablet alan 8/465 denek (% 1.7) ve plasebo alan 3/137 denek (% 2.2) ALC'de 1000 / mm'nin altına düşmüştür3 iki veya daha fazla kez. Bağışıklık yetersizliği bilinen veya şüphelenilen hastalarda, tedavi altı haftayı aşacaksa doktorlar tam kan sayımlarını izlemeyi düşünmelidir. Şiddetli nötropeni vakaları bildirilmiştir; bunlar destekleyici tedavi olsun veya olmasın terbinafinin kesilmesiyle geri dönüşümlüdür. İkincil enfeksiyonu düşündüren klinik belirti ve semptomlar ortaya çıkarsa, tam bir kan sayımı elde edilmelidir. Nötrofil sayısı ≤ 1.000 hücre / mm ise3, Lamisil Oral Granülleri (terbinafin hidroklorür) kesilmeli ve destekleyici yönetim başlatılmalıdır.
Cilt Reaksiyonları
Ciddi cilt reaksiyonları hakkında pazarlama sonrası raporlar bulunmaktadır (ör., Stevens-Johnson Sendromu ve toksik epidermal nekroliz) oral terbinafin ile. Progresif deri döküntüsü meydana gelirse, Lamisil Oral Granül (terbinafin hidroklorür) ile tedavi kesilmelidir.
Böbrek fonksiyonu
Böbrek yetmezliği olan hastalarda (kreatinin klerensi <50 mL / dak), Lamisil Oral Granüllerin kullanımı yeterince araştırılmamıştır.
Lupus Erythenatosus
Pazarlama sonrası deneyim sırasında, oral terbinafin alan hastalarda kutanöz ve sistemik lupus eritematozusun çökelmesi ve alevlenmesi bildirilmiştir. Lupus eritematozusu düşündüren klinik belirti ve semptomları olan hastalarda tedavi kesilmelidir.
Klinik Olmayan Toksikoloji
Kanserojenez, Mutugenesis, Doğurganlığın Bozukluğu
Sıçanlarda yapılan 28 aylık oral karsinojenite çalışmasında, test edilen en yüksek dozda erkeklerde karaciğer tümörü insidansında bir artış gözlenmiştir, 69 mg / kg / gün (2x MRHD, ana terbinafinin AUC karşılaştırmalarına dayanır) ancak, test edilen en yüksek dozda doz sınırlayıcı toksisite elde edilemese de, daha yüksek dozlar test edilmedi.
Çeşitli sonuçları in vitro (mutasyonlar > E. coli ve S. typhimuriumsıçan hepatositlerinde DNA onarımı, Çin hamster fibroblastlarında mutajenite, Çin hamster akciğer hücrelerinde kromozom sapması ve kardeş kromatid değişimleri) ve in vivo (Çin hamsterlarında kromozom sapması, farelerde mikronükleus testi) genotoksisite testleri mutajenik veya klastojenik bir potansiyel kanıtı vermedi. Sıçanlarda 300 mg / kg / güne kadar dozlarda (BSA karşılaştırmalarına dayanan MRHD'nin yaklaşık 12 katı) oral üreme çalışmaları, doğurganlık veya diğer üreme parametreleri üzerinde herhangi bir spesifik etki ortaya koymamıştır. Hamile tavşanlarda 150 mg / gün terbinafin hidroklorürün intravajinal uygulaması, kürtaj veya erken doğum insidansını arttırmadı veya fetal parametreleri etkilemedi.
Belirli Popülasyonlarda Kullanın
Gebelik
Gebelik Kategorisi B .
Oral üreme çalışmaları tavşanlarda ve sıçanlarda 300 mg / kg / güne kadar dozlarda gerçekleştirilmiştir [Önerilen Maksimum İnsan Dozunun 12x ila 23x'i (MRHD) tavşan ve sıçanlarda, sırasıyla, vücut yüzey alanına göre (BSA) karşılaştırmalar] ve terbinafin nedeniyle doğurganlıkta bozulma veya fetüse zarar verdiğine dair bir kanıt ortaya koymamıştır. Bununla birlikte, hamile kadınlarda yeterli ve iyi kontrol edilen bir çalışma yoktur. Hayvan üreme çalışmaları her zaman insan tepkisini öngörmediği ve onikomikoz tedavisi hamilelik tamamlanana kadar ertelenebildiğinden, Lamisil (terbinafin hidroklorür) Oral Granüllerin hamilelik sırasında başlatılmaması önerilir.
Hemşirelik Anneler
Oral uygulamadan sonra emziren annelerin anne sütünde terbinafin bulunur. Sütteki terbinafinin plazmaya oranı 7: 1'dir. Emziren annelerde Lamisil Oral Granül (terbinafin hidroklorür) ile tedavi önerilmez.
Pediatrik Kullanım
Lamisil Oral Granülleri (terbinafin hidroklorür) iki randomize olarak incelenmiştir, KOH mikroskopisi ile doğrulanan tinea kapitin klinik tanısı olan 1021 deneğin Lamisil Oral Granülleri ile tedavi edildiği aktif kontrollü çalışmalar (terbinafin hidroklorür) etiketli dozda 6 haftaya kadar. En yaygın advers olaylar nazofarenjit, baş ağrısı, pireksi, öksürük, kusma ve üst solunum yolu enfeksiyonu idi.
Geriatrik Kullanım
Geriatrik hastalarda Lamisil Oral Granüller (terbinafin hidroklorür) çalışılmamıştır.

YAN ETKİLER
Klinik Çalışmalar Deneyimi
Çünkü klinik araştırmalar çok çeşitli koşullar altında yürütülmektedir, bir ilacın klinik çalışmalarındaki advers reaksiyon oranları, başka bir ilacın klinik çalışmalarındaki oranlarla doğrudan karşılaştırılamaz ve uygulamada gözlemlenen oranları yansıtmayabilir.
Lamisil (terbinafin hidroklorür) Oral Granüller
Aşağıda açıklanan veriler, 42 günlük bir medyan için maruz kalan 1042 denek dahil olmak üzere terbinafine maruz kalmayı yansıtmaktadır. Lamisil Oral Granüller (terbinafin hidroklorür) 2 aktif kontrollü çalışmada (n = 1042) incelenmiştir. Nüfus 4 ila 12 yaş arası çocuklar,% 64 erkek ve% 36 kadın,% 21 Kafkas,% 47 Siyah,% 32 Diğer çocuklardı. Deneklerin başlangıç hastalığı (dermatofit) özellikleri% 49'dur T. bademcikler,% 15 T. violaceum,% 15 M. canis,% 2 M. audouiniive% 1 diğerleri. Vücut ağırlığına göre günde bir kez, 6 hafta boyunca alınan oral dozlarda Lamisil Oral Granül (terbinafin hidroklorür): <25kg 125 mg / gün, 25-35kg 187.5 mg / gün ve> 35kg 250 mg / gün. 2 denemede bildirilen advers olaylar aşağıdaki tabloda listelenmiştir.
Tablo 2 Tinea Capitis Denemelerinde Olumsuz Olaylar (≥% 1)
| Lamisil® Oral Granüller (%) N = 1042 | Griseofulvin oral süspansiyon (%) N = 507 | |
| Nazofarenjit | 10 | 11 |
| Baş ağrısı | 7 | 8 |
| Pyrexia | 7 | 6 |
| Öksürük | 6 | 5 |
| Kusma | 5 | 5 |
| Üst solunum yolu enfeksiyonu | 5 | 5 |
| Üst karın ağrısı | 4 | 4 |
| İshal | 3 | 4 |
| Grip | 2 | 1 |
| Karın ağrısı | 2 | 1 |
| Faringolaringeal ağrı | 2 | 2 |
| Bulantı | 2 | 2 |
| Döküntü | 2 | 2 |
| Rinore | 2 | 0 |
| Burun tıkanıklığı | 2 | 1 |
| Kaşıntı | 1 | 1 |
| Diş ağrısı | 1 | 1 |
Toplanan önemli çalışmalarda, terbinafin grubundaki deneklerin% 2'si (17/1042) ve griseofulvin grubundaki deneklerin% 2'si (6/507), advers olaylar nedeniyle çalışma ilacının kesilmesine maruz kalmıştır. Terbinafine maruz kalanlarda kesilmeye neden olan en yaygın advers olay kategorileri gastrointestinal bozukluklar, cilt ve deri altı bozukluklar ve enfeksiyonlar ve istilaları içermektedir.
Toplanan önemli çalışmalarda oftalmolojik güvenlik sinyali tanımlanmadı. Oftalmolojik değerlendirmeler, retinadaki refraktil cisimleri, görme keskinliği değerlendirmesini ve renk görme testini değerlendirmek için dilate fonoskopiyi içeriyordu. Terbinafin grubundaki 940 denek ve griseofulvin grubundaki tedavi sonrası ziyaretlerde dilate fonoskopiyi tamamlayan 471 denekten hiçbirinin başlangıçta veya tedavinin sonunda retina refraktil gövdelerine sahip olmadığı bulunmuştur. Görme keskinliği için, % 1 (11/837) terbinafin ile tedavi edilen deneklerin% 2'si (7/426) griseofulvin ile tedavi edilen deneklerin 6 haftalık tedaviden sonra görme açısının iki katına çıktığını gösterdi, % 2 iken (15/837) terbinafin ve% 3 ile tedavi edildi (12/426) griseofulvin ile tedavi edilen 6 haftalık tedaviden sonra görme açısının yarıya indiğini gösterdi. Edinilmiş kusurlar için sarı-mavi renk görme değerlendirmesini tamamlayan deneklerin, % 5 (13/262) terbinafin ile tedavi edilen deneklerin% 6'sı (8/129) griseofulvin ile tedavi edilen deneklerin 6. haftada taban çizgisinden daha fazla sembol üzerinde renk karışıklığı vardı, % 13 iken (33/262) terbinafin ile tedavi edilen deneklerin% 13'ü (17/129) griseofulvin ile tedavi edilen deneklerin 6. haftada başlangıçtan daha fazla sembol doğru tanımladılar.
Lamisil (terbinafin hidroklorür) Tabletler
ABD / Kanada plasebo kontrollü üç çalışmada bildirilen advers olaylar arasında ishal (% 6), döküntüler (% 6), dispepsi (% 4), bulantı (% 3), karaciğer anormallikleri (% 3), kaşıntı (% 3), tat bozuklukları (% 3), karın ağrısı (% 2) ve ürtiker (% 1).
Onikomikozlu yetişkin hastalarda klinik çalışmalarda Lamisil Tabletlerin kullanılmasının ardından oküler lens ve retina değişiklikleri bildirilmiştir. Bu değişikliklerin klinik önemi bilinmemektedir.
Pazarlama Sonrası Deneyim
Lamisil'in onay sonrası kullanımı sırasında aşağıdaki advers olaylar tespit edilmiştir. Bu olaylar, belirsiz büyüklükteki bir popülasyondan gönüllü olarak bildirildiğinden, sıklıklarını güvenilir bir şekilde tahmin etmek veya ilaca maruz kalma ile nedensel bir ilişki kurmak her zaman mümkün değildir.
Oral terbinafin kullanımı ile bildirilen advers olaylar şunlardır: idiyosenkratik ve semptomatik hepatik yaralanma ve, karaciğer yetmezliği vakaları, bazıları ölüm veya karaciğer nakline yol açar, ciddi cilt reaksiyonları, şiddetli nötropeni, trombositopeni, agranülositoz, pansitopeni, anemi, anjiyoödem ve alerjik reaksiyonlar (anafilaksi dahil).
Sedef hastalığı patlamaları veya sedef hastalığının alevlenmesi, akut genelleştirilmiş ekzanthematöz püstüloz ve kutanöz ve sistemik lupus eritematozusun çökelmesi ve alevlenmesi bildirilmiştir. Oral terbinafin, genellikle ilacın kesilmesinden sonraki birkaç hafta içinde iyileşen tat bozukluğuna (tat kaybı dahil) neden olabilir. Uzun süreli (bir yıldan fazla) tat bozukluğu raporları vardır. Tat bozukluklarının, gıda alımının azalmasına ve önemli ve istenmeyen kilo kaybına yol açacak kadar şiddetli olduğu bildirilmiştir.
Bildirilen diğer advers reaksiyonlar arasında halsizlik, yorgunluk, artralji, kas ağrısı, kusma, akut pankreatit, rabdomiyoliz, azalmış görme keskinliği, görme alanı kusurları ve saç dökülmesi bulunur. İlaç pazarlandığından beri kendiliğinden bildirilen advers olaylar arasında varfarin ile birlikte tedavi edilen hastalarda protrombin zamanı (uzama ve azalma) değişmektedir.
İLAÇ ETKİLEŞİMLERİ
İlaç-İlaç Etkileşimleri
İn vivo çalışmalar terbinafinin CYP450 2D6 izoziminin bir inhibitörü olduğunu göstermiştir. CYP450 2D6 izozimi tarafından ağırlıklı olarak metabolize edilen ilaçlar arasında aşağıdaki ilaç sınıfları bulunur: trisiklik antidepresanlar, seçici serotonin geri alım inhibitörleri, beta-blokerler, antiaritmik sınıf 1C (ör.flekainid ve propafenon) ve monoamin oksidaz inhibitörleri Tip B. Lamisil (terbinafin hidroklorür) Oral Granüllerin birlikte uygulanması dikkatli bir izleme ile yapılmalıdır ve 2D6 metabolize ilacın dozunda bir azalma gerektirebilir. Normal metabolizörler olarak karakterize edilen sağlıklı gönüllülerde terbinafinin desipramin üzerindeki etkilerini değerlendirmek için yapılan bir çalışmada, terbinafin uygulaması Cmax'ta 2 kat artış ve AUC'de 5 kat artış ile sonuçlandı. Bu çalışmada, bu etkilerin Lamisil'in kesilmesinden 4 hafta sonra son gözlemde devam ettiği gösterilmiştir. Dekstrometorfanın geniş metabolizörleri olarak karakterize edilen sağlıklı kişilerde yapılan çalışmalarda terbinafin, idrardaki dekstrometorfan / dekstrorfan metabolit oranını ortalama 16-97 kat arttırır. İn vitro insan karaciğer mikrozomları ile yapılan çalışmalar, terbinafinin tolbutamid, etinilestradiol, etoksikumarin, siklosporin, sisaprid ve fluvastatinin metabolizmasını inhibe etmediğini göstermiştir.
İn vivo sağlıklı gönüllü deneklerde yapılan ilaç-ilaç etkileşim çalışmaları, terbinafinin antipirin veya digoksinin klerensini etkilemediğini göstermiştir. Terbinafin kafeinin klerensini% 19 azaltır. Terbinafin, siklosporinin klerensini% 15 arttırır.
Terbinafinin flukonazol, trimetoprim, sülfametoksazol, zidovudin veya teofilin farmakokinetiği üzerindeki etkisinin klinik olarak anlamlı olduğu düşünülmemiştir.
Tek bir doz flukonazolün (100 mg) tek bir terbinafin dozu ile birlikte uygulanması, terbinafin Cmax ve AUC'de sırasıyla% 52 ve% 69 artış ile sonuçlandı. Flukonazol, CYP 2C9 ve CYP 3A enzimlerinin bir inhibitörüdür. Bu bulguya dayanarak, hem CYP2C9 hem de CYP3A4'ün diğer inhibitörlerinin (ör., ketokonazol, amiodaron) ayrıca terbinafinin sistemik maruziyetinde (Cmax ve AUC) önemli bir artışa yol açabilir.
Oral terbinafin ve warfarin alan hastalarda protrombin zamanlarında spontan artış veya azalma bildirilmiştir, ancak Lamisil Tabletler arasında nedensel bir ilişki kurulmamıştır ve bu değişiklikler belirlenmemiştir.
Terbinafin klerensi, bir CYP450 enzim indükleyicisi olan rifampin ile% 100 arttırılır ve bir CYP450 enzim inhibitörü olan simetidin ile% 33 azalır. Terbinafin klerensi siklosporinden etkilenmez. Aşağıdaki ilaç sınıflarıyla yeterli ilaç-ilaç etkileşim çalışmalarından bilgi bulunmamaktadır: oral kontraseptifler, hormon replasman tedavileri, hipoglisemikler, fenitoinler, tiazid diüretikleri ve kalsiyum kanal blokerleri.
Gıda Etkileşimleri
Yiyeceklerin Lamisil (terbinafin hidroklorür) Oral Granüller üzerindeki etkisinin değerlendirilmesi yapılmamıştır. Bununla birlikte, klinik çalışmalarda Lamisil (terbinafin hidroklorür) Oral Granüller gıda ile uygulanmıştır.

Gebelik Kategorisi B .
Oral üreme çalışmaları tavşanlarda ve sıçanlarda 300 mg / kg / güne kadar dozlarda gerçekleştirilmiştir [Önerilen Maksimum İnsan Dozunun 12x ila 23x'i (MRHD) tavşan ve sıçanlarda, sırasıyla, vücut yüzey alanına göre (BSA) karşılaştırmalar] ve terbinafin nedeniyle doğurganlıkta bozulma veya fetüse zarar verdiğine dair bir kanıt ortaya koymamıştır. Bununla birlikte, hamile kadınlarda yeterli ve iyi kontrol edilen bir çalışma yoktur. Hayvan üreme çalışmaları her zaman insan tepkisini öngörmediği ve onikomikoz tedavisi hamilelik tamamlanana kadar ertelenebildiğinden, Lamisil (terbinafin hidroklorür) Oral Granüllerin hamilelik sırasında başlatılmaması önerilir.

Klinik Çalışmalar Deneyimi
Çünkü klinik araştırmalar çok çeşitli koşullar altında yürütülmektedir, bir ilacın klinik çalışmalarındaki advers reaksiyon oranları, başka bir ilacın klinik çalışmalarındaki oranlarla doğrudan karşılaştırılamaz ve uygulamada gözlemlenen oranları yansıtmayabilir.
Lamisil (terbinafin hidroklorür) Oral Granüller
Aşağıda açıklanan veriler, 42 günlük bir medyan için maruz kalan 1042 denek dahil olmak üzere terbinafine maruz kalmayı yansıtmaktadır. Lamisil Oral Granüller (terbinafin hidroklorür) 2 aktif kontrollü çalışmada (n = 1042) incelenmiştir. Nüfus 4 ila 12 yaş arası çocuklar,% 64 erkek ve% 36 kadın,% 21 Kafkas,% 47 Siyah,% 32 Diğer çocuklardı. Deneklerin başlangıç hastalığı (dermatofit) özellikleri% 49'dur T. bademcikler,% 15 T. violaceum,% 15 M. canis,% 2 M. audouiniive% 1 diğerleri. Vücut ağırlığına göre günde bir kez, 6 hafta boyunca alınan oral dozlarda Lamisil Oral Granül (terbinafin hidroklorür): <25kg 125 mg / gün, 25-35kg 187.5 mg / gün ve> 35kg 250 mg / gün. 2 denemede bildirilen advers olaylar aşağıdaki tabloda listelenmiştir.
Tablo 2 Tinea Capitis Denemelerinde Olumsuz Olaylar (≥% 1)
| Lamisil® Oral Granüller (%) N = 1042 | Griseofulvin oral süspansiyon (%) N = 507 | |
| Nazofarenjit | 10 | 11 |
| Baş ağrısı | 7 | 8 |
| Pyrexia | 7 | 6 |
| Öksürük | 6 | 5 |
| Kusma | 5 | 5 |
| Üst solunum yolu enfeksiyonu | 5 | 5 |
| Üst karın ağrısı | 4 | 4 |
| İshal | 3 | 4 |
| Grip | 2 | 1 |
| Karın ağrısı | 2 | 1 |
| Faringolaringeal ağrı | 2 | 2 |
| Bulantı | 2 | 2 |
| Döküntü | 2 | 2 |
| Rinore | 2 | 0 |
| Burun tıkanıklığı | 2 | 1 |
| Kaşıntı | 1 | 1 |
| Diş ağrısı | 1 | 1 |
Toplanan önemli çalışmalarda, terbinafin grubundaki deneklerin% 2'si (17/1042) ve griseofulvin grubundaki deneklerin% 2'si (6/507), advers olaylar nedeniyle çalışma ilacının kesilmesine maruz kalmıştır. Terbinafine maruz kalanlarda kesilmeye neden olan en yaygın advers olay kategorileri gastrointestinal bozukluklar, cilt ve deri altı bozukluklar ve enfeksiyonlar ve istilaları içermektedir.
Toplanan önemli çalışmalarda oftalmolojik güvenlik sinyali tanımlanmadı. Oftalmolojik değerlendirmeler, retinadaki refraktil cisimleri, görme keskinliği değerlendirmesini ve renk görme testini değerlendirmek için dilate fonoskopiyi içeriyordu. Terbinafin grubundaki 940 denek ve griseofulvin grubundaki tedavi sonrası ziyaretlerde dilate fonoskopiyi tamamlayan 471 denekten hiçbirinin başlangıçta veya tedavinin sonunda retina refraktil gövdelerine sahip olmadığı bulunmuştur. Görme keskinliği için, % 1 (11/837) terbinafin ile tedavi edilen deneklerin% 2'si (7/426) griseofulvin ile tedavi edilen deneklerin 6 haftalık tedaviden sonra görme açısının iki katına çıktığını gösterdi, % 2 iken (15/837) terbinafin ve% 3 ile tedavi edildi (12/426) griseofulvin ile tedavi edilen 6 haftalık tedaviden sonra görme açısının yarıya indiğini gösterdi. Edinilmiş kusurlar için sarı-mavi renk görme değerlendirmesini tamamlayan deneklerin, % 5 (13/262) terbinafin ile tedavi edilen deneklerin% 6'sı (8/129) griseofulvin ile tedavi edilen deneklerin 6. haftada taban çizgisinden daha fazla sembol üzerinde renk karışıklığı vardı, % 13 iken (33/262) terbinafin ile tedavi edilen deneklerin% 13'ü (17/129) griseofulvin ile tedavi edilen deneklerin 6. haftada başlangıçtan daha fazla sembol doğru tanımladılar.
Lamisil (terbinafin hidroklorür) Tabletler
ABD / Kanada plasebo kontrollü üç çalışmada bildirilen advers olaylar arasında ishal (% 6), döküntüler (% 6), dispepsi (% 4), bulantı (% 3), karaciğer anormallikleri (% 3), kaşıntı (% 3), tat bozuklukları (% 3), karın ağrısı (% 2) ve ürtiker (% 1).
Onikomikozlu yetişkin hastalarda klinik çalışmalarda Lamisil Tabletlerin kullanılmasının ardından oküler lens ve retina değişiklikleri bildirilmiştir. Bu değişikliklerin klinik önemi bilinmemektedir.
Pazarlama Sonrası Deneyim
Lamisil'in onay sonrası kullanımı sırasında aşağıdaki advers olaylar tespit edilmiştir. Bu olaylar, belirsiz büyüklükteki bir popülasyondan gönüllü olarak bildirildiğinden, sıklıklarını güvenilir bir şekilde tahmin etmek veya ilaca maruz kalma ile nedensel bir ilişki kurmak her zaman mümkün değildir.
Oral terbinafin kullanımı ile bildirilen advers olaylar şunlardır: idiyosenkratik ve semptomatik hepatik yaralanma ve, karaciğer yetmezliği vakaları, bazıları ölüm veya karaciğer nakline yol açar, ciddi cilt reaksiyonları, şiddetli nötropeni, trombositopeni, agranülositoz, pansitopeni, anemi, anjiyoödem ve alerjik reaksiyonlar (anafilaksi dahil).
Sedef hastalığı patlamaları veya sedef hastalığının alevlenmesi, akut genelleştirilmiş ekzanthematöz püstüloz ve kutanöz ve sistemik lupus eritematozusun çökelmesi ve alevlenmesi bildirilmiştir. Oral terbinafin, genellikle ilacın kesilmesinden sonraki birkaç hafta içinde iyileşen tat bozukluğuna (tat kaybı dahil) neden olabilir. Uzun süreli (bir yıldan fazla) tat bozukluğu raporları vardır. Tat bozukluklarının, gıda alımının azalmasına ve önemli ve istenmeyen kilo kaybına yol açacak kadar şiddetli olduğu bildirilmiştir.
Bildirilen diğer advers reaksiyonlar arasında halsizlik, yorgunluk, artralji, kas ağrısı, kusma, akut pankreatit, rabdomiyoliz, azalmış görme keskinliği, görme alanı kusurları ve saç dökülmesi bulunur. İlaç pazarlandığından beri kendiliğinden bildirilen advers olaylar arasında varfarin ile birlikte tedavi edilen hastalarda protrombin zamanı (uzama ve azalma) değişmektedir.

Oral terbinafin ile aşırı doz ile ilgili klinik deneyim sınırlıdır. Yetişkinlerde 5 grama kadar dozlar (terapötik günlük yetişkin dozunun 20 katı) ciddi advers reaksiyonlara neden olmadan bildirilmiştir. Doz aşımı belirtileri mide bulantısı, kusma, karın ağrısı, baş dönmesi, döküntü, sık idrara çıkma ve baş ağrısını içerir.

Lamisil ® (terbinafin hidroklorür) Oral Granüllerin farmakodinamiği bilinmemektedir.

Tinea kapitli 4 ila 8 yaş arası çocuklarda farmakokinetik, tekli ve tekrarlı bir farmakokinetik çalışmada araştırılmıştır (42 gün boyunca) Lamisil Oral Granüllerin oral uygulaması (terbinafin hidroklorür) (N = 16) günde bir kez, bölüm 2.2'de açıklanan vücut ağırlığı gruplarını ve dozlarını kullanarak. Sistemik maruziyet (Cmax ve AUC0-24) çocuklarda terbinafin nispeten yüksek bireyler arası değişkenliğe sahipti (% 36 ila% 64 arasında). Kararlı durumda AUC0-24 dozlar boyunca ortalama 1.9 ila 2.1 faktörü artmıştır. Gözlenen birikimden elde edilen ortalama (SD) etkili yarılanma ömrü, 125 mg ve 187.5 mg dozlar için sırasıyla 26.7 (13.8) saat ve 30.5 (9.3) saat idi.
Çocuklarda terbinafine sistemik maruziyet, günde bir kez 250 mg Lamisil (terbinafin) Tablet dozları alan yetişkinlerde sistemik maruziyetin en yüksek değerlerini aşmamıştır. 4-12 yaş arası çocukları ve 18-45 yaş arası yetişkinleri (N = 113) içeren oral terbinafinin popülasyon farmakokinetik değerlendirmesi, terbinafinin klerensinin (CL / F) vücut ağırlığına doğrusal olmayan bir şekilde bağlı olduğunu bulmuştur. 25 kg CL / F'lik tipik bir çocuk için 19 L / s olduğu ve 70 kg vücut ağırlığına sahip tipik bir yetişkin için 27 L / s olduğu tahmin edilmiştir. Analize dahil edilen pediatrik hastalar için ağırlık aralığı boyunca (14.1 kg-68 kg), tahmin edilen CL / F 15.6 - 26.7 L / saat arasında değişmektedir. Plazmada terbinafin plazma proteinlerine>% 99 oranında bağlanır. Boşaltmadan önce terbinafin, CYP2C9, CYP1A2, CYP3A4, CYP2C8 ve CYP2C19'un büyük katkılarıyla en az yedi CYP izoenzimi tarafından hızlı ve yoğun bir şekilde metabolize edilir. Terbinafine benzer antifungal aktiviteye sahip hiçbir metabolit tanımlanmamıştır. Uygulanan dozun yaklaşık% 70'i idrarda elimine edilir. Böbrek yetmezliği (kreatinin klerensi ≤ 50 mL / dak) veya hepatik sirozu olan yetişkin hastalarda, terbinafinin klerensi normal gönüllülere göre yaklaşık% 50 azalır.



